GLI1在结肠癌中表达及与上皮-间质转化的关系
林智平 段 炤 熊萍香 黄捷平 梅瑞平 杨德平
1.江西省中西医结合医院消化内科,江西南昌 330006;2.江西省儿童医院内科,江西南昌 330006
结肠癌(colonic cancer)是严重危害人类健康的恶性肿瘤,居全球癌症死亡最常见原因第三位,每年约有100万新发病例和超过60万的死亡病例[1]。早期结肠癌无明显症状,晚期主要表现为排便性质改变、肠梗阻及肠外转移等[2]。发生转移后患者的5年生存率<10%。上皮-间质转化(epithelial-mesenchymal-transformation,EMT)是指上皮细胞通过特定程序转化为具有间质表型细胞的生物学过程。EMT是肿瘤远处转移的关键步骤之一,Vimentin、N-cadherin表达上调,E-cadherin表达下调,进而转变为具有侵袭特性的间质型肿瘤细胞。Hedgehog/GLI1信号通路涉及多种人类肿瘤发生、发展,其异常活化已经被证实与结肠癌密切相关[3]。本实验通过免疫组化检测GLI1、Vimentin、N-cadherin、E-cadherin在结肠癌及对应癌旁组织中的表达,探讨GLI1表达与结肠癌EMT的关系,现报道如下。
1 资料与方法
1.1 一般资料
收集2010年1月~2015年12月江西省中西医结合医院胃镜下所取的50例结肠癌病理标本及其50例癌旁组织,病理标本均未接受过放疗、化疗,病理组织检查确诊为结直肠癌,其中女12例,男38例;分化程度:低分化21例,中高分化29例;TNM分期:Ⅰ+Ⅱ期17例,Ⅲ+Ⅳ期33例;淋巴结有无转移:淋巴结转移组38例,无转移组12例。本实验已经医院医学伦理研究会批准。
1.2 试剂
抗兔抗人GLI1多克隆抗体、鼠抗人Vimentin单克隆抗体、鼠抗人N-cadherin单克隆抗体、鼠抗人E-cadherin单克隆抗体、防脱挂胶玻片、苏木精染色液、SP免疫组化试剂盒、DAB试剂盒、中性树胶均购自武汉博士德公司,所有检测过程严格按照试剂盒操作说明进行。
1.3 实验过程
将石蜡切片置烤箱内30 min。经二甲苯三缸,加乙醇,入苏木精,入饱和碳酸锂溶液,伊红染色,二甲苯透明,中性树胶封片。石蜡切片脱蜡和水化后,用PBS冲洗3次。苏木素复染,PBS冲洗返蓝。用新鲜配制的DAB显色,梯度酒精脱水干燥,中性树胶封固。GLI1主要表达于细胞浆及胞核,阳性细胞<20%为阴性,≥20%为阳性[4]。 Vimentin、N-cadherin[5]、E-cadherin[6]主要表于达细胞膜和细胞浆中,阳性细胞<10%为阴性,≥10%为阳性。参考Rosano[7]的方法,EMT阳性为Vimentin表达阳性,N-cadherin表达阳性而E-cadherin表达阴性,将这一组标记为阳性。
1.4 统计学方法
采用SPSS 20.0统计学软件进行数据分析,计数资料采用率表示,组间比较采用χ2检验;GLI1表达与Vimentin、N-cadherin、E-cadherin 的表达情况以及与临床病理因素的关联性采用多因素分析,GLI1与EMT的关系采用Kendall tau-b相关分析,以P<0.05为差异有统计学意义。
2 结果
2.1 GLI1、Vimentin、N-cadherin 及 E-cadherin 表达及与病理参数的关系
GLI1在癌旁组织中的表达率为30%(15/50),低于结肠癌组织[78%(39/50)],差异有统计学意义(P<0.05)。GLI1阳性表达率与结肠癌的淋巴转移、临床分期、肿瘤分化明显相关(P<0.05),与性别、肿瘤大小无明显关系(P>0.05)。Vimentin在癌旁组织中的表达率为 16%(8/50),低于结肠癌组织[58%(29/50)],差异有统计学意义(P<0.05)。Vimentin的表达与结肠癌的肿瘤分化、TNM、及淋巴是否转移明显相关(P<0.05)。N-cadherin在癌旁组织中的表达率为12%(6/50),低于结肠癌组织[46%(23/50)],差异有统计学意义(P<0.05)。N-cadherin的表达与结肠癌的肿瘤分化、TNM、及淋巴是否转移明显相关(P<0.05)。E-cadherin在癌旁组织中的表达率为92%(46/50),高于结肠癌组织[30%(15/50)],差异有统计学意义(P<0.05)。 E-cadherin 的表达与结肠癌的肿瘤分化、TNM、及淋巴是否转移明显相关(P<0.05)(表1)。
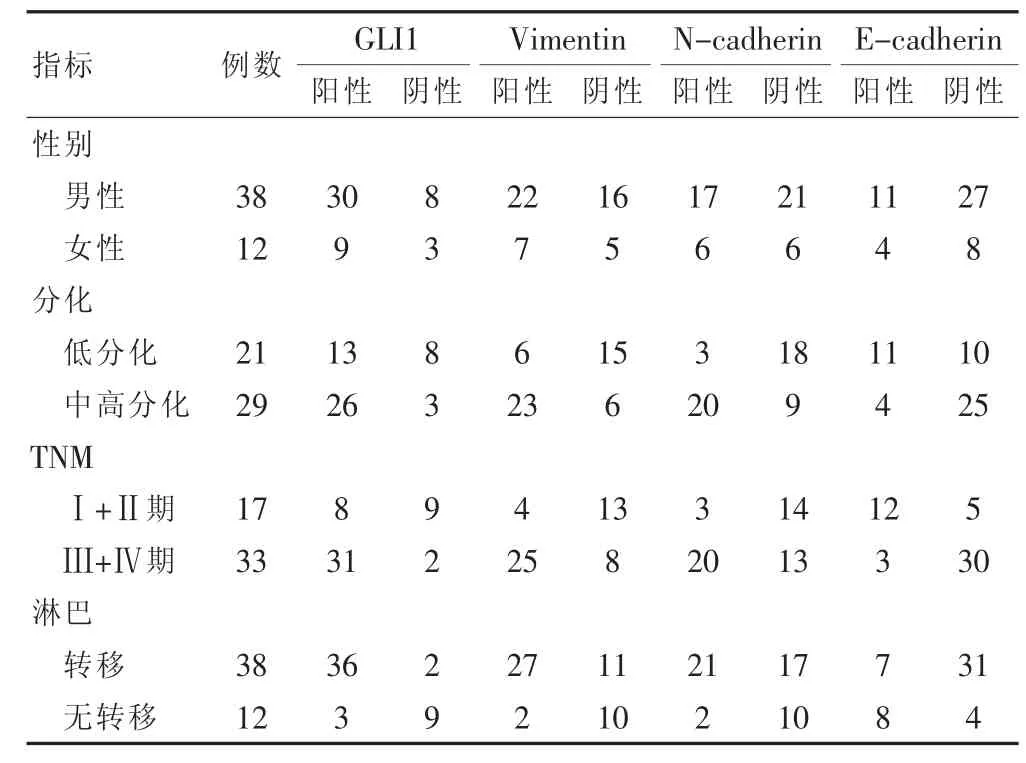
表1 GLI1、Vimentin、N-cadherin、E-cadherin 在结肠癌中的表达(例)
2.2 结肠癌组织中GLI1与EMT的关系
在50例结肠癌中,EMT阳性表达率为36%,Kendall tau-b相关分析提示,GLI1与EMT的状态成正相关(P<0.05)(表2)。
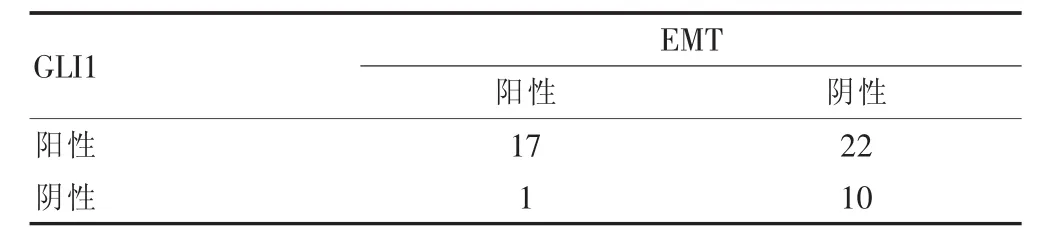
表2 GLI1与EMT的关系(例)
3 讨论
EMT是指上皮细胞在特定的生理和病理情况下向间质细胞转化的现象[8]。上皮细胞失去极性,经过细胞骨架重塑,转变成具有迁移能力的间质表型过程。其过程伴随着E-cadherin、角蛋白等上皮标志物的减少和Vimentin、纤维连接素、N-cadherin等间质标志物的增加[2]。E-cadherin主要表达于上皮细胞,通过增加肿瘤细胞的黏附能力抑制肿瘤细胞侵袭。N-cadherin主要表达于间质细胞,通过使肿瘤细胞结合于间质成分促进肿瘤细胞侵袭[9]。EMT可以增强癌症的侵袭,促进癌症的发展。曾祥岳等[10]的研究结果显示,检测E-cadherin、Vimentin表达情况能评估肿瘤细胞发生转移的潜在危险性,有助于对结直肠癌肿瘤细胞增殖能力、分化程度、恶性扩散潜能及患者预后进行判断。本研究结果提示,E-cadherin在癌旁组织中的表达率高于结肠癌组织,与结肠癌的淋巴转移、临床分期、肿瘤分化明显有关;Vimentin、N-cadherin在结肠癌中的表达率高于癌旁组织,与结肠癌的淋巴转移、临床分期、肿瘤分化明显有关。本研究结果提示,结肠癌的发生与Vimentin、N-cadherin上调及E-cadherin下调有关,与曾祥岳等[10-12]的研究结果相符。
GLI1能够激活SHH通路下游基因转录和翻译,其发生突变或者表达上调时会引起多种调控肿瘤细胞增殖、分化、转移的基因和生长因子转录和表达水平改变,最终导致肿瘤的发生和发展[13]。近期众多研究发现,GLI1参与各种肿瘤的发生过程。彭友[14]的研究显示,GLI1蛋白在结肠癌组织中的表达水平显著高于对应的癌旁组织,GLI1在淋巴结转移和高T分期的结肠癌组织中显著高表达,且GLI1是结肠癌患者术后无转移生存率的独立预后因素。柳青峰[15]的研究也显示GLI1能促进胰腺癌细胞的侵袭和转移,其研究 GLI1和 EMT相关蛋白 MMP9、E-cadherin和Vimentin在胰腺癌中的表达相关性及临床病理学意义。窦连峰等[16]的研究发现,GLI1表达上调可能在肺癌早期的发生过程中起作用。郑建涛等[17]证实GLI1及Foxml水平对胃癌转移状况及治疗预后有影响。魏凌云等[18]发现GLI1参与了食管鳞状细胞癌的发生及发展,与肿瘤的侵袭及转移密切相关。郭丽梅等[19]的研究显示,GLI1蛋白表达的阳性比例和阳性信号越高,肿瘤的浸润和侵袭行为越强,淋巴结发生转移的概率越高,TNM分期越高。本研究结果与上述研究结果相同。
GLI1蛋白的活化可能增强肿瘤细胞的侵袭和转移能力,从而促进结直肠癌的进展[19]。GLI1蛋白上调导致ER蛋白、E-cadherin蛋白表达下调相关,从而诱导EMT的高度活化,乳腺癌细胞转移游走的能力得到增强后,更容易发生腋窝淋巴结的跳跃式转移。乳腺癌中Hedgehog通路调节EMT过程的机制愈发明晰,靶向干涉或阻断Hedgehog通路[20],证实GLI1表达与EMT的状态有关。
综上所述,GLI1及 EMT中的Vimentin、N-cadherin、E-cadherin与结直肠癌患者的肿瘤分化程度、TNM临床分期、淋巴是否转移关系密切,且对患者转移的预判具有一定的临床应用价值。

