格拉斯哥预后评分和中性粒细胞/淋巴细胞比值在骨肉瘤预后评估中的作用
黄振华 杨晨 罗宇玲 邓琼 戎晓祥
1南方医科大学南方医院肿瘤内科(广州 510515);2南方医科大学第一临床医学院(广州 510515)
骨肉瘤是骨组织最常见的原发实体瘤。临床工作中发现骨肉瘤的预后差异较大,即使同样的TNM分期、同样的病理分化程度,也会具有不同的预后,这就提示我们还有其他因素影响骨肉瘤的预后。过去十几年,研究者致力于发掘影响癌症进展的因素,研究表明:全身炎症反应(system inflammation response,SIR)在癌症患者病情进展中发挥重要作用,在预测癌症患者生存中有显著意义[1-5]。SIR可通过患者的血液检测指标及基于炎症指标的评分系统反映,如C反应蛋白(CRP)、中性粒细胞计数、格拉斯哥预后评分(Glasgow prognostic score/modified GPS,GPS/mGPS)、中性粒细胞/淋巴细胞比值(neutrophil lymphocyte ratio,NLR)、血小板/淋巴细胞比值(platelet lymphocyte ratio,PLR)等。临床医生所面临的挑战是如何根据每位患者的炎症反应程度正确地评估患者的预后从而更好地将患者进行风险程度分层,为临床治疗决策提供帮助。
最近发表的一篇Meta分析结果显示GPS/mGPS和NLR对癌症的预后预测价值优于其他炎症标志物[1],并且这两个标志物(评分系统)可依据血常规和血生化检测结果而获取,不需要另外的检测,不增加患者医疗费用。据笔者所知,目前国内尚无研究评价mGPS和NLR在骨肉瘤预后评估中的作用。故本研究拟探讨mGPS和NLR在骨肉瘤预后评估中的价值,以利于临床医生对骨肉瘤患者尽早做出危险分层来指导治疗决策。
1 对象与方法
1.1 研究对象本研究收集从2008年1月1日至2016年12月31日在南方医科大学南方医院住院并经组织学病理诊断为骨肉瘤的所有患者病例资料。入组标准:(1)一线化疗方案为AP(多柔吡星45 mg/m2d1~2+顺铂75~100 mg/m2d1或分3 d)或MAP(大剂量甲氨蝶呤8~12 g/m2+多柔吡星45 mg/m2d1~2+顺铂75~100 mg/m2d1或分3 d),至少接受6周期的化疗方案;(2)接受新辅助化疗、手术切除和辅助化疗(除非在术前化疗时期发生转移而失去手术机会)。值得注意的是,那些接受少于6周期化疗而发生死亡或出现病情进展而中断治疗的病例也要入选研究组。最终,本研究抽取了103例有随访记录的患者,其中男63例(61.2%),女40例(38.8%)。男∶女=1.575∶1;患者的年龄4~64岁,中位值17岁,平均22.37岁。其中,年龄>40岁者仅占13.6%。本次临床研究项目符合人体试验伦理学标准并获得本单位伦理委员会的批准。所有入组病例均获取患者或患者家属所签署的知情同意文件。
1.2 研究方法回顾性记录以下患者信息:性别、年龄、肿瘤部位、肿瘤大小、初诊时是否发生远处转移、手术方式(保肢术或截肢术)、与全身炎症反应相关的血液化验结果(CRP、血清白蛋白、白细胞计数、中性粒细胞计数、淋巴细胞计数、血小板计数)、诊断时间、复发或第一次疾病进展时间、死亡时间等。血液化验数据采自治疗开始前的血液样本。mGPS系统评分标准如下:CRP升高(>10 mg/L)伴有低蛋白血症(<35 g/L)者记为2分,CRP升高且白蛋白正常者记为1分,CRP正常者记为0分[3]。NLR为中性粒细胞计数与淋巴细胞计数比值。
1.3 随访及观察指标本研究对入组患者进行门诊随访或电话随访,随访截止日期为2017年10月31日。中位随访时间为43个月。主要观察指标为总生存期(overall survival,OS),定义为从确诊日期至任何原因引起死亡的日期或末次随访的时间。次要观察指标为无事件生存期(event-free survival,EFS),定义为从确诊日期至疾病复发或进展或死亡(以先发生的计算)或末次随访的时间。
1.4 统计学方法利用独立样本t检验或Mann-Whitney检验分析NLR和临床病理特征的相关性,χ2检验分析mGPS和临床病理特征的相关性。连续变量NLR做ROC曲线分析,根据最大约登指数选定NLR的最佳界值(cut-off point)。生存分析采用Kaplan-Meier方法并绘制生存曲线,显著性检验采用Log-rank检验。Cox回归单因素分析中显著性检验(P≤0.10)的变量用Cox比例风险回归模型作多因素分析。列线图采用R3.4.3软件构建,采用c-index评价预测精确度。所有的统计学分析采用SPSS 22.0统计软件处理,P<0.05为差异具有统计学意义。
2 结果
2.1 临床病理特征与NLR、mGPS的相关性分析性别(P=0.898)、年龄(P=0.322)、肿瘤部位(P=0.056)、肿瘤大小(P=0.512)、初诊时有无转移(P=0.082)、手术方式(P=0.655)与NLR无显著相关性(表1);不同mGPS组间,性别(P=0.039)、年龄(P=0.000)、肿瘤部位(P=0.030)差异具有统计学意义,而肿瘤大小(P=0.551)、初诊时有无转移(P=0.635)、手术方式(P=0.261)差异无统计学意义(表2)。
2.2 NLR和mGPS的AUC和NLR界值以OS作为观察终点时,NLR和mGPS的AUC值分别为0.651和0.603(图1A),NLR的最佳界值是2.70(敏感性66%,特异性63%);同样地以EFS作为观察终点时,NLR和mGPS的AUC值分别为0.621和0.645(图1B),NLR的最佳界值是3.03(敏感性80%,特异性54%)。分别根据OS和EFS的NLR最佳界值划分为高NLR组(大于或等于最佳界值)和低NLR组(小于最佳界值)。
2.3 OS和EFS的预后因子分析OS的单因素分析中,肿瘤部位(P=0.001)、初诊时有无转移(P=0.001)、NLR(P=0.007)和 mGPS(P=0.004)是影响骨肉瘤OS的相关因素,而性别、年龄、肿瘤大小、手术方式对骨肉瘤的OS没有显著性影响;进一步用Cox比例风险回归模型作多因素分析,结果显示肿瘤部位(P=0.023)、初诊时有无转移(P=0.000)、NLR(P=0.011)和 mGPS(P=0.007)是骨肉瘤患者OS的独立预后因子(表3)。

表1 临床病理特征与NLR之间的相关性分析Tab.1 The relationship between clinical characteristics and NLR

图1 NLR和mGPS的ROC曲线Fig.1 ROC curve of NLR and mGPS
EFS的单因素分析中,肿瘤部位(P=0.012)、初诊时有无转移(P=0.033)、NLR(P=0.007)和mGPS(P=0.003)对骨肉瘤EFS有预测价值,而性别、年龄、肿瘤大小、手术方式跟患者EFS无显著相关性;多因素分析结果显示初诊时有无转移(P=0.029)、NLR(P=0.032)和 mGPS(P=0.014)仍具有统计学差异,而肿瘤部位(P=0.093)不是EFS的独立预后因子(表4)。比较而言,低NLR和低mGPS具有更优的总生存时间和无事件生存时间(图2)。

表2 临床病理特征与mGPS之间的相关性分析Tab.2 The relationship between clinical characteristics and mGPS 例
2.4 Nomogram预后评分系统根据Cox比例风险回归模型多因素分析结果,用列线图对OS和EFS根据独立预后因子做预后预测模型(图3)。通过列线图可以计算出患者3年和5年总生存率、2年和3年EFS。OS和EFS相应的一致性指数(C-index)分别是0.689和0.685。
3 讨论
本研究表明mGPS和NLR是骨肉瘤患者OS和EFS的独立预后因子,同时研究显示肿瘤部位和初诊时有无转移是骨肉瘤的独立预后影响因素,这与此前一些研究报道结论一致[6-7]。
与GPS相比,mGPS能更准确预测癌症患者预后,因此本研究中采用的是改良版格拉斯哥预后评分(mGPS)。此前有大量的研究证实了mGPS在肺癌、胃癌、胰腺癌、直肠癌、淋巴瘤、胆管癌、血液系统肿瘤、前列腺癌、肾癌、肝细胞癌、宫颈癌等肿瘤中的预后作用[1],而本研究首次证明了mGPS在骨肉瘤中的预后价值。从图2可以发现:随着mGPS评分的升高,骨肉瘤患者的OS和EFS显著下降,生存曲线差距显著,P值提示差距具有统计学意义。这与其他学者的研究报道一致[8-10]。

表3 影响骨肉瘤总生存期的单因素和多因素分析Tab.3 Univariate and mutilvariate analyses for OS in osteosarcoma patients

表4 影响骨肉瘤无事件生存期的单因素和多因素分析Tab.4 Univariate and mutilvariate analyses for EFS in osteosarcoma patients

图2 根据mGPS和NLR水平的骨肉瘤患者的总生存期和无事件生存期的生存曲线Fig.2 Survival curves of(A and B)OS and(C and D)EFS in the osteosarcomas
另一类研究较多的SIR标志物是由循环血白细胞计数组合而成的联合标志物包括NLR、PLR和LMR,其中NLR得到一致性验证成功率最高[1]。本研究中以AUC曲线计算的约登指数最大值作为最佳界值(cut-off point)将NLR划分为低NLR组和高NLR组,结果显示:与低NLR组患者比较,高NLR组患者具有更差的OS和EFS,风险比分别为2.060和1.688,均具有统计学差异。这一结果也与国内外学者研究结论一致[11-14]。
在以肿瘤部位、初诊时有无转移、NLR和mGPS 4个独立危险因素构建的列线图模型中,分数越高表明预后越差,C-index指数接近0.7,表明该列线图预测模型具有良好的区分度与准确性,可以对骨肉瘤的预后进行有效评估的预测。
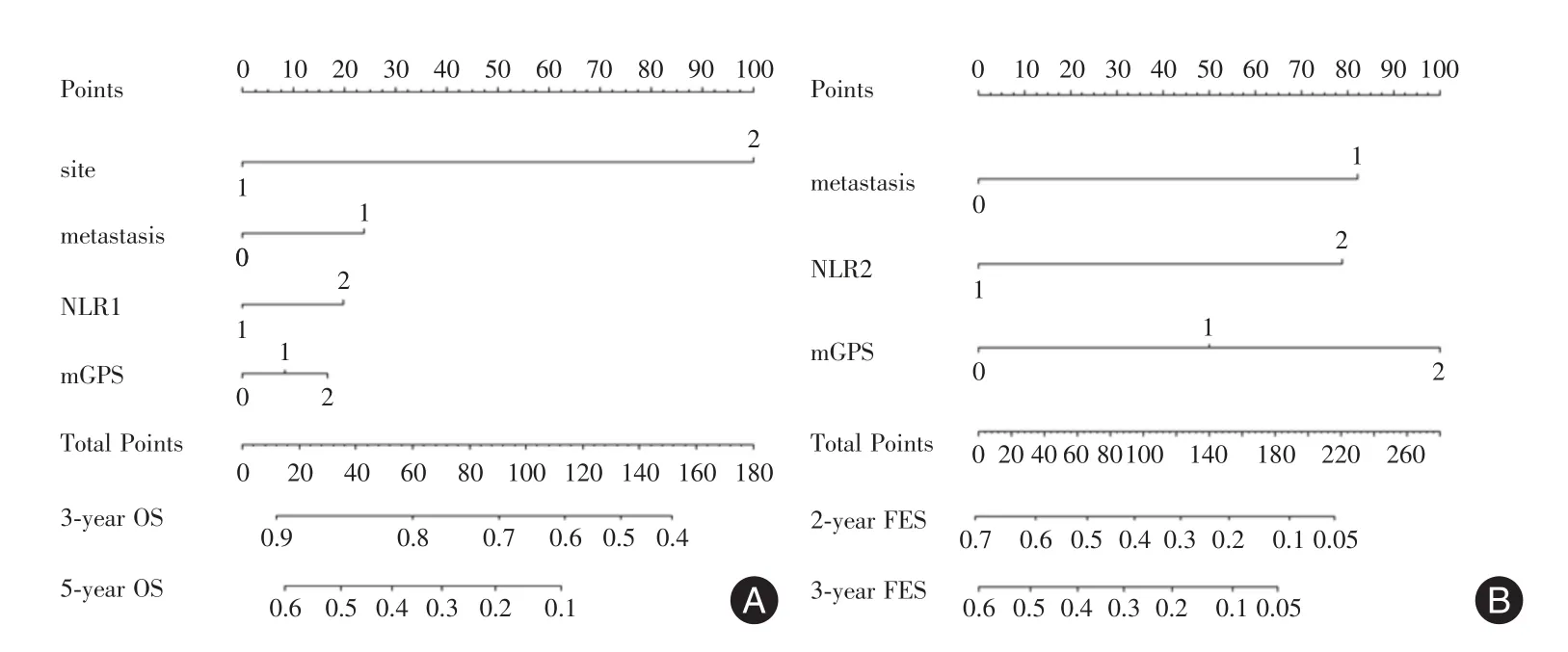
图3 预测骨肉瘤的总生存期(A)和无事件生存期(B)的NomogramFig.3 Osteosarcoma survival nomogram for(A)OS and(B)EFS
本研究选取的是在全世界一致成功验证率最高的两个SIR标志物:mGPS和NLR。其中,NLR的划分界值在不同的国家地区、不同的人种中差别较大,而NLR的检测是客观的,如此大差异的原因可能跟遗传和环境因素有关。AZAB等[15]报道了一篇含有>9 000例患者的综述,在美国患者人群中NLR具有种族差异,总体人群的平均NLR是2.15,黑人是1.76,西班牙裔是2.08,白种人是2.24。同时,糖尿病、心血管疾病、吸烟和高BMI患者具有更高的NLR。而GPS/mGPS就不存在这种差异,因为GPS/mGPS具有国际公认的系统评分标准,这种评分系统简单、客观、容易标准化。因此在癌症患者的随机临床试验中可重复性更好。GPS/mGPS成为一个最容易被广泛验证的标志物。而SIR的这种预后价值,使肿瘤的预后不仅由肿瘤本身的TNM分期决定而且还受宿主SIR的影响。
虽然本研究选取了治疗方案几乎一致的患者,以尽可能减小治疗相关的偏倚从而使得分析结果更可靠、可信。但是需要指出的是,仍然存在一些不足。本研究是单中心、回顾性研究,而且样本量较小,目前的研究结论需其他中心、大样本的前瞻性随机临床试验进一步验证。
综上,本研究以骨肉瘤患者为研究对象,研究全身炎症反应的预后价值。结果显示mGPS和NLR都是骨肉瘤的独立预后因子,高mGPS和高NLR具有较差的OS和EFS。其他的独立预后因子还包括肿瘤部位和初诊时是否发生转移。

