NF-κB通路在自身免疫性甲状腺炎发病过程中的作用
祁岗 朱艳媚 李焱 李玉娟 罗世文 李曼
1青海省人民医院(西宁810007);2青海大学医学院(西宁810016)
自身免疫性甲状腺疾病(autoimmune thyroid disease,AITD)是病变部位主要发生在甲状腺的器官特异性自身免疫性疾病[1],主要包括Graves病(GD)和桥本甲状腺炎(Hashimotos thyroiditis,HT)。AITD的发病机制尚未完全清楚,而越来越多的研究发现甲状腺细胞炎症相关信号转导异常、炎症反应失衡与自身免疫性甲状腺疾病有很大的关系[2-3]。研究发现在AI组织中,TNF-α、IL-1β、IFN-γ等炎症因子高表达[4],其中 TNF-α 是NF-κB 通路的激活因子和效应子,其表达变化即受到NF-κB信号通路的调控,同时反过来又去调控NF-κB通路,二者相互调控形成正反馈环,加重炎症[5]。作为重要的炎症信号通路,NF-κB通路在多种炎症疾病中异常激活,与炎症发生发展密切相关[6-7],已经发现在甲状腺癌组织及其细胞中NF-κB通路异常激活,促进甲状腺癌的发展[8-9],但是其在AITD发病过程中的作用并未被阐明。为此本研究将以NF-κB通路作为基础,研究自身免疫性甲状腺炎发病的分子机制,为临床治疗AITD提供一定的理论依据。
1 材料与方法
1.1 材料昆明小鼠,清洁级,雌性,6~8周,体质量18~22 g,购买自兰州大学动物实验中心,许可证号:SYXK(甘)2015-0005。CBA/j小鼠,清洁级,雌性,5~6周,体质量16~20 g,购买自北京华阜康生物科技股份有限公司,许可证号:SCXK(京)2014-0004。
上述小鼠均在在相对恒定温度和相对湿度(25~27℃、40%~50%)条件下,12 h自然采光,按照清洁级标准采用标准饲料进行饲养。小鼠适应性饲养1周后,观察无异常表现者即可入组进行实验研究。该饲养条件贯穿整个实验过程。标准饲料购买自北京科澳协力饲料有限公司,Sephadex G-200凝胶购买自索莱宝生物科技有限公司,完全弗氏佐剂(complete Freund′s adjuvant,CFA)和弗氏不完全佐剂(Freund incomplete adjuvant,FIA)购买自北京索莱宝生物科技公司,TNF-α ELISA试剂盒购买自上海酶联生物科技有限公司,SP9001免疫组化试剂盒、RIPA裂解液、超敏型ECL检测试剂、SDS-PAGE凝胶配制试剂盒、SDSPAGE蛋白上样缓冲液、SDS-PAGE电泳液以及蛋白质印迹转膜液均购自上海碧云天生物技术有限公司;NF-κB、IKK抗体均属于兔单克隆抗体,皆购自Abcam公司;HRP标记的山羊抗兔IgG购买自CST公司,Trizol、逆转录试剂盒、实时定量PCR试剂盒购买自Takara,引物有Takara公司。引物信息:TNF-α:上游5′-CCTCTAGCCCACGTCGTAGC-3′,下游5′-AGCAATGACTCCAAAGTAGACC-3′;Bcl-2:上游5′-TGACCCGCAGCAAGAAAGTG-3′,下游 5′-ATCTGTGGAGAAGACAGCTA-3′;ICAM-1:上游 5′-GACCACGGAGCCAATTTCTCA-3′,下游5′-TCCAGTTCCCCAAGCAGTCC-3′;β-actin:上游5′-TGGAATCCTGTGGCATCCATGAAAC-3′,下游 5′-TAAAACGCA GCTCAGTAACAGTCCCG-3′。
1.2 方法
1.2.1 mTg蛋白纯化将昆明小鼠的甲状腺置于4℃预冷的0.01 mmol/L的PBS中,研磨成匀浆液后,4℃3 000 r/min,离心30 min,取上清再经4℃10 000 g,离心1 h后,经饱和度为42%、37%和42%硫酸铵3次沉淀,PBS重悬,4℃充分透析48 h,换液6次,去除硫酸铵,透析后冻干,进行Sephadex G-200凝胶层析纯化,将纯化后的收集物用蒸馏水透析,聚乙二醇20000反透浓缩,冷冻干燥,将上述方法再次进行凝胶层析。最后将mTg冷冻干燥,保存于-70℃冰箱。
1.2.2 mTg蛋白鉴定将纯化的蛋白加入4×上样缓冲液,煮沸变性后,加到4%浓缩胶浓缩,10%分离胶分离,然后用考马斯亮蓝R250染色,根据条带的分子量鉴定是否为甲状腺球蛋白。
1.2.3 动物饲养及造模参照文献[10]进行造模:于8周龄时,将CBA/j小鼠随机分为两组,每组10只,其中对照组(control组)给予水+CFA,模型组(mTg组)给予100 μg/鼠的mTg+CFA皮下注射初次免疫,10周龄时模型组再给予相同mTg+FIA重复免疫1次,14周龄时处死小鼠,取血清及甲状腺组织进行检测,并参照HE染色结果对模型进行评价。
1.2.4 HE染色摘取甲状腺组织,PBS洗涤后,4%多聚甲醛固定1周后,经脱水后,石蜡包埋,切成4 μm切片,进行HE染色。光镜下观察甲状腺组织的炎症细胞(包括淋巴细胞、浆细胞、嗜中性粒细胞)浸润程度,EAT炎症分级标准:<1级为正常,≥ 1、< 2级为轻度,≥ 2、< 3级为中度,3~4级为重度。
1.2.5 ELISA实验眼球取血后,将血液于室温放置30 min,待其凝固后,3 000 r/min离心10 min,取血清,按照说明书进行ELISA实验,450 nm波长测量各孔OD值。
1.2.6 qPCR实验用Trizol法提取甲状腺组织总mRNA,然后按照Takara反应试剂盒依次经过去除基因组DNA反应、反转录反应和qPCR进行扩增,扩增程序为:预变性:95℃、10 min、1循环数;扩增:95 ℃、15 s,60 ℃、15 s,72 ℃、30 s、40循环数。
1.2.7 Western bloting实验甲状腺组织中加入RIPA裂解液,置于冰上研碎至匀浆后,4℃放置30 min,13 000 r/min离心10 min,取一部分上清,BCA试剂盒检测蛋白浓度,另一部分上清加入4×上样缓冲液,煮沸变性后,进行SDS-PAGE凝胶电泳,经4℃孵育一抗、室温孵育二抗、ECL发光液显色、X医用胶片显影、定影等步骤,最后进行拍照分析。
1.2.8 免疫组化实验按照SP免疫组化试剂盒说明书进行实验。甲状腺组织切片经过抗原热修复、封闭、依次孵育一抗、生物素标记的二抗、辣根过氧化物酶标记的链霉卵白素后,DAB显色液显色,至显色程度适宜,终止反应。苏木素复染2 min,用自来水冲洗切片,盐酸酒精分色,洗涤后,将切片脱水、二甲苯透明,中性树胶封片,晾干后拍照分析。
1.3 统计学方法数据分析采用SPSS 21.0软件包,多组间比较用单因素方差分析,组间两两比较采用LSD-t检验,均以P<0.05为差异具有统计学意义。
2 结果
2.1 蛋白纯化及鉴定由图1可知,在纯化mTg过程中,图1A中第一个峰代表丙酮分子,单一平滑表明柱子安装合格。第二个峰图代表分离纯化的甲状腺球蛋白,文献报道在甲状腺中,甲状腺球蛋白分子量是最大的,因此第二个峰推测即为甲状腺球蛋白,进行收集。为验证是否为甲状腺球蛋白,进行SDS聚丙烯酰胺凝胶电泳,图1B中三条带为稀释不同浓度的收集的纯化蛋白,根据分子量显示分析为甲状腺球蛋白且蛋白纯度较高,达到实验动物造模的要求。
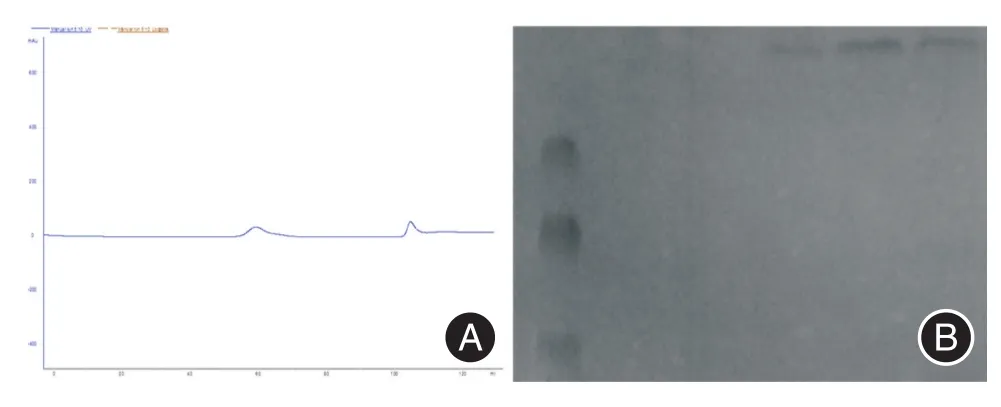
图1 甲状腺球蛋白的纯化与鉴定Fig.1 Purification and identification of thyroglobulin
2.2 病理变化与Control组相比,mTg组甲状腺组织可见甲状腺滤泡体积变小,数量明显增多,形状不规则,滤泡间壁膜增厚,细胞增多,可见大量炎症细胞浸润。评分后,mTg组甲状腺组织炎症严重程度均达到3级以上,可见10%~40%的甲状腺组织被炎症细胞取代;或超过40%的甲状腺组织被炎症细胞取代。见图2。
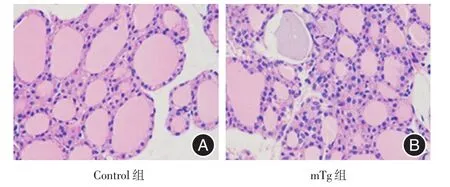
图2 甲状腺组织病理变化Fig.2 Pathological changes in thyroid tissue
2.3 血清中TNF-α含量变化与对照组相比,mTg组血清中TNF-α含量显著上升,差异具有统计学意义(P<0.01)。见表1、图3。
2.4 甲状腺组织中TNF-α、Bcl-2、ICAM-1 mRNA变化与对照组相比,mTg组甲状腺组织中TNF-α mRNA、Bcl-2 mRNA、ICAM-1 mRNA表达明显增加,差异具有统计学意义(P<0.01)。见表2、图4。
表1 小鼠血清中TNF-α浓度变化Tab.1 Changes of TNF-α levels in mice serum ±s,ng/L

表1 小鼠血清中TNF-α浓度变化Tab.1 Changes of TNF-α levels in mice serum ±s,ng/L
注:与Control组比较,**P <0.01
分组Control组mTg组TNF-α 83.37±11.39 185.42±13.36**
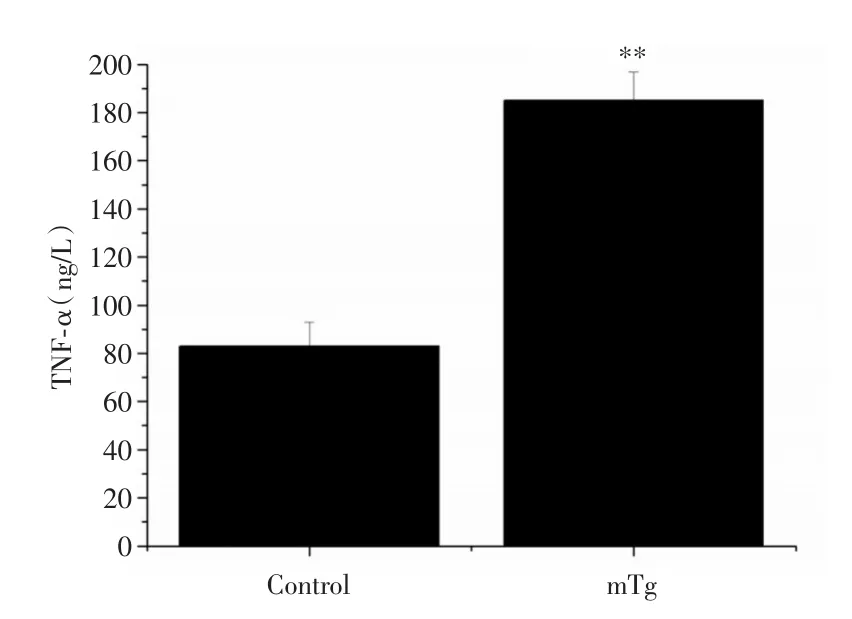
图3 小鼠血清中TNF-α浓度变化Fig.3 Changes of TNF-α levels in mice serum
表2 各组小鼠甲状腺组织中TNF-α、Bcl-2、ICAM-1 mRNA变化Tab.2 Changes of TNF-α,Bcl-2 and ICAM-1 mRNA level in thyroid tissue ±s

表2 各组小鼠甲状腺组织中TNF-α、Bcl-2、ICAM-1 mRNA变化Tab.2 Changes of TNF-α,Bcl-2 and ICAM-1 mRNA level in thyroid tissue ±s
注:与Control组相比,**P<0.01
分组Control组mTg组TNF-α 1.00±0.00 2.38±0.13**Bcl-2 1.00±0.00 2.11±0.12**ICAM-1 1.00±0.00 2.24±0.13**
2.5 甲状腺组织中NF-κB蛋白变化与对照组相比,mTg组甲状腺组织中NF-κB蛋白表达明显增加,差异具有统计学意义(P<0.01)。见表3、图5。
表3 各组小鼠甲状腺组织中NF-κB蛋白表达变化Tab.3 Changes of NF-κB protein in thyroid tissue ±s

表3 各组小鼠甲状腺组织中NF-κB蛋白表达变化Tab.3 Changes of NF-κB protein in thyroid tissue ±s
注:与Control组相比,**P<0.01
分组Control组mTg组NF-κB 0.52±0.07 0.93±0.11**
2.6 甲状腺组织中IKK蛋白变化与对照组相比,mTg组甲状腺组织中IKK蛋白表达明显增加,差异具有统计学意义(P<0.05)。见图6。
3 讨论

图4 甲状腺组织中TNF-α、Bcl-2、ICAM-1 mRNA变化Fig.4 Changes of TNF-α,Bcl-2 and ICAM-1 mRNA level in thyroid tissue
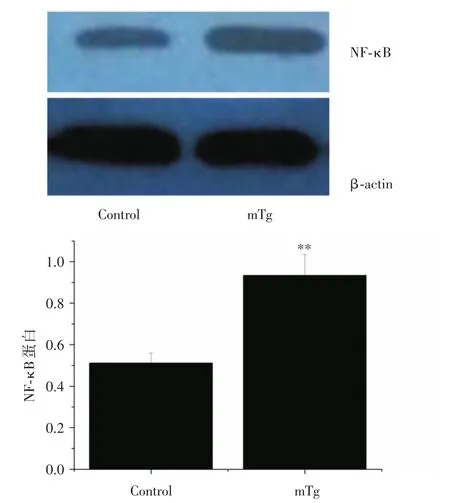
图5 甲状腺组织中NF-κB蛋白变化Fig.5 Changes of NF-κB protein in thyroid tissue

图6 甲状腺组织中IKK蛋白变化Fig.6 Changes of IKK protein in thyroid tissue
为了给临床治疗提供一定的理论依据,本研究通过建造自身免疫性甲状腺炎模型探索其发病机制,在造模过程中用CBA/j小鼠,采用多次注射mTg进行免疫的造模方法,建造自身免疫性甲状腺炎模型。HE染色结果发现模型组小鼠在造模完成后,甲状腺组织中大量炎症细胞浸润,导致滤泡明显增多,体积减小,泡间壁厚度增厚,滤泡呈明显不规则样,可见明显的发炎症状,提示造模成功。
AITD作为免疫性疾病,其发病多与免疫细胞、免疫因子及其免疫相关信号通路相关。近年来研究发现,在甲状腺血管中TGF-β、TNF-α、IL-1α、IL-8等炎症因子的高表达,促进了甲状腺的炎症介质、黏附分子、趋化因子和一些相关酶类的过度或持续表达[11-12],与本研究结果一致,在自身免疫性甲状腺疾病模型鼠血清中TNF-α含量明显增加。TNF-α作为最重要的炎症介质之一,其高表达不仅导致炎症部位细胞释放大量炎症介质和趋化因子,同时激活体内的炎症细胞,加重炎症[13]。TNF-α可激活体内多条炎症相关信号通路[13],包括NF-κB信号通路,同时TNF-α基因含有NF-κB的特异性结合位点,即TNF-α的表达可受NF-κB的调控,因此TNF-α与NF-κB信号通路可形成正反馈环[15],相互促进,使炎症进一步加重。这种正反馈环在很多疾病中被发现,参与疾病的炎症反应。在本研究中发现NF-κB在模型组小鼠甲状腺组织中表达显著升高,同时作为NF-κB的激活因子IKK的表达在模型组甲状腺组织中同样显著升高,以上提示NF-κB信号通路在自身免疫性甲状腺模型组织中被激活。其可能与TNF-α形成正反馈环,促进AITD的发生发展,但具体机制还需进一步实验证实。激活的NF-κB不仅调控TNF-α的表达,同时可启动下游与凋亡、存活、增殖、迁移等相关蛋白的表达,广泛参与炎症反应、免疫应答、细胞增殖和细胞凋亡等多种生理、病理过程的基因调控[16],其中凋亡相关蛋白Bcl-2以及黏附迁移相关蛋白ICAM-1基因的启动子中皆含有NF-κB转录因子识别结合序列,二者受NF-κB的激活调控[17-18]。已有研究表明在炎症组织中Bcl-2高表达抑制炎症细胞凋亡,促进细胞增殖,加重炎症[19],而ICAM-1在炎症组织中高表达可促进炎症细胞的浸润[20],研究发现在炎症过程中血管内皮细胞表达的ICAM-1不仅介导淋巴细胞与血管内皮细胞的黏附,促使淋巴细胞向炎症部位浸润并释放多种炎性因子,而且炎症组织中炎性因子又可刺激诱导血管内皮细胞表达ICAM-1,从而促使更多的细胞向炎症部位迁移[21]。本研究发现模型组小鼠甲状腺组织中Bcl-2 mRNA、ICAM-1 mRNA高表达,提示其可促进AITD炎症的发生、发展,并且其高表达可能是由NF-κB的异常表达造成的。
综上可知在自身免疫性甲状腺炎发病过程中,NF-κB通路异常激活,并与TNF-α形成正反馈环导致NF-κB通路持续激活,启动Bcl-2和ICAM-1基因表达,促使炎症细胞增殖、浸润至甲状腺组织,促进AITD的发生发展。

