转录因子FoxO1对神经母细胞瘤侵袭迁移和上皮-间质转化的影响及其机制
何霞 刘铭
西南医科大学附属医院儿外科(四川泸州646000)
神经母细胞瘤(neuroblastoma,NB)是儿童常见肿瘤性疾病,起源于胚胎期神经嵴细胞。NB具有很高异质性,由于肿瘤生长迅速、易转移及恶性程度高等特点[1],导致临床治疗效果不佳。目前NB治疗主要包括手术、放疗、化疗、造血干细胞移植和诱导分化等治疗手段,但出现转移的患者生存率极低[2-3]。因此,探究影响神经母细胞瘤转移的分子机制对于提高生存及预后具有重要意义。
FoxOs转录因子家族包括FoxO1、FoxO3、FoxO4和FoxO6,影响细胞增殖、凋亡和细胞分化等生物学行为,在生长发育过程中起到重要作用[4]。FoxOs家族在哺乳动物大脑发育过程中广泛表达[5],最新研究[6]发现FoxOs家族在神经元极性发育过程中发挥重要功能。FoxO1功能失调在多种肿瘤疾病中均有发现,DONG等[7]发现FoxO1抑制肝癌侵袭转移及上皮-间质转化。此外,FoxO1在胃癌[8]、肺癌[9]及恶性胶质瘤[10]等肿瘤性疾病中发挥抑制侵袭转移的功能。然而,FoxO1对NB侵袭转移及上皮-间质转化(epithelial-mesenchymal transition,EMT)的影响确未曾报道,同时其潜在的分子机制未知,因此本研究通过体外实验探究FoxO1对神经母细胞瘤细胞侵袭转移及上皮-间质转化的影响并揭示其机制,为NB靶向治疗提供新思路。
1 材料与方法
1.1 材料人神经母细胞瘤细胞系IMR-32和SHSY5Y购自中国科学院昆明细胞库;DMEM/F12培养基和1640培养基购自美国Gibco公司,胎牛血清购自杭州四季青公司;FoxO1过表达慢病毒和FoxO1 shRNA慢病毒购自上海吉玛公司,FoxO1 shRNA序列:5′-CCGGGCCTGTTATCAATCTGCTAAACTCGAGTTTAGCAGATTGATAACAGGCTTTTTG-3′。FoxO1和E-cadherin单克隆抗体购自美国abcam公司,N-cadherin、Vimentin和ZEB2单克隆抗体购自美国CST公司,GAPDH多克隆抗体购自沈阳万类生物科技有限公司。
1.2 细胞培养及慢病毒转染人神经母细胞瘤细胞系IMR-32和SH-SY5Y分别培养于含10%胎牛血清的1640培养基和DMEM/F12培养基,加入100 μg/mL 的青霉素/链霉素,细胞置于 5%CO2、37℃培养箱中培养。细胞每隔2~3天进行细胞换液,待细胞生长至80%~90%密度时使用胰酶消化离心,进行细胞传代培养。FoxO1过表达和FoxO1 shRNA慢病毒预实验感染确定IMR-32和SH-SY5Y细胞MOI值,加入5 μg/mL的polybrene和相同病毒数慢病毒转染细胞,放置于培养箱继续培养48 h,加入2~3 μg/mL嘌呤霉素筛选3周,使用qRT-PCR和免疫印迹法(Western-blot)检测FoxO1 mRNA和蛋白表达情况,确定转染及筛选效率。
1.3 siRNA细胞转染细胞正常消化离心,1.0×105/孔接种于6孔板内,调节siRNA浓度为20 μmol/L,转染前使用无血清DMEM/F12培养液清洗细胞,按X-treme GENE HP siRNA Transfection Reagent说明书将无血清培养基、siRNA或对照组Control siRNA及转染试剂混合静置15 min后转染细胞,继续细胞培养48 h检测转染效率。
1.4 Transwell细胞迁移和侵袭实验胰酶消化对数生长期的细胞,用PBS和无血清培养基先后洗涤一次,用无血清培养基悬浮细胞,计数并调整浓度为1.5×105/mL,下室加入800 μL含10%胎牛血清的细胞培养基,上室加入200 μL无血清细胞悬液,放置于37℃、5%CO2培养箱中培养24 h。将小室用PBS清洗后使用4%多聚甲醛固定20 min,再置于0.1%的结晶紫溶液中染色30 min,取出用PBS清洗,并用棉签擦掉上室未穿膜的细胞,随机挑选5个不同视野于100倍光学显微镜下拍照并计数穿膜细胞数。
侵袭实验前4~6 h使用matrigel基质胶50 μL包被滤膜孔径为8 μm的Transwell小室,并放置于培养箱。细胞侵袭实验参照迁移实验进行铺板,计数并调整浓度为2.0×105/mL,48 h后染色记录并拍照。
1.5 qRT-PCR检测mRNA表达细胞正常消化离心按4.0×105/孔接种于6孔板,进行不同细胞处理。PBS清洗细胞3遍,加入细胞裂解液并置于冰上1 min,使用上海飞捷生物RNA提取试剂盒提取不同处理总RNA,紫外分光光度计进行定量。按照TaKaRa PrimeScriptTMRT Master Mix反转录试剂盒说明进行反转录获得cDNA,mRNA表达检测使用TaKaRa SYBR@PrimixEx TaqTMⅡ反应体系,FoxO1上游引物序列为:5′-TCGTCATAATCTGTCCCTACACA-3′,下游引物序列为:5′-CGGCTTCGGCTCTTAGCAAA-3′;ZEB2上游引物序列为:5′-CAAGAGGCGCAAACAAGCC-3′,下游引物序列为:5′-GGTTGGCAATACCGTCATCC-3′。使用GAPDH作为内参,上游引物序列为:5′-GGAGCGAGATCCCTCCAAAAT-3′,下游引物序列为:5′-GGCTGTTGTCATACTTCTCATGG-3′。mRNA的表达水平采用2-△△Ct计算方法进行分析。
1.6 免疫印迹法(Western blot)检测相关蛋白表达细胞胰酶消化离心后传代,4.0×105/孔种于6孔板内进行不同处理。取出并弃去上清,用PBS冲洗3遍加入细胞裂解液并置于冰上静置1 min,刮下裂解物并转移至1.5 mL离心管,震荡混匀30 s,冰上静置10 min。15 000 r/min离心15 min,吸取上清总蛋白。留取5 μL定量,加入6×Loading buffer后于沸水中煮沸5 min进行蛋白变性处理。30 μg蛋白上样,使用10%SDS-PAGE凝胶进行电泳分离,110 V×2 h转膜至硝酸纤维素膜。5%脱脂奶粉将膜封闭1 h,置于特定一抗4℃摇床上孵育过夜。使用TBST洗膜液10 min×3次,置于相应的二抗,常温摇床慢速孵育1 h,10 min×3次洗膜后使用ECL显影液进行显影,目的蛋白表达量通过与内参蛋白GAPDH标准化后得到相对比值。
1.7 统计学方法应用SPSS 18.0统计软件处理数据,数据以均数±标准差表示,组间差异采用t检验,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 过表达FoxO1抑制细胞侵袭转移能力使用FoxO1过表达慢病毒感染IMR-32细胞,构建FoxO1过表达稳转细胞系,通过Western blot(图1A)和qRT-PCR(图1B)检验FoxO1蛋白和mRNA表达,成功构建FoxO1过表达细胞系。使用Transwell小室检测细胞迁移和侵袭能力改变(图1C、图1D),IMR-32细胞对照组迁移和侵袭细胞数分别为(187±5.438)和(278±10.343),IMR-32过表达FoxO1组迁移和侵袭细胞数分别为(96±7.970)和(147±9.564),差异均有统计学意义(均P<0.001),表明FoxO1过表达抑制IMR-32细胞侵袭转移能力。
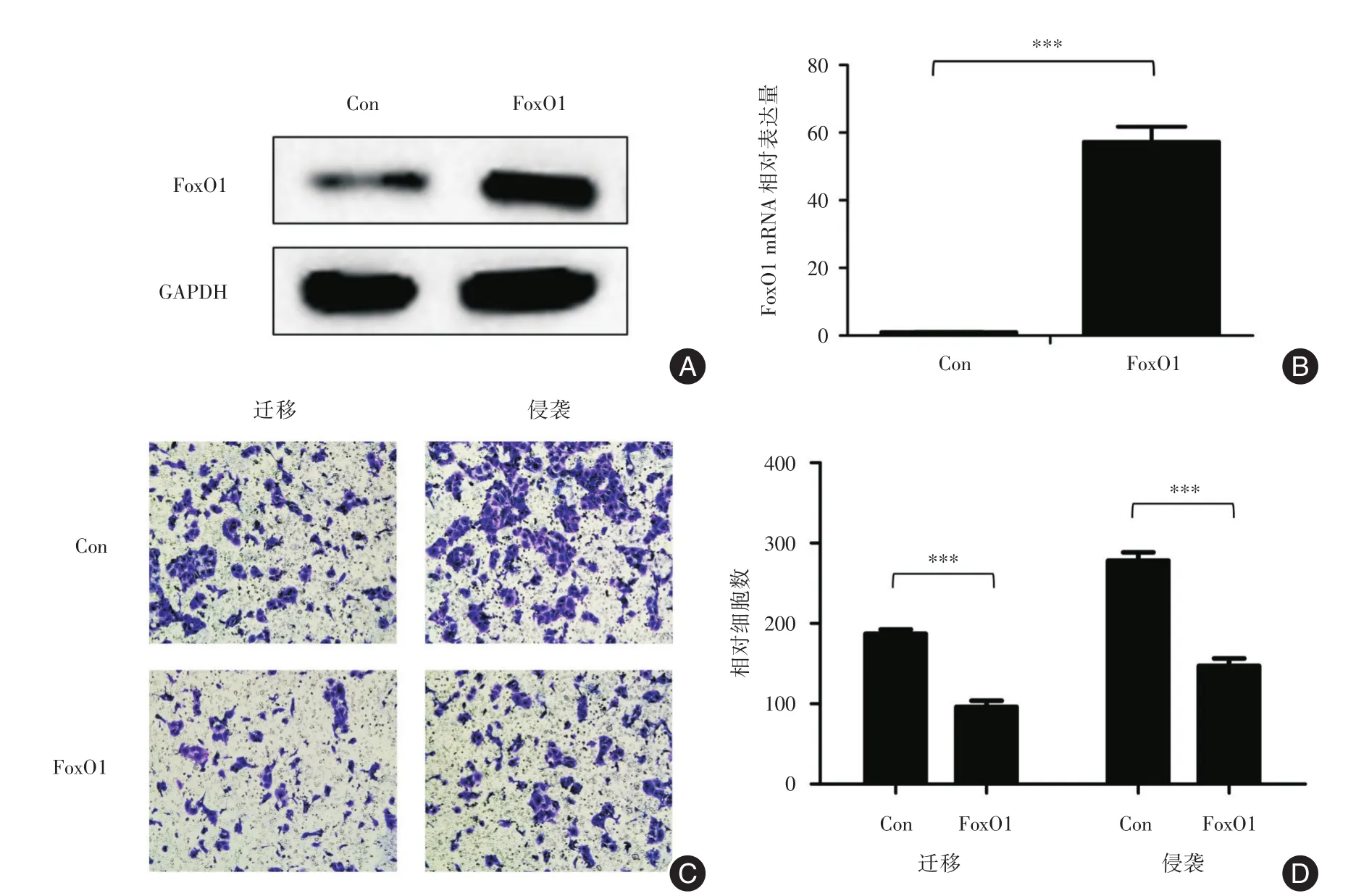
图1 IMR-32细胞系过表达FoxO1侵袭转移能力减弱Fig.1 Overexpressed FoxO1 in IMR-32 cells decreased the metastasis ability
2.2 敲低FoxO1增强细胞侵袭转移能力使用FoxO1敲低慢病毒感染SH-SY5Y细胞,构建FoxO1敲低稳转细胞系,通过Western blot(图2A)和qRT-PCR(图2B)检验FoxO1蛋白和mRNA表达,成功构建FoxO1敲低细胞系。Transwell小室检测细胞迁移和侵袭能力改变(图2C、图2D),SH-SY5Y细胞对照组迁移和侵袭细胞数分别为(81±11.232)和(197±14.890),SH-SY5Y敲低FoxO1组迁移和侵袭细胞数分别为(165±18.697)和(328±16.768),结果差异存在统计学意义(均P<0.001),说明敲低FoxO1促进SH-SY5Y细胞侵袭转移。
2.3 FoxO1抑制神经母细胞瘤上皮-间质转化使用Western blot检测IMR-32过表达FoxO1细胞系和SH-SY5Y敲低FoxO1细胞系上皮-间质细胞标志物E-cadherin、N-cadherin和Vimentin蛋白表达,结果发现FoxO1稳定过表达后细胞发生间质-上皮转化,E-cadherin蛋白水平上调而N-cadherin和Vimentin蛋白水平下调(图3A、图3B);FoxO1稳定敲低后细胞发生上皮-间质转化,E-cadherin蛋白水平下调而N-cadherin和Vimentin蛋白水平上调(图3C、图3D),结果差异具有统计学意义(P<0.05)。
2.4 FoxO1通过抑制ZEB2表达调节神经母细胞瘤上皮-间质转化IMR-32过表达FoxO1细胞系和SH-SY5Y敲低FoxO1细胞系检测ZEB2 mRNA(图4A)和蛋白(图4B)水平变化,发现FoxO1抑制ZEB2 mRNA和蛋白表达,结果差异具有统计学意义(P<0.05)。为了验证FoxO1通过调节ZEB2影响神经母细胞瘤上皮-间质转化,本实验使用siRNA敲低SH-SY5Y细胞系ZEB2表达,使用Westernblot检测E-cadherin和N-cadherin蛋白表达,发现ZEB2敲低条件下FoxO1引起的上皮-间质转化作用减弱,提示FoxO1通过影响ZEB2表达发挥功能。
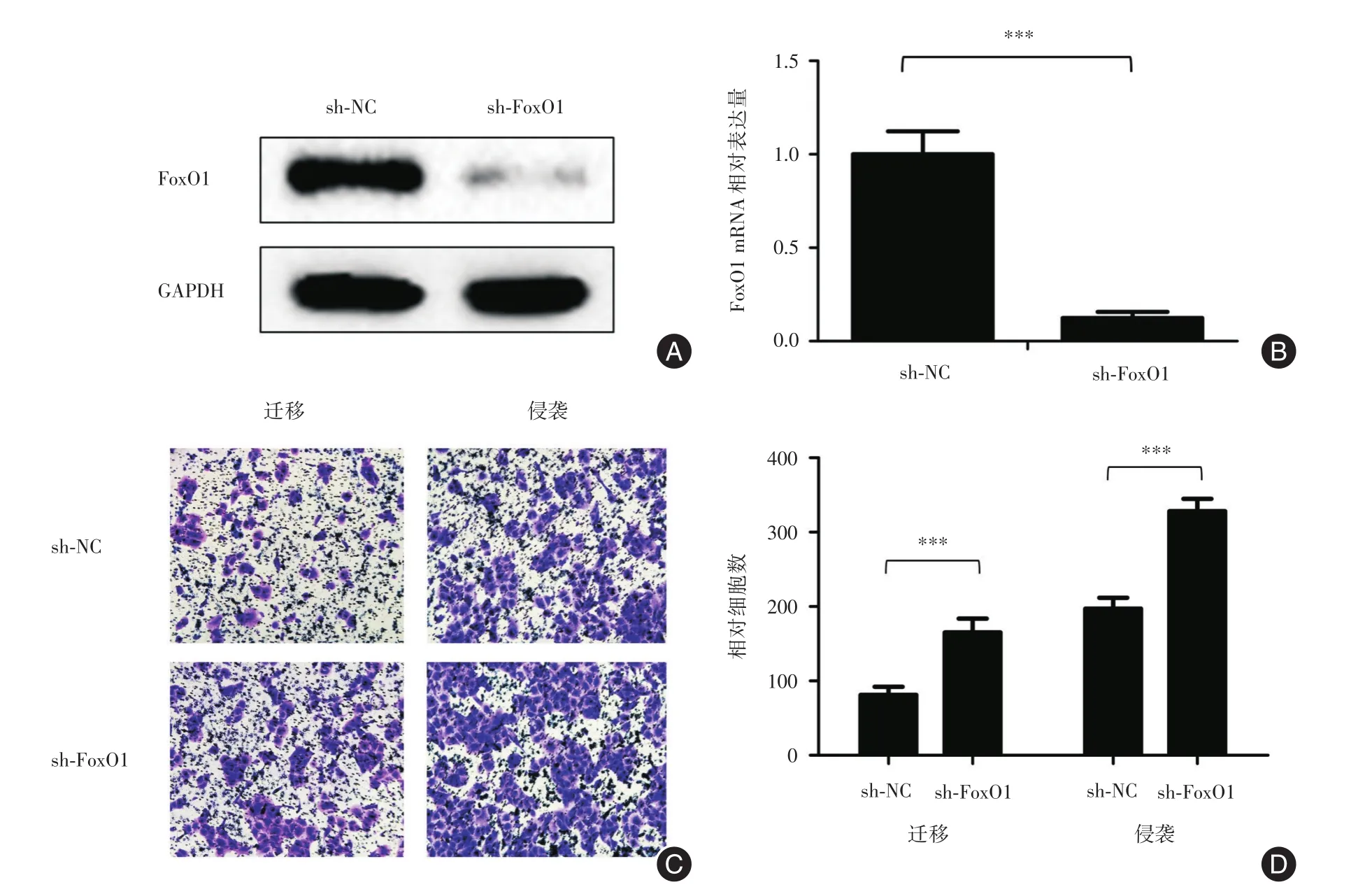
图2 SH-SY5Y细胞系敲低FoxO1侵袭转移能力增强Fig.2 Knock-down FoxO1 in SH-SY5Y cells increased the metastasis ability
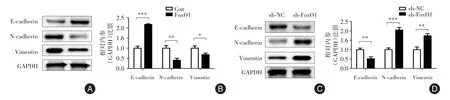
图3 FoxO1抑制神经母细胞瘤细胞上皮-间质转化Fig.3 FoxO1 inhibited EMT of neuroblastoma cells
3 讨论
神经母细胞瘤是儿童常见的恶性肿瘤,易发生早期转移,导致临床治疗颇具困难,目前常用的手术治疗、化疗、放射治疗及移植治疗等手段仍不能有效控制肿瘤进展,因此探究NB转移分子机制对于提高预后具有重要指导意义。
FoxO1蛋白在多种肿瘤中存在低表达,其上游受到PI3K/AKT信号通路调节,下游靶向调控与细胞增殖、细胞凋亡及侵袭转移等相关性基因表达,FoxO1在胰岛素/胰岛素样生长因子信号通路中发挥重要功能[11]。FoxO1含量及活性受到多种因素调节,作为转录因子可以被上游调控分子磷酸化,磷酸化FoxO1从胞核转移至胞浆中,失去靶向激活下游靶基因的功能[12]。MEI等[13]发现在神经母细胞瘤中FoxO1/3/4通过影响PDGFRA调节NB细胞分化,本研究发现FoxO1在NB侵袭迁移中发挥重要功能,通过过表达和敲低NB细胞FoxO1表达,发现FoxO1过表达抑制NB侵袭迁移能力,而敲低FoxO1促进NB侵袭迁移能力。肿瘤转移是造成NB患者死亡的重要因素,而EMT在侵袭迁移发生过程中起到重要作用。EMT发生过程中,组织良好和连接紧密的上皮细胞转化为组织松散和缺乏细胞连接的间质细胞[14],并且具有转移和侵袭的能力。本研究同时检测上皮-间质标志物发现过表达FoxO1抑制NB细胞上皮-间质转化的发生,而敲低FoxO1促进NB细胞上皮-间质转化的发生,说明FoxO1在NB中作为抑癌基因调控其侵袭转移及上皮-间质转化的发生。
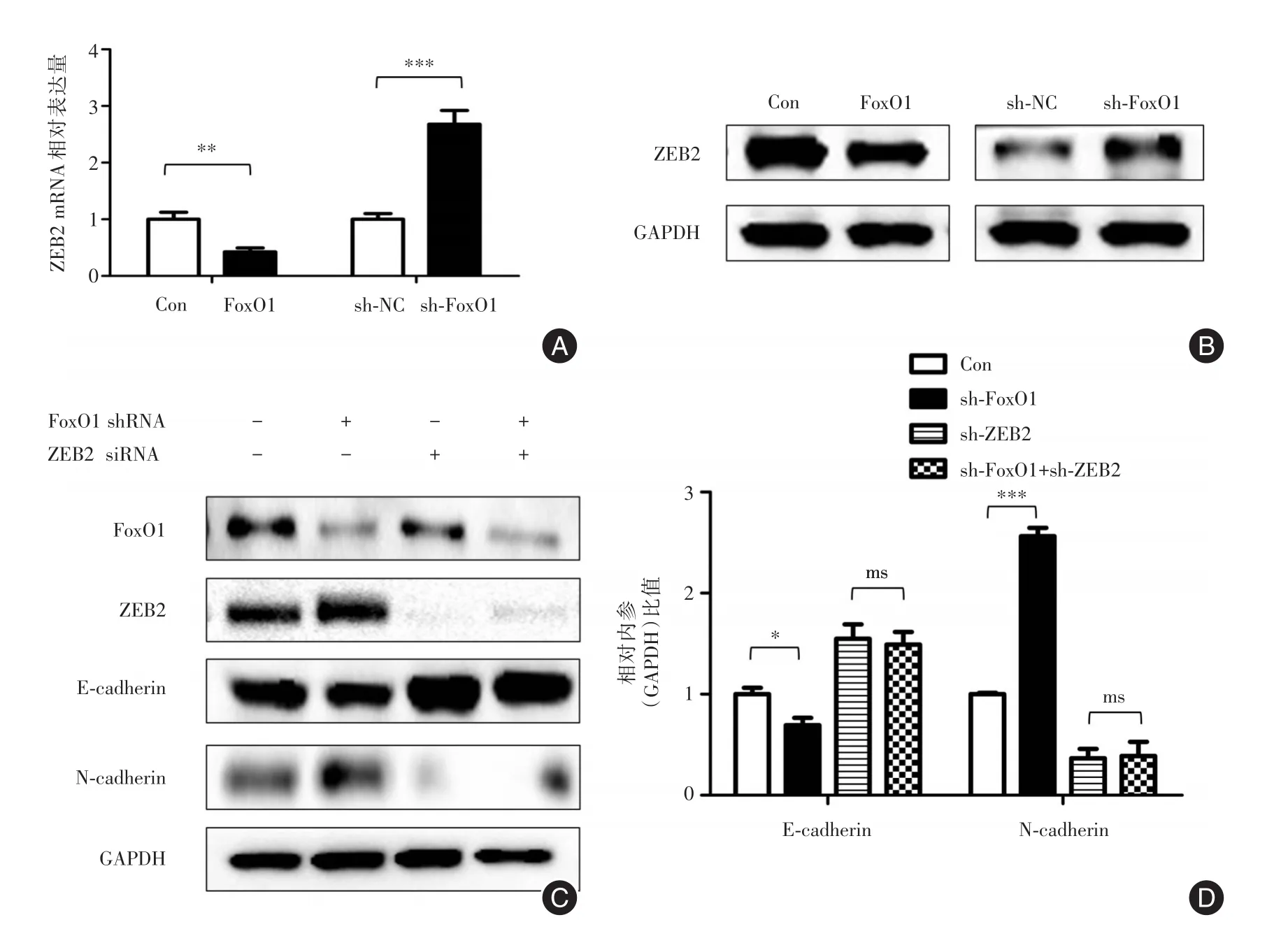
图4 FoxO1通过抑制ZEB2表达调节神经母细胞瘤上皮-间质转化Fig.4 FoxO1 regulated EMT of neuroblastoma cells through inhibiting the expression of ZEB2
ZEB2(zinc-finger E-box binding homebox 2,ZEB2)在多种肿瘤如大肠癌[15]、胃癌[16]及乳腺癌[17]等促进肿瘤侵袭转移的发生。ZEB2能与E-cadherin编码基因启动子上的E2盒结合抑制E-cadherin转录功能[18],从而促肿瘤侵袭转移。此外,研究发现肝癌肺转移组织中ZEB2存在过表达,且肝癌组织中FoxO1和ZEB2表达存在明显负相关性[7]。为了探究FoxO1抑制NB侵袭转移及EMT的分子机制,本研究检测FoxO1对ZEB2表达的影响,结果发现FoxO1过表达ZEB2表达下调而FoxO1敲低后ZEB2表达升高,提示FoxO1可能通过调节ZEB2表达发挥抑制肿瘤功能。为了研究假设,本实验在FoxO1敲低细胞系基础上再次敲低ZEB2,通过检测上皮间质标志物发现双基因敲除后E-cadherin和N-cadherin变化明显减弱,提示FoxO1通过抑制ZEB2表达发挥功能。
综上所述,本研究率先发现并验证FoxO1抑制NB侵袭迁移和上皮-间质转化,同时发现FoxO1抑制ZEB2表达是其可能的分子机制,对于NB转移研究提供新思路。本研究主要通过体外实验研究FoxO1蛋白的功能,缺乏体内研究证据,在今后研究中会增加体内实验验证FoxO1蛋白的功能并进一步探讨其影响ZEB2表达的分子机制,有可能为转移性NB的综合治疗带来新的靶点。

