富氢水对大鼠离体心肌缺血再灌注损伤细胞凋亡的影响
李翔子 孙晓宇 王赞 李志林 刘福林 周玉娟
河北大学1医学院,2化学院(河北保定071000);2河北大学附属医院(河北保定071000)
随着现代社会人们生活习惯的改变,越来越多的疾病威胁到人们的生命安全。据世界卫生组织统计,2000-2016年间,缺血性心脏病一直居于全球十大致死原因的首位。及时的心肌再灌注是治疗缺血性心脏病的有效手段,但心肌再灌注也可能对心肌造成进一步损伤,这一现象称为缺血再灌注损伤(ischemia reperfusion injury)。自发现氢气对大鼠缺血后脑梗死的治疗效用以来,研究者们对氢气进行了深入研究,发现其具有抗炎、抗凋亡、抗氧化等多种作用,对各种器官包括心脏缺血再灌注损伤具有很好的效果[1-3]。本研究基于NF-κB/Bcl-2信号通路,研究富氢水对大鼠离体心肌缺血再灌注损伤细胞凋亡的影响,探讨富氢水减轻大鼠离体心脏缺血再灌注损伤的机制。
1 材料与方法
1.1 材料实验动物为Wistar大鼠48只。雌雄各半,体质量250~280 g,由河北医科大学动物实验中心提供,合格证号:SCXK-(冀)2013-1-003。实验用富氢水为由河北大学化学院李志林老师提供(制备技术已获得国家专利,专利号ZL102557227B)。生物素-链霉卵白素免疫组化检测试剂盒、DAB试剂盒购自北京中杉金桥生物公司,0.01 mol/L柠檬酸钠缓冲液购自北京索莱宝生物科技有限公司,半胱氨酸蛋白酶蛋白-3(Caspase-3)、B淋巴细胞瘤-2(BCL-2)、B淋巴细胞瘤-2相关X蛋白(BAX蛋白)抗体购自Proteintech;组织蛋白提取试剂盒购自BestBio,NF-κB、二抗及β-actin购自Proteintech,预染蛋白Marker一抗稀释液购自索莱宝;ECL化学发光液及考马斯亮蓝试剂购自Bio-Rad Laboratovies。TUNEL试剂盒购自Vazyme。氢气测试仪购自日本TRUSTLEX。
1.2 实验方法
1.2.1 实验分组及模型的建立[4-5]48只Wistar大鼠适应性饲养1周后,随机分为对照组与富氢水组,每组24只,两组再分别随机分成缺血前期、缺血期、再灌注期,每期8只大鼠。麻醉采用腹腔注射方式,按大鼠体质量注射戊巴比妥钠(30 mg/kg)、肝素(250 U/kg)。麻醉成功后,迅速开胸摘取心脏,立即放入4℃冰盐水中,并轻压心脏,排空心腔积血。进行主动脉插管并将其固定于Langendorff装置,对照组采用预先用氧平衡(95%O2+5%CO2)的37℃K-R灌注液进行心脏灌注,富氢水组采用预先用氧平衡(95%O2+5%CO2)的37℃K-R液+富氢水灌注(0.6 mmol/L,pH7.3),两组心脏灌注的灌注压为7.85 kPa。按逆灌注10 min,常温旷置20 min、再灌注20 min进行处理。完毕后,取大鼠左心室心肌约0.3 g备用。
1.2.2 指标检测(1)TUNEL法检测各组心肌细胞凋亡率:严格按照TUNEL试剂盒说明书进行操作,于200倍荧光显微镜下拍照,每张切片5个不同视野,取平均值分析细胞凋亡程度。(2)免疫组织化学法检测Caspase-3、BAX、Bcl-2表达:心肌组织用10%福尔马林固定,梯度乙醇脱水,常规石蜡包埋,切片厚度4 μm。按试剂盒说明书操作。于200倍光镜下照相收集图像,每张切片随机取5个不同视野,应用Image-pro plus(IPP)图像分析系统进行图像分析。(3)蛋白质印迹法检测心肌细胞转录因子NF-κB蛋白的表达:大鼠取材后用磷酸盐缓冲液(PBS)漂洗干净,装入冻存管,-80℃保存备用。取0.05 g组织,匀浆后提取蛋白并定量,取总蛋白60 μg蛋白变性,标本于-20℃保存。进行15%SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE),进行湿法转膜。脱脂奶粉封闭2 h后,一抗孵育:TTBS稀释好的一抗3 mL加入PVDF膜,赶走气泡并封口,4℃摇床上过夜。洗膜,孵育二抗,再次洗膜。发光仪压片发光。
1.3 统计学方法采用SPSS 19.0统计软件对数据进行分析处理。计量数据以±s表示,组间比较用t检验及方差分析,进一步两两比较时用LSD法。P<0.05表示差异有统计学意义。
2 结果
2.1 富氢水对心肌缺血再灌注损伤细胞凋亡的影响对照组与富氢水组缺血前期均未出现细胞凋亡,对照组缺血再灌注期与缺血期比较,出现明显凋亡,细胞凋亡率明显增高(P<0.01),说明模型建造成功;富氢水组缺血再灌注期与缺血期比较,细胞凋亡率略高,但差异无统计学意义;富氢水组缺血期与对照组缺血期相比,无明显差异;富氢水组缺血再灌注期与对照组缺血再灌注期相比,细胞凋亡率明显降低(P<0.01),说明富氢水可以降低细胞凋亡的发生(图1、2)。

图1 大鼠心肌细胞凋亡结果(×200)Fig.1 Results of cardiomyocyte apoptosis in rats(× 200)
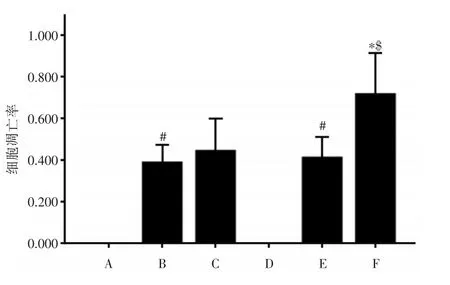
图2 大鼠心肌细胞凋亡结果Fig.2 Results of cardiomyocyte apoptosis in rats
2.2 富氢水对心肌组织中Bcl-2、BAX、Caspase-3蛋白表达的影响对照组缺血再灌注期与缺血期相比较,Bcl-2蛋白表达水平下降(P<0.05),富氢水组缺血再灌注期与对照组缺血再灌注期相比较,Bcl-2蛋白表达水平增高(P < 0.05)(表1,图3);对照组缺血再灌注期与缺血期相比较,Bax蛋白表达水平增高(P<0.05),富氢水组缺血再灌注期与对照组缺血再灌注期相比,Bax蛋白表达水平降低(P < 0.05)(表1,图4);对照组缺血再灌注期与缺血期相比较,Caspase-3蛋白表达水平增高(P<0.05),富氢水组缺血再灌注期与对照组缺血再灌注期相比,Caspase-3蛋白表达水平降低(P<0.05)(表1,图5)。
2.3 富氢水对心肌组织中NF-κB蛋白表达的影响研究结果显示,对照组缺血再灌注期与缺血前期、缺血期比较NF-κB蛋白含量增高(P<0.05);富氢水组缺血再灌注期与缺血前期、缺血期比较NF-κB蛋白含量增高(P<0.05);富氢水组缺血再灌注期与对照组缺血再灌注期NF-κB蛋白含量明显降低(P<0.01)(表2,图6)。
3 讨论
心肌缺血再灌注是治疗心肌缺血的有效策略,但是标准的再灌注治疗仍然会对心肌造成一定破坏。氧自由基增加、钙超载、线粒体损伤、炎症等是心肌缺血再灌注损伤的发生机制[6-8]。
当细胞受到某些因素刺激后启动凋亡程序时,细胞中抑制凋亡的基因也会被激活,以维持细胞的正常结构。Caspase家族是一种内切蛋白家族,它们在控制炎症和细胞凋亡的细胞调控网络中提供关键链接[9]。Caspase-3是Caspase家族的关键性因子,是细胞凋亡发生的标志酶[10],既是效应分子又是执行分子,其活化可激活核酸内切酶、降解DNA修复酶和细胞骨架蛋白进而导致细胞凋亡。再灌注会导致心肌自噬体增加并诱发自噬作用,激活Caspase级联反应,氧自由基、钙超载和m PTP开放等导致线粒体肿胀和破裂,释放凋亡诱导因子和细胞色素C等凋亡相关蛋白,进一步启动Caspase级联反应,诱导心肌细胞凋亡[11]。
表1 大鼠心肌细胞凋亡相关蛋白Bcl-2、Bax、Caspase-3的表达Tab.1 Expression of apoptosis related proteins Bcl-2,Bax and Caspase-3 in rat myocardium ±s,%

表1 大鼠心肌细胞凋亡相关蛋白Bcl-2、Bax、Caspase-3的表达Tab.1 Expression of apoptosis related proteins Bcl-2,Bax and Caspase-3 in rat myocardium ±s,%
注:与对照组比较,*P<0.05;与缺血期比较,△P<0.05
组别对照组缺血前期缺血期再灌注期富氢水组缺血前期缺血期再灌注期n 8 8 8 8 8 8 Bcl-2Bax Caspase-3 0.103±0.040 14.483±2.274 6.223±1.658△0.021±0.008 6.433±2.609 29.911± 7.382△0.106±0.033 13.661±1.151 33.099±3.342△0.034±0.017 13.186±2.604 15.753±3.095*0.079±0.019 6.063±1.531 6.711±1.961*0.097±0.022 13.173±1.619 13.424±2.719*

图3 大鼠心肌细胞Bcl-2蛋白表达免疫组织化学检测结果(×200)Fig.3 Immunohistochemical expression of Bcl-2 protein in rat cardiac myocytes(× 200)

图4 大鼠心肌细胞Bax蛋白表达免疫组织化学检测结果(×200)Fig.4 Immunohistochemical expression of Bax protein in rat cardiac myocytes(× 200)
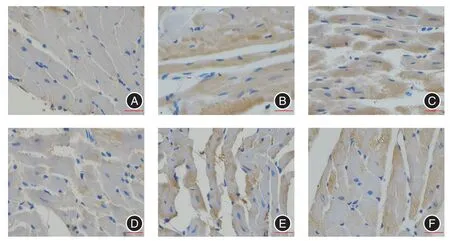
图5 大鼠心肌细胞Caspase-3蛋白表达免疫组织化学检测结果(×200)Fig.5 Immunohistochemical expression of Caspase-3 protein in rat cardiac myocytes(× 200)
表2 富氢水对大鼠心肌中NF-κB蛋白含量(%)的影响Tab.2 Effect of hydrogen rich water on NF-κB protein content(%)in rat myocardium ±s
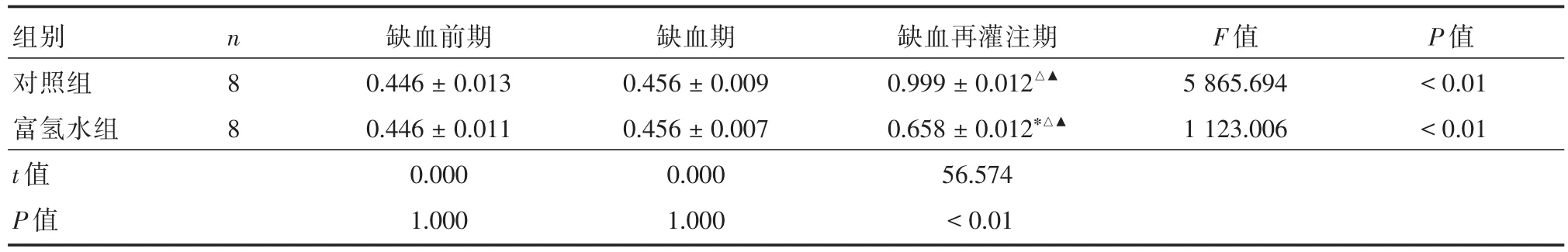
表2 富氢水对大鼠心肌中NF-κB蛋白含量(%)的影响Tab.2 Effect of hydrogen rich water on NF-κB protein content(%)in rat myocardium ±s
注:与对照组比较,*P<0.05;与缺血前期比较,△P<0.05;与缺血期比较,▲P<0.05
组别对照组富氢水组t值P值n 8 8缺血前期0.446±0.013 0.446±0.011 0.000 1.000缺血期0.456±0.009 0.456±0.007 0.000 1.000缺血再灌注期0.999 ± 0.012△▲0.658 ± 0.012*△▲56.574<0.01 F值5 865.694 1 123.006 P值<0.01<0.01

图6 心肌组织中HMGB1、NF-κB蛋白表达Fig.6 Expression of NF-κB protein in myocardium
Bcl-2家族是细胞凋亡的关键调节剂,包括抗凋亡蛋白和促凋亡蛋白,这些蛋白质动态平衡的轻微变化可能导致细胞凋亡的抑制或促进。Bcl-2和Bax是Bcl-2家族中调控细胞凋亡的关键性基因,Bcl-2可以抑制细胞凋亡,拮抗促凋亡基因Bax,Bcl-2与Bax在体内构成一种均衡体系,Bax的过度表达可抑制Bcl-2的保护效应而促使细胞死亡,同时Bcl-2也可抑制Bax的表达,减少细胞凋亡[12-14]。Bcl-2与Bax互为影响,共同参与调节细胞的凋亡。同时,Bcl-2也可以抑制线粒体中促凋亡的蛋白质细胞色素c释放到胞质,阻止胞质中的细胞色素c激活Caspase。
NF-kB是表达最广的转录因子之一,介导凋亡抑制剂家族(IAP和Bcl-2)许多抗细胞凋亡蛋白的形成,是细胞凋亡的一个决定性因子,同时对免疫和炎症过程中起重要作用的蛋白质有调节作用[15-16]。在再灌注过程中,炎症细胞因子的产生增加,会刺激NF-κB活化。NF-κB的活化会下调抗凋亡蛋白Bcl-2的表达,促进凋亡增加[17-18]。
研究发现,当Bcl-2/Bax比例升高,Caspase-3活性降低时,细胞凋亡被有效的抑制[19-22]。当NF-κB表达降低时,炎症反应减轻,细胞凋亡减少,缺血再灌注损伤有所减轻[23-24]。本实验结果显示,缺血再灌注损伤后,抗凋亡蛋白Bcl-2蛋白表达水平下降,NF-κB、Bax蛋白表达水平增高,同时Caspase-3蛋白表达水平增高,细胞凋亡明显增加。富氢水组Bcl-2蛋白表达水平增高,NF-κB、Bax蛋白表达水平降低,同时Caspase-3蛋白表达水平降低,心肌细胞凋亡水平下降。富氢水能够通过调节NF-κB/Bcl-2信号通路,上调Bcl-2/Bax比例减少细胞凋亡,减轻大鼠离体心脏缺血再灌注损伤。
致谢:感谢河北大学附属医院中心试验室提供的帮助。

