丰富环境干预对帕金森病大鼠中脑miR-133b表达的影响
许容娟 蒲蜀湘 庄顺芝 李芳 高聪 龙友明 姚海燕
广州医科大学附属第二医院神经内科(广州 510260)
帕金森病(Parkinson′s disease,PD)是常见的神经系统退行性疾病,主要病理表现为中脑黑质多巴胺能神经元进行性减少,临床主要表现为静止性震颤、运动迟缓、肌强直、姿势步态异常。目前PD的治疗手段包括药物治疗和手术治疗,但效果差强人意。丰富环境(enriched environment,EE)是指在动物饲养环境中增加体力活动、躯体感觉及视觉输入、社交活动的实验模型[1]。研究表明EE通过影响神经元的可塑性,对亨廷顿氏舞蹈病、阿尔兹海默病等多种神经退行性疾病有益[2-3]。有研究显示微小RNA(microRNA,miRNA)广泛参与神经系统疾病的发生发展过程,miR-133b在中脑多巴胺神经元中特异性表达,且对中脑多巴胺能神经元的成熟、存活起重要作用[4-5]。本研究旨在通过探讨EE干预对PD大鼠中脑miR-133b表达的影响,进而阐明EE治疗PD的可能机制。
1 材料与方法
1.1 PD大鼠模型的制作SPF级雄性Wistar大鼠(购自南方医科大学实验动物中心)36只,体质量200~250 g,经反复确认无旋转行为,随机均分为PD模型组和假手术(sham)组。大鼠称重,予10%水合氯醛(3.5 mL/kg)腹腔注射麻醉后,固定于大鼠脑立体定位仪。予备皮、常规消毒、开颅后,行大鼠左侧纹状体损毁手术[6]。参照大鼠脑立体定位图谱,坐标为:第一点:前囟前0.3 mm,矢状线左侧旁开2.6 mm,硬膜下4.5 mm;第二点:前囟前0.7 mm,矢状线左侧旁开2.6 mm,硬膜下6.0 mm。以微量注射器将10 μL 4 g/L的6-羟基多巴胺(6-hydroxydopamine,6-OHDA)(以含0.1%坏血酸的生理盐水配制)缓慢注射入PD模型组大鼠上述两点,每点注射完毕后留针10 min。sham组大鼠予相同部位注射相同体积含0.1%坏血酸的生理盐水。3周后,对大鼠予腹腔内注射阿扑吗啡(apomorphine,APO),剂量为0.5 mg/kg,观察大鼠自开始旋转30 min内的旋转圈数。旋转速度>7 r/min者为成功的PD模型。
1.2 实验分组将造模成功的PD模型组大鼠随机分成2组:PD+EE组、PD+标准环境(standard environment,SE)组。将sham组大鼠随机分成2组:sham+EE组、sham+SE组。各组动物分别予对应环境干预。
1.3 不同环境干预EE为体积为60 cm×50 cm×100 cm的钢丝笼,分上下3层,每层以阶梯连通,内设滚轮、秋千、管道等设施,并置入不同形状和颜色的玩具,定期更换玩具种类、数量、位置。笼中大鼠可自由进食饮水。标准环境为32 cm×20 cm×15 cm的普通鼠笼,笼内大鼠可自由进食饮水。将各组动物分别置入对应环境饲养,6周后,各组取6只大鼠进行酪氨酸羟化酶(tyrosine hydroxylase,TH)免疫组化染色检测损毁侧纹状体TH阳性纤维及黑质TH阳性细胞的表达,其余大鼠用于提取中脑黑质RNA检测miR-133b表达情况。
1.4 标本处理
1.4.1 主要试剂及仪器抗酪氨酸羟化酶抗体(德国Millipore公司)、UltrasenitiveTMS-P超敏试剂盒(鼠/兔)(迈新试剂公司)、MirVanaTMmiRNA试 剂 盒(Thermo life technologies)、Thermoscript RT-PCR system试剂盒(Thermo life technologies)、RNase Inhibitor(Thermo Fisher Scientific)、SYBR®qPCR Mix(ToYoBo)、Rotor-GeneQ 实时荧光定量PCR分析仪(德国QIAGEN公司)。
1.4.2 TH免疫组化染色大鼠麻醉后,先经心脏灌注生理盐水100 mL,再予4%多聚甲醛溶液灌注30 min。灌注完毕后取脑,在4%多聚甲醛溶液中固定24 h,之后依次置入10%、20%、30%蔗糖溶液脱水。取中脑行冠状切片,片厚30 μm。将切片按以下步骤行TH免疫组化染色:(1)切片入内源性过氧化物酶阻断剂30 min;(2)动物非免疫血清(羊)封闭30 min;(3)兔抗TH多克隆抗体(1∶10 000)室温孵育1 h后,4℃孵育过夜;(4)生物素标记的羊抗鼠/兔IgG室温孵育2 h;(5)链霉菌抗生物素蛋白-过氧化物酶室温孵育30 min;(6)DAB显色。上述各步骤间均用PBS缓冲液漂洗3次,每次5 min。每只大鼠各取纹状体、黑质相同部位脑片3张,通过Leica显微镜采集图像,以Image J图像分析软件进行分析,统计纹状体TH阳性纤维灰度值及黑质TH阳性细胞数目。
1.4.3 组织分离、RNA提取及质量检测不同环境干预6周后,各组大鼠麻醉后取脑,冰上、显微镜下分离左侧中脑黑质组织。按MirVanaTMmiRNA试剂盒说明书步骤,提取大鼠黑质RNA。总RNA转移至RNase free EP管,加入80 μL预热至95℃的RNasefree water,1 000 g离心30 s,取滤液加入1 μL RNase Inhibitor,放于-80 ℃保存备用。取1.5 μL RNA样品,用微量分光光度计检测RNA浓度,要求OD260/280值在1.8~2.1之间,并以电泳检测RNA质量。
1.4.4 逆转录反应对各组大鼠的总RNA进行逆转录。在RNase free的PCR管中加入总RNA 11 μL、RNase free H2O 1 μL,吹打均匀,置于80 ℃保温5 min,65℃保温5 min,使RNA变性,随后立即4℃冷却,防止RNA复性。向上述PCR管加入10 mmol/L dNTPs 2 μL、5 × Buffer 4 μL、0.1 mol/L DTT 1 μL、RNase out 1 μL、RT(script)1 μL,反应条件为65℃ 45 min,85℃ 5 min,最后4℃冷却,-20℃保存。
1.4.5 实时荧光定量PCR选用U6snRNA为内参照。20 μL PCR反应体系:模板cDNA 1.5 μL,上游引物 0.5 μL,下游引物 0.5 μL,2×SYBR Green qPCR SuperMix 10 μL,RNase-free water 7.5 μL。反应条件:95℃预变性1 min,95℃变性15 s,60℃复性30 s,60℃延伸30 s,45个循环;融解曲线分析:温度60~95℃。每个样本重复3次。采用比较Ct值法分析miR-133b相对表达量(F=2-△△Ct)。
1.5 统计学方法数据采用SPSS 16.0软件分析,定量资料以±s表示。多组间比较采用单因素方差分析。两两比较,满足正态分布和方差齐性数据采用student t检验,不满足正态分布或方差齐性数据采用Mann-Whitney检验。P<0.05认为差异有统计学意义。
2 结果
2.1 不同环境干预下PD大鼠损毁侧(左侧)纹状体TH阳性纤维灰度值及黑质TH阳性细胞数目测定PD+SE组大鼠损毁侧纹状体TH阳性纤维灰度值、黑质TH阳性细胞数目少于sham+SE组,差异有统计学意义(t=-6.643,P <0.05;t=-18.002,P<0.05)。PD+EE组大鼠损毁侧纹状体TH阳性纤维灰度值、黑质TH阳性细胞数目较PD+SE组多,差异有统计学意义(t=2.373,P < 0.05;t=4.208,P<0.05)。sham+EE组大鼠损毁侧纹状体TH阳性纤维、黑质TH阳性细胞数目较sham+SE组多(t=-4.490,P < 0.05;t=6.845,P < 0.05)。见表1和图1、2。
表1 各组大鼠中脑损毁侧(左)纹状体TH阳性纤维灰度值和黑质TH阳性细胞数目比较(n=6)Tab.1 Comparison of expression of TH-positive fiber in striatum and TH-positive cells in substantia nigra ±s
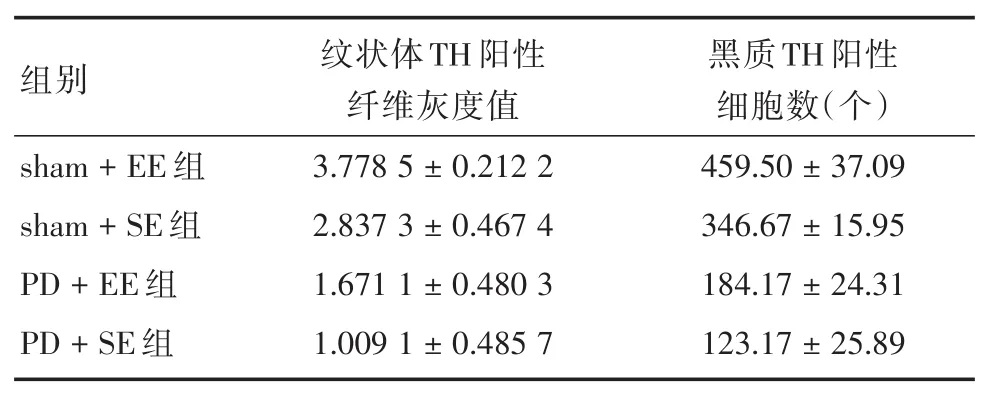
表1 各组大鼠中脑损毁侧(左)纹状体TH阳性纤维灰度值和黑质TH阳性细胞数目比较(n=6)Tab.1 Comparison of expression of TH-positive fiber in striatum and TH-positive cells in substantia nigra ±s
组别sham+EE组sham+SE组PD+EE组PD+SE组纹状体TH阳性纤维灰度值3.778 5±0.212 2 2.837 3±0.467 4 1.671 1±0.480 3 1.009 1±0.485 7黑质TH阳性细胞数(个)459.50±37.09 346.67±15.95 184.17±24.31 123.17±25.89
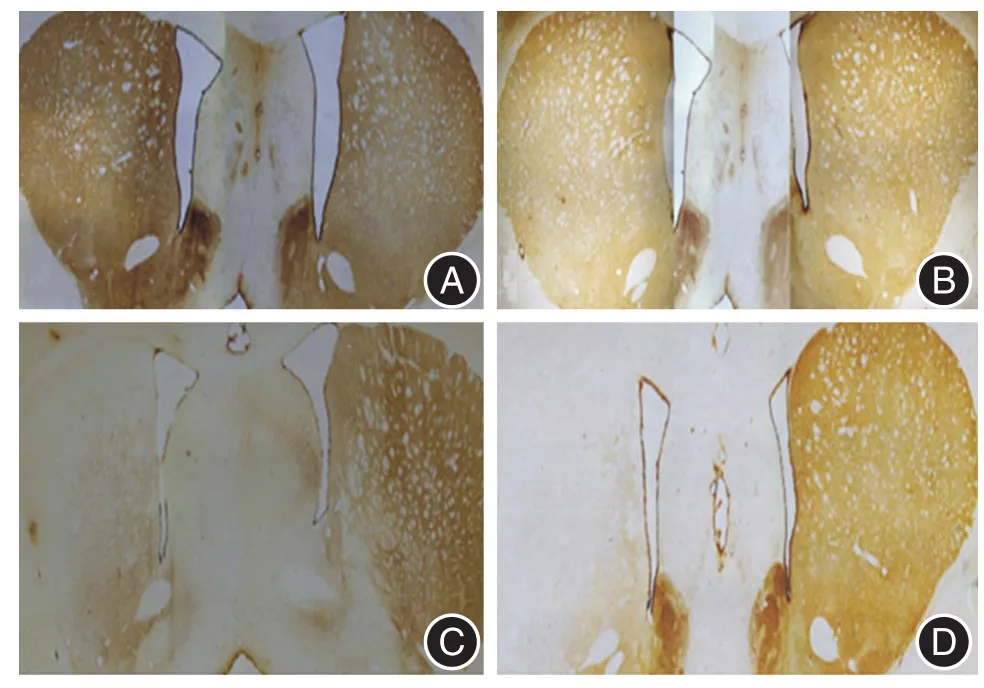
图1 各组大鼠纹状体TH染色Fig.1 Tyrosine hydroxylase immunohistochemistry staining in striatum
2.2 不同环境干预下的PD大鼠中脑黑质miR-133b的表达情况PD+SE组大鼠损毁侧中脑黑质miR-133b相对表达量高于sham+SE组大鼠,差异有统计学意义(t=2.868,P<0.05)。PD+EE组大鼠损毁侧中脑黑质miR-133b的相对表达量低于PD+SE组,差异有统计学意义(t=-2.948,P<0.05)。见图3、4。
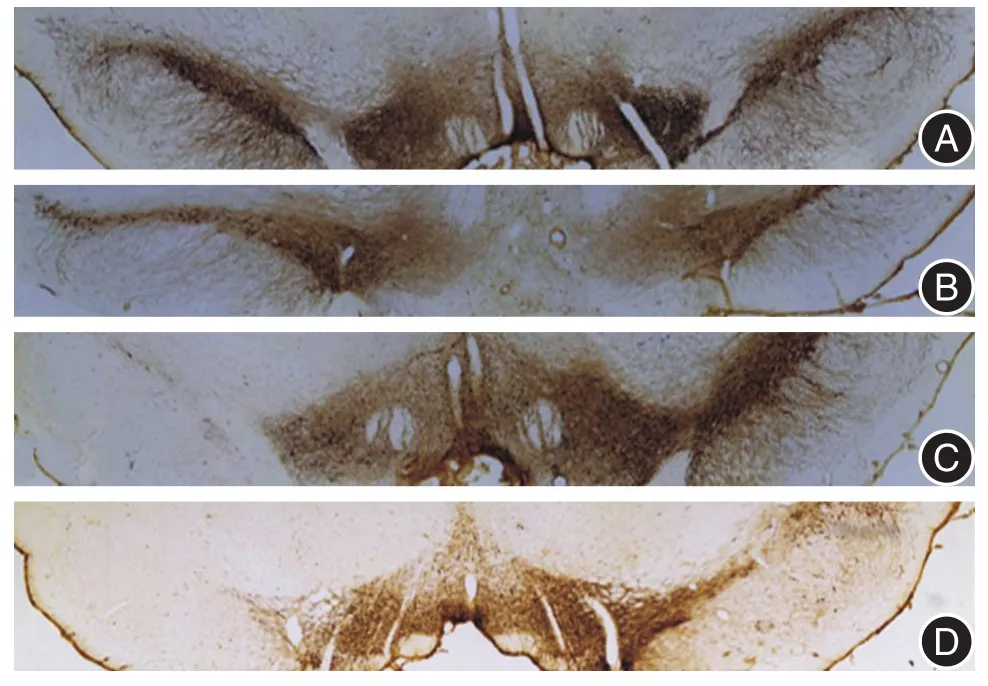
图2 各组大鼠黑质TH染色Fig.2 Tyrosine hydroxylase immunohistochemistry staining in substantia nigra

图3 PD+SE组、sham+SE组大鼠中脑miR-133b相对表达量Fig.3 MiR-133b relative expression in mibrain of rats in PD+SE and sham+SE group

图4 PD+EE组、PD+SE组大鼠中脑miR-133b相对表达量Fig.4 MiR-133b relative expression in mibrain of rats in PD+EE and PD+SE group
3 讨论
EE是一个有着复杂的物理性刺激和社会刺激的复合体,设置EE的总原则是要增加自主物理运动和社会刺激。目前EE的概念已被广泛运用到环境对脑功能的影响研究中。研究表明,EE在缺血性脑损伤、阿尔兹海默病、抑郁等多种中枢神经系统疾病中起积极作用[7]。JUNGLING 等[8]在大鼠出生后即予5周EE干预,在大鼠成年后予6-OHDA模拟PD的病理生理状态,结果发现出生后予EE干预的动物黑质多巴胺能神经元的损失略少于对照环境组,尽管没有达到统计学意义上的差异,但进一步的行为学检查表明EE干预可对抗6-OHDA造成的运动功能减退,在一定程度上提示早期EE干预对晚期PD可能存在神经保护作用。然而在PD晚期的EE干预的作用,在不同的研究中存在差异。STEINER等[9]先对大鼠予6-OHDA处理建立PD模型,随后予EE干预,结果发现在干预4和7周后,PD模型大鼠的运动功能得到改善,但对6-OHDA造成的多巴胺能神经元退化没有影响。TH是多巴胺合成的限速酶,是脑内多巴胺能神经元的标志酶,在多巴胺生成的调节中起重要作用。因此,本研究采用TH免疫组化染色检测大鼠中脑多巴胺能神经元的表达情况。本研究中,PD组大鼠损伤侧纹状体TH阳性神经纤维及黑质TH阳性细胞较假手术组减少,模拟了PD中黑质纹状体系统多巴胺能神经元减少的病理状态。并且,EE干预的PD大鼠中脑TH阳性纤维及TH阳性细胞数目表达较PD+SE组增多,这与前述STEINER等[9]的研究存在差异,但与ANASTASÍA等[10]的研究结果相一致。在ANASTASÍA等[10]的研究中,对大鼠进行6-OHDA处理的前后均予3周EE干预,结果发现EE干预可使PD大鼠黑质纹状体通路得到保护,运动损害也减少。不同研究间存在差异的原因可能与建立PD模型时6-OHDA的用量、注射的部位以及EE干预的时机有关。本研究表明EE上调了PD大鼠中脑多巴胺能神经元的表达,证实在PD晚期的EE干预具有神经修复作用,为PD晚期的临床治疗提供了一种新的策略。
尽管EE在基因、分子、行为学水平上对多种疾病具有积极的影响,其作用机制目前仍未十分明确。miRNA是由内源性基因编码、长度约20~25个核苷酸的单链非编码RNA[11]。miRNA对基因表达转录后调节和神经细胞表型调控起重要作用,广泛参与神经疾病的发生发展过程[5,12-13]。研究表明,PD患者脑脊液中miRNA的表达与正常人群相比存在显著差异,多个miRNA的异常表达被认为与PD相关[14-15]。KIM等[11]对PD患者尸检发现,在PD患者中脑、皮层、小脑中,miR-133b表达减少。KIM等[11]进一步的体外实验表明,敲除miR-133b能够上调多巴胺能神经元表达,miR-133b与调控多巴胺能神经元发育和成熟的转录因子Pitx3存在负反馈调节回路。然而,与KIM等[11]在组织水平上的研究不同的是,SCHLAUDRAFF 等[16]利用优化的单细胞定量实时PCR技术,对散发性PD患者和正常对照者的黑质多巴胺神经元分析发现,两者miR-133b水平并无差异。研究发现敲除小鼠miR-133b对中脑多巴胺神经元数量及Pitx3表达无明显影响,小鼠的运动及认知行为也无改变[11]。马孝俊等[17]发现,PD 患者脑脊液中 miR-133b表达升高。本研究中,标准环境干预的PD大鼠黑质miR-133b的相对表达水平高于标准环境干预的假手术对照组大鼠,表明6-OHDA的神经毒性作用可能与miR-133b有关,可能引起miR-133b表达上调而导致多巴胺能神经元变性。在不同的研究中,miR-133b与PD的关系尚存争议。推测原因可能在于:(1)miR-133b的旁系同源物miR-133a1和miR-133a2的存在可能补偿了miR-133b的失调;(2)在体内miR-133b失调与PD病因学之间缺乏因果关系,但miR-133b的水平可能影响多巴胺能神经元对神经毒素介导的神经变性的易感性;(3)miR-133b在PD的不同时期的水平可能存在差异[16,18]。EE 干预下的 PD 大鼠损伤侧黑质 miR-133b相对表达水平较标准环境干预下的PD大鼠低,提示EE干预可能通过抑制miR-133b的表达,促进黑质-纹状体系统多巴胺能神经元修复,由此实现在PD晚期中的神经修复作用。关于EE如何影响脑组织中miRNA表达的变化,目前的研究很少。在关于抑郁症的研究[19]中,发现EE可影响miR-107、miR-134等miRNA的表达,提示miRNA的表达谱在EE下发生变化。特定miRNA的累积依赖于转录、加工和衰变的速率。因此,EE对miRNA表达谱的影响可能与基因转录、miRNA转换率或两者均相关。EE如何下调miR-133b的表达尚不清楚。DENHAM等[20]发现,运动训练降低人全血中miR-133家族的水平。在EE中,体力活动是重要的组成要素之一。因此,EE可能通过增加骨骼肌代谢的蛋白质合成和改善氧化能力、胰岛素敏感性和线粒体生物合成使miR-133b下降。JIN 等[21]发现,lncRNA133b,一种长 链 非编码RNA,其下调增加miR-133b的表达,而其过表达则降低miR-133b的表达。因此,EE通过上调lncRNA133b表达以下调miR-133b是另一种可能的解释。此外,MARGOLIS等[22]研究发现,限制能量摄入可上调血清miR-133b表达。因此,能量代谢的变化可能是解释EE下调miR-133b表达的另一个突破口。miR-133b可能是EE作用的潜在的靶标,通过直接干预miR-133b的表达或调整影响miR-133b表达的因素,可能模拟EE的神经修复作用,这可能为临床PD晚期的治疗提供一种新的可能的思路。
尽管本研究的结果揭示了miR-133b可能是EE的神经修复作用潜在的靶标,但两者之间具体的作用机制仍有待进一步的深入研究。

