磁敏感加权成像检测帕金森病患者黑质铁含量▲
任延德 龙莉玲 李向荣 秦宇虹 李春燕 戴 旖 蒋牧良 叶 伟
(1 广西医科大学第一附属医院放射科,南宁市 530021,E-mail: lxr99@sina.com;2 青岛大学附属医院放射科,青岛市 266003)
论著·临床研究
磁敏感加权成像检测帕金森病患者黑质铁含量▲
任延德1,2龙莉玲1李向荣1秦宇虹1李春燕1戴 旖1蒋牧良1叶 伟1
(1 广西医科大学第一附属医院放射科,南宁市 530021,E-mail: lxr99@sina.com;2 青岛大学附属医院放射科,青岛市 266003)
目的 探讨磁敏感加权成像(SWI)检测帕金森病(PD)患者黑质铁含量的应用价值。方法 42例PD患者(PD组)和41例健康人(对照组)均行SWI检查,选取相位图进行数据分析,背侧及腹侧黑质各选取3个等大圆形感兴趣区(ROI),分别测量每个ROI相位偏移值,利用公式计算出相位值。结果 与对照组比较,PD组黑质相位值减小(P<0.05);PD组黑质前、中、后部位相位值及黑质腹侧、背侧相位值均低于对照组(P<0.05);PD组症状明显侧黑质相位值与对侧黑质相位值比较,差异无统计学意义(P>0.05)。结论 PD患者黑质铁含量呈同步性增加;选取黑质内多个ROI研究黑质相位值,能较客观、整体评价PD患者黑质铁含量变化。
帕金森病;黑质;磁敏感加权成像;相位值;铁
帕金森病(Parkinson′s disease,PD)是中老年人常见的进行性中枢神经系统变性病变,主要病理改变是黑质多巴胺变性、丢失,而黑质铁过量沉积与病理改变密切相关。因此能够简单、无创地检测黑质铁含量,对PD的诊断与鉴别诊断以及病理生理的研究具有重要意义。磁敏感加权成像(susceptibility-weighted imaging,SWI)技术对脑铁变化极其敏感,可以清晰显示铁异常沉积部位信号变化,并可以进行铁含量的测量[1]。以往研究中测量黑质铁含量一般根据黑质形态先勾画出黑质边缘,再测量勾画区内黑质铁含量,但PD患者的病理改变为黑质变性,所以黑质边界不能准确勾画。为了客观测量PD患者黑质铁含量变化,本研究应用SWI检测42例早期PD患者的大脑双侧黑质内多个等大圆形感兴趣区(region of interest,ROI),计算相应部位相位值,评估PD患者黑质内各个部位铁含量变化特点。
1 资料与方法
1.1 临床资料 选取2013年7月至2014年10月在广西医科大学第一附属医院门诊就诊或住院的早期PD患者42例(PD组),Hoehn-Yahr分级1~2.5级,诊断符合英国脑库帕金森病诊断标准[2],男22例,女20例,年龄44~76(61.5±9.3岁)。同期选取41名健康人作为对照组,男21例,女20例,年龄45~74 (60.7±8.6)岁。两组年龄、性别比较,差异无统计学意义(P>0.05),具有可比性。本研究通过广西医科大学伦理委员会批准,所有研究对象均获得本人同意并自行签署检查同意书。依据统一帕金森病评定量表(Unified Parkinson′s Disease Rating Scale,UPDRS)[3],分别对42例PD患者双侧上下肢体的运动功能(包括震颤、僵直、手及腿部灵活性)进行评分,评价双侧肢体症状严重程度,分值较高侧视为症状明显侧。
1.2 方法
1.2.1 检查方法:应用西门子Vetrio 3.0T磁共振扫描仪进行扫描,12通道头部相控阵线圈。先进行常规序列扫描:轴位T2加权像(T2-weighted image,T2WI),重复时间(repetition time,TR)5 000 ms,回波时间(echo time,TE)128 ms,视野(field of view,FOV)220 mm×220 mm,层厚5 mm,层间距5.5 mm、轴位T1加权像(T1-weighted image,T1WI)(TR 450 ms,TE 14 ms,FOV 220 mm×220 mm,层厚5 mm,层间距5.5 mm)、轴位液体衰减反转恢复(fluid-attenuated inversion recovery,FLAIR)[(TR 9 000 ms,TE 110 ms,反转时间(inversion time,TI)2 500 ms,FOV 220,层厚5 mm,层间距5.5 mm]、矢状位T2WI(TR 5 000 ms,TE 128 ms,FOV 220 mm×220 mm,层厚5 mm,层间距5.5 mm);再进行SWI序列扫描,范围从枕骨大孔至半卵圆中心层面,扫描参数:TR=28 ms,TE=20 ms,翻转角度15 deg,层数60,层厚1.2 mm,激励次数2次,FOV 220 mm×220 mm,矩阵192×256。1.2.2 图像分析:将SWI图像传入工作站,进入VIEW操作界面,选取相位图中黑质最清楚层面测量相位偏移值(见图1)。从黑质头侧到尾侧分两排平均选取6个等大圆形ROI区测量相位偏移值,面积6 mm2;腹侧前、中、后ROI标记为1~3,背侧前、中、后ROI标记为4~6。1~3、4~6分别合并取均值,代表黑质腹侧、背侧相位偏移值;ROI 1与4、2与5、3与6分别合并取均值,代表黑质前、中、后部位相位偏移值;取ROI 1~6的均值计算整体黑质相位偏移值。应用公式f(x)=-x·π/4096(x为相位偏移值)计算出相位值,相位值位于+π与-π之间。
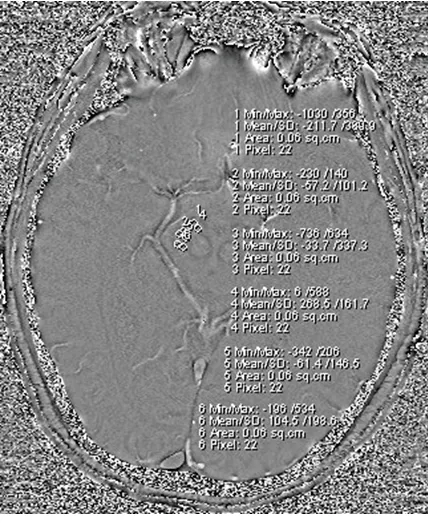
图1 黑质相位偏移的测量
注:PD患者右侧黑质,由前至后、由外而内依次选取6个圆形ROI,面积约6 mm2。
1.3 统计学分析 采用SPSS 19.0统计学分析软件进行数据分析。计量资料以(x±s)表示,采用独立样本t检验或配对t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 PD组与对照组整体黑质相位值比较 PD组黑质相位值为(-0.15316±0.02289)D,低于对照组的(-0.13915±0.02792)D(t=2.496,P=0.015)。
2.2 PD组与对照组黑质前、中、后区相位值比较 PD组患者黑质的前、中、后区相位值均低于对照组(P<0.05);见表1。

表1 PD组与对照组黑质前、中、后区相位值比较(x±s,D)
2.3 PD组与对照组黑质腹侧、背侧相位值比较 PD组黑质腹侧、背侧相位值均低于对照组(P<0.05);见表2。
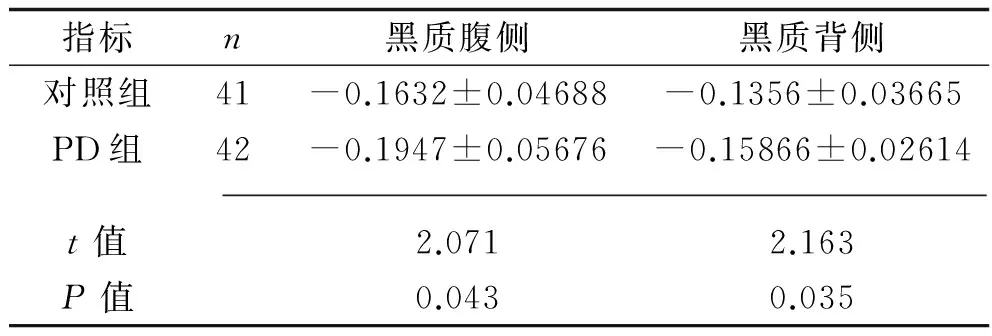
表2 PD组与对照组黑质腹侧、背侧相位值比较(x±s,D)
2.4 PD组患者症状明显侧及对侧肢体整体黑质相位值比较 42例PD患者中,症状明显侧的同侧大脑黑质相位值为(-0.14509±0.03570)D,对侧大脑黑质相位值为(-0.16123±0.03728)D,两侧黑质相位值比较,差异无统计学意义(t=1.818,P=0.077)。
3 讨 论
黑质是中脑最大的神经核团,呈对称性分布,横断面上呈半月形,由背侧的致密带(substania nigra compacta,SNc)和腹侧网状带(substania nigra reticularis,SNr)组成。SNc由大多角形或锥体细胞组成,细胞内富含黑色素颗粒;SNr细胞内富含铁元素,细胞数量少。正常情况下,SNr含铁量高于SNc,相位图中表现为SNr相位值低于SNc,且越近腹侧信号减低越明显。
与同龄正常人相比,PD患者脑组织中铁含量无差异,但尸检发现,PD患者黑质内总铁量较正常人高约175%,三价铁含量高达225%[4],提示黑质内至少有一部分活性铁水平升高。黑质内铁异常沉积是引起PD神经元变性死亡的起始原因,在PD神经变性的发展过程中起直接作用,病理表现为黑质细胞萎缩、消失,残存细胞变性,胶质细胞增生,并引起黑质体积减小,随病情进展、病程延长,黑质也会进一步减小[5-6]。 本研究结果显示,PD组患者黑质相位值低于对照组(P<0.05),提示PD患者黑质铁含量增高,与其他学者的研究结果相似[6-9]。本研究结果亦显示,PD组黑质背侧、腹侧及黑质前、中、后部位的相位值均低于对照组(P<0.05),说明PD患者黑质内铁含量呈弥漫性增加,同时累及SNr以及SNc各个区域。该结果与其他文献报告不尽相同[10-12],其中有学者发现PD组SNc相位值低于对照组(P<0.05),但两组SNr相位值无差异(P>0.05),提示PD患者SNc、SNr区域铁含量变化不完全一致。这可能与MRI检查设备、场强高低、扫描参数、ROI的选取、测量方法的差异等因素有关,还可能是检查者对于SNr、SNc影像解剖结构的认识不一致,比如,有的学者将红核黑质之间的白质纤维作为SNc的一部分[13-14]。有学者测量SNr、SNc相位值时,根据黑质解剖位置、形态分别勾画出黑质或者SNr、SNc边缘[15]。而本研究发现PD患者因黑质变性,与周围脑白质分界不清,难以准确勾勒黑质边界;PD患者SNr、SNc铁含量增加、信号减低,两者分界不清,3.0 T以下MR不能准确区分。黄新明等[16]也认为黑质的SNc、SNr分界不清,无法清楚分离,因此将整个黑质作为一个整体进行铁沉积的测量。
本研究将黑质作为一个整体,在黑质内各区域选取多个ROI进行测量,每个ROI大小一致,采用统一标准,根据需要计算相应部位平均相位值,研究黑质内铁含量变化特点。另外本研究应用黑质背侧、腹侧来代表SNc、SNr,也符合MR各序列黑质形态、信号表现,这与Sofic等[4]的研究结果相似。与其他学者应用勾勒黑质边缘测量铁含量方法相比,本方法能更客观、整体评价黑质铁含量变化特点。
本研究结果显示,PD患者肢体症状明显侧大脑黑质相位值与对侧大脑黑质相位值比较无差异,推测可能PD黑质的病理生化改变早于运动症状甚至非运动症状期,在PD的亚临床期或者非运动症状之前已经出现了黑质双侧异常铁沉积。Braak等[17]报告SNc多巴胺神经元丢失达50%~80%时才出现相关临床症状,而且病变初期症状不对称,病变多处于亚临床期;病程处于1~2期时黑质的病理改变就已经存在,DA已经减少、缺失,但因为神经元的异常兴奋性或多巴胺受体的敏感性增强等影响,患者可以没有运动症状,因为1~2期患者主要以非运动症状为主,但是这些症状往往被忽视或者误诊。
应用SWI技术选取多个ROI测量黑质相位值,可以更加客观、准确定量评估PD大脑铁含量,今后我们将继续扩大样本量,深入探索黑质铁沉积含量与PD临床表现之间的关系,以确定PD发病的铁含量的阈值范围。
[1] 任延德,孔庆奎,苏 慧,等.脑微出血的磁敏感加权成像诊断价值[J].医学影像学杂志,2011,21(6):823-826.
[2] Gelb DJ,Oliver E,Gilman S.Diagnostic criteria for Parkinson disease[J].Arch Neurol,1999,56(1):33-39.
[3] Fahn S.Parkinson′s disease:10 years of progress,1997-2007[J].Mov Disord,2010,25(Suppl 1):S2-S14.
[4] Sofic E,Riederer P,Heinsen H,et al.Increased iron(Ⅲ) and total iron content in post mortem substantia nigra of parkinsonian brain[J].J Neural Transm,1988,74(3):199-205.
[5] 王 丰,刘 丽,李晓陵,等.磁敏感加权成像对针刺治疗帕金森病黑质致密带改变的评价[J].针灸临床杂志,2012,28(6):24-26.
[6] Moriwaka F,Tashiro K,Itoh K,et al.Magnetic resonance imaging in Parkinson′s disease--the evaluation of the width of pars compacta on T2 weighted image[J].Rinsho Shinkeigaku,1992,32(1):8-12.
[7] 舒红格,漆剑频,朱文珍,等.帕金森病脑铁沉积的定量研究[J].华中科技大学学报:医学版,2009,38(4):527-530
[8] 王 波,安鸿飞,张 洁,等.3.0TMR磁敏感加权成像对早期帕金森病黑质致密带的研究[J].昆明医科大学学报,2014,35(2):27-30.
[9] 王书健,邓克学,郑春生,等.SWI测量脑铁沉积在帕金森病中的临床应用价值[J].安徽医科大学学报,2013,48(5):523-526.
[10]Zhang W,Sun SG,Jing YH,et al.Determination of brain iron content in patients with Parkinson′s disease using magnetic susceptibility imaging[J].Neuroscience Bulletin,2009,25(6):353-360.
[11]刘 放,申宝忠,王 丹,等.应用磁敏感加权成像检测帕金森病患者脑铁含量变化的初步研究[J].现代生物医学进展,2012,12(30):5 845-5 847,5 910.
[12]王 慈,范国光,刘 芳,等.磁敏感加权成像中脑定量测量在帕金森病中的初步应用[J].中国医学影像技术,2011,27(6):1 129-1 133.
[13]王 波,戴敏方.帕金森病的MRI研究进展[J].磁共振成像,2013,4(6):459-462.
[14]Levin BE,Katzen HL,Maudsley A,et al.Whole-brain proton MR spectroscopic imaging in Parkinson′s disease[J].J Neuroimaging,2014,24(1):39-44.
[15]陶 静,周 滟,戈 欣,等.SWI序列在早期原发性帕金森病中的应用价值[J].医学影像学杂志,2009,19(9):1 073-1 077.
[16]黄新明,孙 斌,薛蕴菁,等.磁敏感加权成像检测帕金森病患者脑铁沉积[J].中华医学杂志,2010,90(43):3 054-3 058.
[17]Braak H,Del Tredici K,Rüb U,et al.Staging of brain pathology related to sporadic Parkinson′s disease[J].Neurobiol Aging,2002,24(2):197-211.
Detection of iron content in substantia nigra by susceptibility weighted imaging in patients with Parkinson′s disease
RENYan-de1,2,LONGLi-ling1,LIXiang-rong1,QINYu-hong1,LIChun-yan1,DAIYi1,JIANGMu-liang1,YEWei1
(1DepartmentofRadiology,theFirstAffiliatedHospitalofGuangxiMedicalUniversity,Nanning530021,China;2DepartmentofRadiology,theAffiliatedHospitalofQingdaoUniversity,Qingdao266003,China)
Objective To investigate the application value of susceptibility weighted imaging(SWI) for the detection of iron content in the substantia nigra in the patients with Parkinson′s disease(PD).Methods Forty-two patients with PD(PD group) and 41 normal individuals(control group) underwent SWI examination.Then the phase images were selected for statistical analysis.Three circular regions of interest(ROI) with equal size were selected from dorsal side and ventral side of the substantia nigra separately.The phase radian of each ROI was measured,and then the phase values were calculated with the formula.Results Compared to the control group,the phase values of the substantia nigra in the PD group reduced(P<0.05),and the phase values of the anterior,middle and posterior parts,ventral and dorsal parts of the substantia nigra in the PD group were all significantly less than those in the control group(P<0.05).There was no significant difference in the phase values of the substantia nigra between the side with obvious symptoms and the opposite side(P>0.05).Conclusion The iron content increase simultaneously in the substantia nigra of patients with PD.Selection of multiple ROIs in the substantia nigra for measuring the phase values of the substantia nigra can provide an objective and overall evaluation for the changes of the iron content in the substantia nigra of patients with PD.
Parkinson′s disease,Substantia nigra,Susceptibility-weighted imaging,Phase value,Iron
国家自然科学基金(81260215);广西自然科学基金(2012GXNSFAA053142)
任延德(1973~),男,博士,副主任医师,研究方向:神经系统影像诊断与研究。
李向荣(1973~),男,硕士,副主任医师,研究方向:神经系统影像诊断与研究,E-mail:lxr99@sina.com。
R 742.5
A
0253-4304(2016)06-0770-03
10.11675/j.issn.0253-4304.2016.06.05
2016-02-11
2016-04-22)

