miR-126在子痫前期胎盘中的表达及其对血管生成的影响
李仲均 黄丽珊 萧丽娟 李婵 赵继红 黄素然
南方医科大学附属东莞人民医院(广东东莞 523059)
子痫前期是在妊娠20周后出现的以高血压、蛋白尿、水肿为特征的妊娠期特发性疾病,是孕产妇和围生儿死亡的重要原因。子痫前期的病因和发病机制迄今仍未完全阐明。目前研究认为,胎盘血管重铸异常导致胎盘缺血缺氧是子痫前期发病的关键环节。胎盘血管重铸过程受到多种因素的共同调节。既往的研究主要集中在sFlt1、VEGF等细胞因子表达失调方面[1]。近年来,DNA甲基化、非编码RNA调控等表观遗传学变化在胎盘血管生成中的作用受到越来越多的关注[2]。miR-126属于内源性非编码RNA,在血管内皮细胞中表达丰富。已经有研究显示,miR-126在子痫前期患者中呈低表达[3],但其具体的作用尚不清楚。本研究采用实时荧光定量PCR检测miR-126在子痫前期胎盘中的表达情况,分析其与胎盘微血管密度的相关性。利用体外细胞实验观察miR-126对血管内皮细胞增殖、迁移和小管形成的影响,探讨其中可能的机制。
1 资料与方法
1.1 一般资料选取2014年1月至2016年12月期间在南方医科大学附属东莞人民医院妇产科住院分娩的轻度和重度子痫前期孕产妇各25例。轻度子痫前期组平均年龄(30.2±5.1)岁,平均孕周(37.8±1.2)周,重度子痫前期组平均年龄(29.7±6.7)岁,平均孕周(37.2±1.9)周。选取年龄、孕周匹配的正常妊娠孕产妇25例作为对照,平均年龄(30.5±4.8)岁,平均孕周(37.9±1.2)周。子痫前期组与正常妊娠组孕产妇年龄、孕次和孕周比较,差异无统计学意义(P>0.05)。子痫前期的诊断标准参照乐杰主编的《妇产科学》(第7版)。入选的孕产妇均无慢性高血压、糖尿病、肾病等原发性内科疾病或其他产科并发症。
1.2 组织样本和细胞系孕产妇分娩后立即收集胎盘组织,从近脐带附着处切取胎盘全层组织2块,每个组织块大小约为1 cm×1 cm×0.2 cm,用预冷的灭菌生理盐水快速冲洗3次除去血污,其中一份装入1.5 mL的EP管,置于-80℃冰箱保存;另一份组织加入10%中性福尔马林固定24 h,梯度脱水后用石蜡包埋备用。本研究使用的组织标本通过医院伦理委员会审核批准。人血管内皮细胞株HMEC-1购自中国科学院上海细胞库。HMEC-1细胞在含10%胎牛血清的DMEM培养基中,37℃、5%CO2及95%空气饱和湿度条件下培养。当细胞生长达80%~90%融合后,使用胰蛋白酶消化传代。取对数生长期的细胞进行实验。
1.3 qRT-PCR使用RNAiso Plus提取总RNA;应用miRcute miRNA First-Strand cDNA Synthesis Kit将miRNA逆转录成cDNA;应用miRcute miRNA qPCR Detection Kit进行real-time PCR。miR-126特异引物序列为5′-CAUUAUUACUUUUGGUACGCG-3;U6特异引物序列为5′-GCTTCGGCAGCACATATACTAAAAT-3′;PCR反应参数为:95℃预变性5 min,95℃变性10 s,60℃退火20 s,72℃延伸10 s,共35个循环。
1.4 CCK-8法检测细胞增殖在不同时间点分别向每孔加入10 μL CCK-8应用液,置于细胞培养箱内避光继续培养1 h,酶联免疫检测仪检测波长为450 nm处的吸光度值,绘制细胞生长曲线。
1.5 细胞迁移实验用无血清培养基制成1×105/mL的细胞悬液,以每孔100 μL接种于Transwell的上室,下室加入500 μL含10%胎牛血清的完全培养基,37℃培养48 h后,用棉签擦去上室细胞,4%多聚甲醛固定,结晶紫染色,100倍镜下随机取5个视野,计算迁移细胞平均数目。
1.6 小管形成实验在培养板底部加入0.3 mL Matrigel,铺平后于37℃静置10 h。将细胞用无血清培养基制成1×105/mL的细胞悬液,以每孔100 μL接种,培养12 h,弃去旧培养液,加入含10%胎牛血清的完全培养基,继续培养24 h。在倒置显微镜下观察小管形成情况。
1.7 统计学方法统计学分析采用SPSS 17.0软件。数据采用均数±标准差(±s)或中位数(IQR)表示。两组间比较采用t检验。相关性分析采用Spearman相关分析。P<0.05认为差异有统计学意义。
2 结果
2.1 miR-126表达及其与微血管密度的关系qRT-PCR结果显示,miR-126在重度子痫前期组胎盘中的表达水平低轻度子痫前期组和正常妊娠组,3组间比较,差异具有统计学意义(P<0.05)。见图1。重度子痫前期组胎盘微血管密度值低于轻度子痫前期组和正常妊娠组,3组间比较,差异具有统计学意义(P<0.05)。胎盘组织中miR-126表达水平与微血管密度呈正相关关系(r=0.309,P=0.007)。见图2。
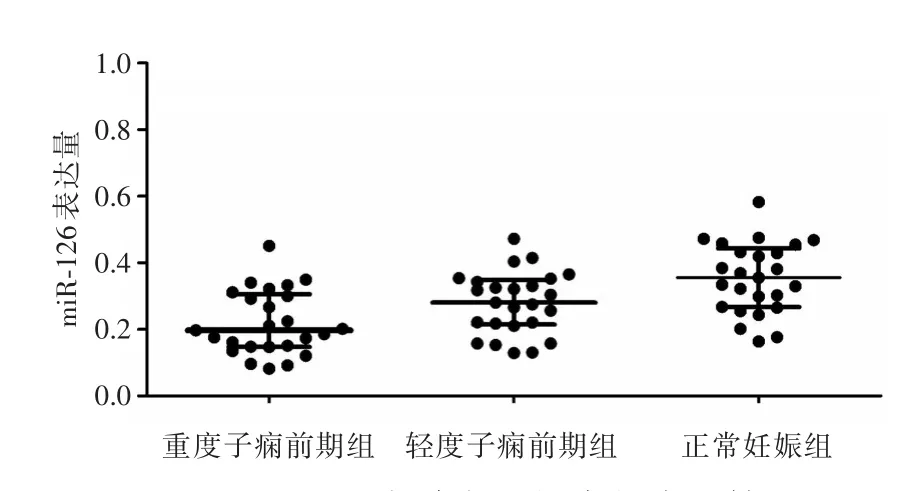
图1 miR-126在胎盘组织中的表达情况Fig.1 The expression of miR-126 in placental tissue of different groups
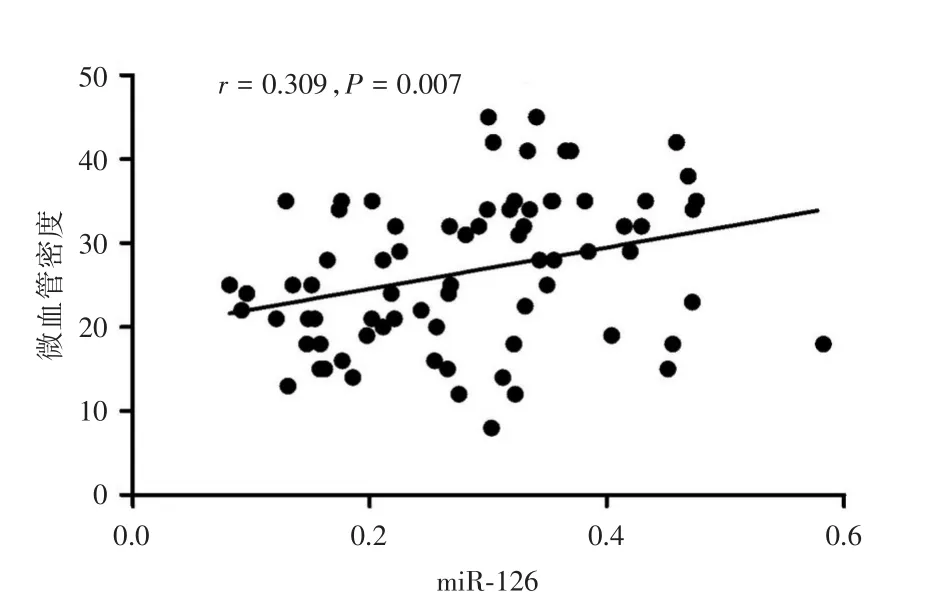
图2 胎盘组织中miR-126表达量与微血管密度的相关性分析Fig.2 The correlation between miR-126 and microvascular density
2.2 miR-126对血管内皮细胞增殖能力的影响miR-126 antagomir转染后 72、96 h,血管内皮细胞株HMEC-1生长抑制率分别为(19.65±0.17)%和(17.12±0.21)%,细胞增殖能力较对照组降低,差异具有统计学意义(P<0.05)。见图3。
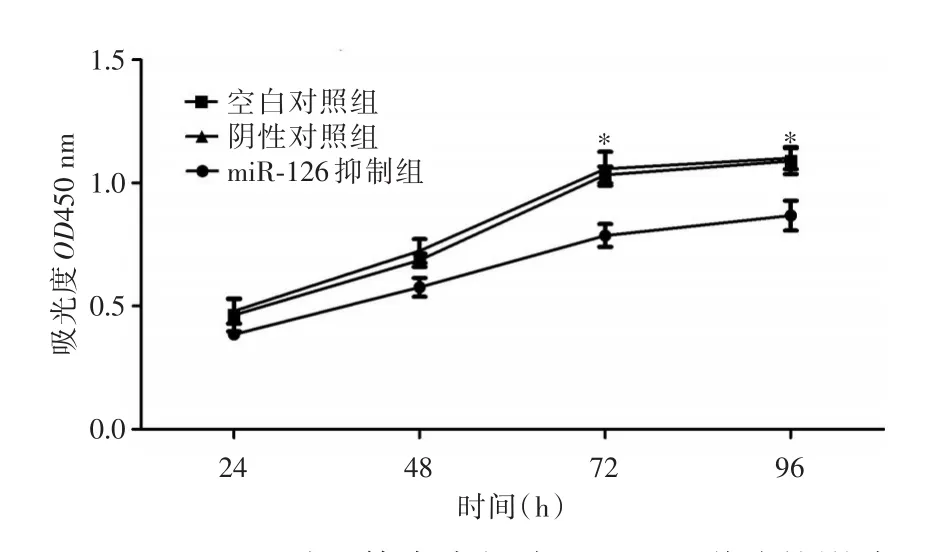
图3 miR-126对血管内皮细胞HMEC-1增殖的影响Fig.3 The effect of miR-126 on the proliferation of HMEC-1 cells
2.3 miR-126对血管内皮细胞迁移能力影响Transwell小室装置检测结果显示,转染miR-126 antagomir后HMEC-1细胞株的穿膜细胞数(28.33±6.51)个,明显低于空白对照组(52.00±12.77)个和阴性对照组(48.33±14.22)个,差异具有统计学意义(P<0.05)。见图4。

图4 miR-126对血管内皮细胞HMEC-1迁移的影响Fig.4 Detection of cell migration after transfected with miR-126 mimics in HMEC-1 cells
2.4 miR-126对血管内皮细胞小管形成的影响转染miR-126 antagomir后HMEC-1细胞株的小管形成度[(3.83± 1.89)mm/mm2]明显低于空白对照组[(6.17±3.25)mm/mm2]和阴性对照组[(5.97±2.95)mm/mm2],差异具有统计学意义(P < 0.05)。见图5。
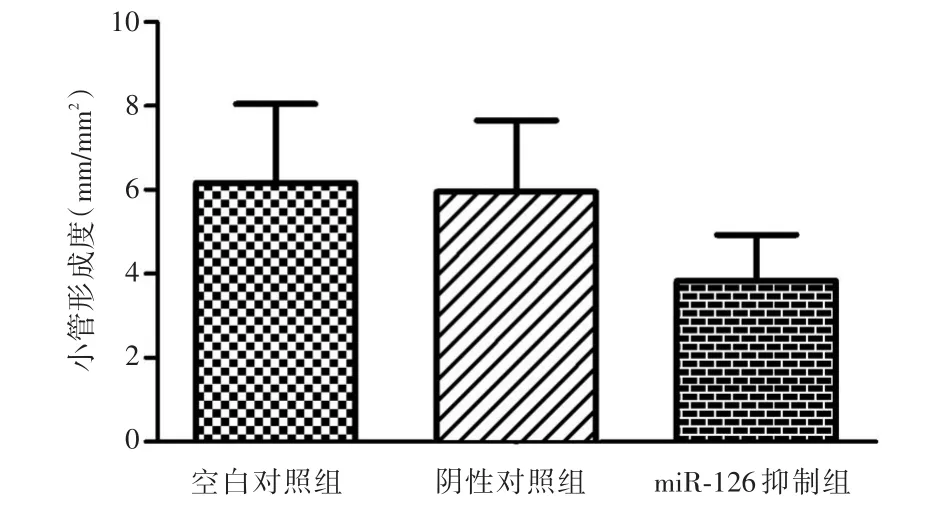
图5 miR-126对血管内皮细胞HMEC-1小管形成的影响Fig.5 Analysis of effect of miR-126 on tube formation of HMEC-1 cells
3 讨论
子痫前期是妊娠最常见的并发症之一。在西方发达国家发病率约为2%~8%,在我国发病率约为9.4%~10.4%[4]。近年来,随着我国生育政策的调整,高龄孕产妇日渐增多,子痫前期的发病率呈上升趋势。子痫前期严重威胁母胎健康,是导致孕产妇和围生儿预后不良的重要原因。在全球范围内每年因子痫前期及相关并发症所致的孕产妇死亡数约为5万例,新生儿死亡数约为9万例[5]。子痫前期发病机制复杂,涉及遗传、免疫和环境等众多因素的相互作用[6]。既往对子痫前期的遗传学研究主要集中在遗传易感性方面,近年来随着分子生物学技术的快速发展,DNA甲基化、染色质重塑、组蛋白修饰、非编码RNA调控等表观遗传学异常改变在子痫前期发病中的作用受到越来越多的关注[7-8]。miRNA是一类长19 ~ 25 nt的内源性非编码RNA,可通过与靶基因mRNA的3′非编码区(3′UTRs)特异性结合,诱导靶基因mRNA降解或者阻遏其转录后翻译,从而调控基因表达。miRNA具有进化保守性、组织特异性、表达时序性和基因簇集性等生物学特征。目前已有多个研究发现在子痫前期孕产妇的胎盘和血清中存在多种差异化表达的miRNA。2011年,ENQUOBAHRIE等[9]利用基因芯片技术对20例子痫前期患者和20例正常孕产妇进行检测,发现子痫前期患者的胎盘组织中存在8种异常表达的miRNA,其中miR-1、miR-139-5p、miR-1247、miR-34C-5P、miR-328、miR-500、miR-584表达下调,而miR-210表达上调。2013年,BETONI等[10]对包括自身在内的共9个独立研究进行荟萃分析,结果显示在子痫前期孕产妇的胎盘组织中存在至少20个异常表达的miRNA。
miR-126是一种血管内皮细胞特异性高表达的miRNA,其基因定位于人类染色体9q34.3,可由3个不同的表皮生长因子样结构域蛋白7(epidermal growth factor like domain protein multiple 7)基因转录产生[11]。miR-126通过调控细胞增殖、凋亡、迁移等生物学功能,在血管新生、血管重塑和创伤修复方面发挥重要的作用。miR-126基因敲除可导致小鼠胚胎发生血管破裂、多发性出血和严重的系统性水肿而死亡[12]。WANG等[13]通过冠状动脉结扎建立心肌梗死模型,发现miR-126敲除后小鼠心肌血管生成反应明显减弱,提示miR-126对成熟个体组织的血管再生是必需的。已有研究[3]显示,miR-126在子痫前期患者血清和胎盘组织中的表达下调。在本实验中,笔者通过qRT-PCR和免疫组化染色技术对子痫前期和正常妊娠孕妇胎盘组织进行对比研究,验证了miR-126子痫前期组胎盘组织中的表达水平低于正常妊娠组(P<0.05)。此外,本研究还发现子痫前期胎盘组织中miR-126表达水平与胎盘微血管密度呈正相关(r=0.309,P=0.007),提示miR-126可能通过调控胎盘微血管生成参与子痫前期的病理过程。在体外细胞实验中,瞬时转染antagomir抑制HMEC-1血管内皮细胞株中miR-126的表达,发现下调miR-126表达可抑制血管内皮细胞增殖、迁移和小管形成。miRNA的生物学功能主要依赖于其作用的靶基因。miR-126可能通过靶向下调PAK1、SOX-2、VCAM-1等细胞增殖或迁移相关分子,参与血管生成[14-15],是否存在其他途径或分子机制仍然有待深入研究。

