乳腺肿瘤患者外周血中T淋巴细胞表面活化分子和Tregs的表达研究
林帝金,刘纯岳,方俊粤,黄洁珊,林向华
(中山大学孙逸仙纪念医院检验科,广州 510120)
乳腺癌是严重危害女性健康甚至危及生命的恶性肿瘤之一,近年来其发病率有上升趋势,且发病年龄年轻化[1]。在恶性肿瘤患者中,其自身的细胞免疫和T淋巴细胞的活化与肿瘤的发生、发展及治疗密切相关[2]。而在免疫抑制机制和维持自身耐受中,调节性T细胞(Tregs)作为一组具有免疫调节功能的T淋巴细胞亚群,发挥着极其重要的作用[3]。目前对于T淋巴细胞活化分子CD25,CD69和人类白细胞抗原-DR(HLA-DR)在不同肿瘤表达情况的研究不够详尽。本研究拟通过流式细胞术检测乳腺肿瘤患者外周血中T淋巴细胞表面活化分子和Tregs的表达,探讨其在乳腺肿瘤患者病情判断及疗效监测中的临床意义。
1 材料与方法
1.1 研究对象 选取了2016年7月~2017年12月在中山大学孙逸仙纪念医院进行诊治的245例乳腺肿瘤患者为研究对象,年龄17~83岁,平均年龄43.66(s=1.18)岁。其中恶性乳腺肿瘤组(malignant tumors,MT)139例,按TNM分期:Ⅰ期32例,Ⅱ期70例,Ⅲ期23例,Ⅳ期14例;按淋巴结是否转移分:65例无淋巴结转移,74例有淋巴结转移。良性乳腺肿瘤组(benign tumors,BT)106例:包括良性叶状肿瘤2例,巨大积乳囊肿1例,纤维腺瘤85例,错构瘤3例,脂肪瘤2例,导管内乳头状瘤13例。所有病例均排除肝炎[4~6]、自身免疫性疾病及其他肿瘤,按照国际抗癌协会标准进行TNM临床分期[7]。另选取健康对照组(healthy controls,HC)50例,年龄23~46岁,平均年龄35.13(s=8.26)岁。
1.2 试剂与仪器 美国Beckman Coulter Navios流式细胞仪;单克隆抗体:CD45 PE-Cy7(批号:198),CD8 FITC(批号:44),CD4 PE(批号:41),CD3 ECD(批号:112),HLA-DR PE-Cy5(批号:35),CD25 PE(批号:36),CD69 PE-Cy5(批号:42),CD4 FITC(批号:43),CD25 PE-Cy5(批号:52),CD127 PE(批号:42);OptiLyseC(批号:48);鞘液(批号:2711126A);清洗液(批号:2607125A);所有试剂均购自美国贝克曼库尔特公司。
1.3 方法
1.3.1 标本采集:用乙二胺四乙酸二钾(EDTA-K2)抗凝管采集研究对象的空腹外周静脉血2 ml,在采集后6 h内处理。
1.3.2 实验步骤:将单克隆抗体按标准用量加入到50 μl全血中与T淋巴细胞表面上相应抗原结合,经过溶血、洗涤等步骤后上机检测,获取淋巴细胞数为1万个。
1.3.3 结果分析:通过CD45/SSC散点图来圈取淋巴细胞并设门分析门内T淋巴细胞群:T淋巴细胞(CD3+)、辅助T淋巴细胞(CD3+CD4+)、抑制T淋巴细胞(CD3+CD8+)各占淋巴细胞百分比;辅助T淋巴细胞/抑制T淋巴细胞(Th/Ts);CD3+CD25+T淋巴细胞、CD3+CD69+T淋巴细胞、CD3+HLA-DR+T淋巴细胞、CD8+HLA-DR+T淋巴细胞各占T淋巴细胞百分比;Tregs(CD4+CD25+CD127low/-T淋巴细胞)占CD4+T淋巴细胞百分比。
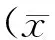
2 结果
2.1 健康对照组、良性肿瘤组和恶性肿瘤组的结果比较 见表1,图1。与健康对照组比较,乳腺肿瘤患者外周血的CD3+CD25+T淋巴细胞、CD3+HLA-DR+T淋巴细胞和CD8+HLA-DR+T淋巴细胞均明显上升,且恶性肿瘤患者较良性肿瘤患者升高更显著。此外,恶性肿瘤患者外周血中Tregs较良性肿瘤患者以及健康对照组均升高,恶性肿瘤患者的CD4+T淋巴细胞较良性肿瘤患者升高显著,以上差异均有统计学意义(P<0.05)。

表1健康对照组、良性肿瘤组和恶性肿瘤组的结果比较±s,%)
注:HC:健康对照组;BT:良性乳腺肿瘤组;MT:恶性乳腺肿瘤组。#:健康对照组与良性乳腺肿瘤组,P<0.05;*:健康对照组和恶性乳腺肿瘤组,P<0.05;Δ:良性乳腺肿瘤组与恶性乳腺肿瘤组,P<0.05。
2.2 恶性乳腺肿瘤TNM分期T细胞活化分子结果 恶性乳腺肿瘤TNM分期之间的T淋巴细胞活化分子结果差异无统计学意义(F=0.359~1.242,P>0.05)。
2.3 恶性乳腺肿瘤淋巴结有无转移之间T淋巴细胞活化分子结果比较 淋巴结无转移组和淋巴结转移组之间的T淋巴细胞活化分子结果差异无统计学意义(F=0.143~2.561,P>0.05)。

(A).CD3+CD25+T淋巴细胞%;(B).CD3+HLA-DR+T淋巴细胞%;(C).CD8+HLA-DR+T淋巴细胞%;(D).Tregs。
图1 HC组、BT组和MT组CD3+CD25+T淋巴细胞百分率比较
3 讨论
近年来的研究表明[8]肿瘤的发生、发展、转移与机体免疫监视有关,活化后的T淋巴细胞发挥重要的免疫监视作用。T淋巴细胞在不同活化阶段会表达不同的活化分子,CD69分子是T淋巴细胞被激活后通过T淋巴细胞受体(TCR)信号通路活化的一个最早表达于T淋巴细胞表面的活化标记,而在T淋巴细胞静息状态时呈低表达。CD25分子是白细胞介素2受体的α链,是T淋巴细胞中期活化的表面标记[9]。HLA-DR抗原是MHC-Ⅱ类抗原中表达最频繁的一种,是重要的免疫反应参与者,在抗原递呈和胸腺选择中起作用,属于晚期激活抗原[10]。
本研究结果显示,与健康对照组比较,乳腺肿瘤患者的CD3+CD25+T淋巴细胞、CD3+HLA-DR+T淋巴细胞和CD8+HLA-DR+T淋巴细胞表达量均明显上升,而CD3+CD69+T淋巴细胞表达量无明显变化。有研究发现早期阶段的乳腺癌患者中CD69会有明显表达[11],不同肿瘤患者外周血T淋巴细胞的CD25表达水平均较高[2,10],本文结果与文献报道一致,且恶性肿瘤患者较良性肿瘤患者升高更显著,表明恶性肿瘤患者机体正处于正性免疫状态,此时的T淋巴细胞处于活化状态中后期,因而早期活化标记CD69表达量无明显变化。CD25的表达有利于肿瘤逃避免疫监视,形成免疫耐受,CD69和HLA-DR则在对抗肿瘤的发展和转移中起到协调作用。推测可能是由于乳腺癌对机体的免疫状态起到正性刺激作用,但肿瘤负荷和机体免疫状态之间是否具有可检测的比例关系,且这种正性免疫状态可持续多长时间,发生机制及临床意义值得进一步研究。
调节性T细胞是一群可通过抑制其它免疫效应细胞的激活和增殖的免疫负调控T细胞亚群,Tregs形成的免疫无能和免疫抑制两大功能使肿瘤逃离机体的抗肿瘤免疫[3,10]。明亚芳等[12]人研究发现,Tregs可以作为区分良恶性肿瘤生物学行为有参考价值的标志。本研究结果表明,恶性肿瘤患者较健康对照者和良性肿瘤患者Tregs显著升高,与文献报道[3,9,10]结果相符。随着肿瘤的恶化程度,机体的免疫功能逐渐紊乱,Tregs也相应升高。但有文献报道[13],在肿瘤患者中Ⅲ~Ⅳ期比Ⅰ~Ⅱ期,病理低分化比病理高分化,淋巴结有转移比淋巴结无转移均有Tregs表达升高的情况。本研究中恶性肿瘤组的分期及淋巴结是否转移对Tregs均无统计学差异,可能与本研究仅以乳腺肿瘤为研究对象,而上述文献报道则以多种恶性肿瘤为研究对象有关。
综上所述,检测乳腺肿瘤患者外周血T淋巴细胞表面分子CD25,HLA-DR,CD69和Tregs的表达可以辅助临床病情判断和动态监测肿瘤发生发展,也可以更好地评估和分析机体免疫调节作用。

