一株极端耐盐菌的分离鉴定及特性
樊 霆,伍玲丽,李云云,刘亚楼,刘 如,叶文玲,陈海燕,潘丹丹
(安徽农业大学 资源与环境学院,农田生态保育与污染防控安徽省重点实验室,安徽 合肥 230036)
耐盐菌可在高盐度环境生存,除在工业生产的生物技术中具有重要的地位[1],还在石油污染治理、工业废水处理、环境修复等方面具有广阔的应用前景[2]。从盐湖、石油污染海水和污水处理厂污泥中筛选的BacillusbadiusD1、Achromobactersp. HZ01、Brevundimonasdiminuta、Acinetobactersp.、HalomonasxianhensisSUR308在1%~10%的盐度范围内能生长,并能降解蒽、石油烃类、柴油、苯酚、辛烷等石油相关产品和污染物[3-8]。高盐度工业废水对传统生物处理产生明显的抑制作用[9]。宋晶等[10]直接驯化嗜盐菌,采用序批式生物膜法处理高盐废水,出水COD去除率能达到90%以上;段金明等[11]从海洋沉积物中筛选出1株高效脱氮嗜盐好氧反硝化菌SF16在含盐废水/富营养化水体处理工程中具有良好应用前景;张培玉等[12]研究了1株中度嗜盐异硝化菌gs2的脱氮特性和耐盐性能,结果表明该菌株可独立完成生物脱氮的全过程;李维国等[13]从盐场晒盐池盐水中分离1株中度嗜盐菌株YS-1,对高盐制革废水生化处理具有强化功能。因此,筛选耐盐菌株并研究其耐盐机制十分重要。目前相关研究耐盐菌主要是通过盐碱地、晒盐场、污水厂污泥、石油污染海水和沉积物中筛选得到,而从危险废物填埋场渗滤液中分离的极端耐盐菌的研究较少。为此,本研究从危废填埋场新鲜高盐渗滤液中分离筛选出1株极度耐盐菌株,通过形态观察和16S rDNA序列分析对菌株进行鉴定,同时对其生长特性、耐盐性及耐盐机理等进行初步分析,旨在为该菌株在高盐环境中污染修复的应用的进一步研究提供数据支撑。
1 材料与方法
1.1 材料
水样取自合肥市吴山危险废物填埋场新鲜渗滤液,带回实验室立即进行筛选。
SC培养基:蛋白胨10.0 g,牛肉膏3.0 g,NaCl 5.0 g,蒸馏水1 L,pH值7.6。固体培养基加琼脂15.0~20.0 g·L-1。
LB培养基:胰蛋白胨10.0 g,酵母提取物5.0 g,NaCl 5.0 g,蒸馏水1 L,pH值7.0~7.3。
M63培养基[14]:K2HSO413.6 g,(NH4)2SO42.0 g,FeSO4·7H2O 0.5 mg,MgSO40.25 g,葡萄糖10 g,蒸馏水1 L,pH值7.0~7.3。
以上培养基都需在121 ℃的高温高压条件下灭菌30 min。
1.2 仪器与设备
STARTER 2100实验室pH计,上海梅特勒-托利多仪器有限公司;UV759紫外-可见分光光度计,上海精密科学仪器有限公司;OLYMPUS CX41生物显微镜,日本OLYMPUS公司;Z36 HK台式离心机,德国HERMLE Labortechnik GmbH公司;HZ-9210K摇床,金坛市杰瑞尔电器有限公司;BSA224S电子天平,北京赛多利斯科学仪器有限公司;PWT-P75B恒温培养箱,合肥华德利科学器材有限公司;GR1100A立式自动压力蒸汽灭菌器,厦门致微仪器有限公司;SW-OJ-1FD洁净工作台,苏州安泰空气科技有限公司;DHG-9140A电热鼓风干燥箱,上海恒科仪器有限公司。
1.3 方法
1.3.1 菌株NY-1的筛选
取吴山危险废物填埋场新鲜渗滤液,稀释10倍、100倍涂布在SC固体培养基平板上,于30 ℃培养 1~2 d。挑取单菌落至平板划线培养,反复挑取分离后,接入具有10%、15%、20%和30%盐质量分数的SC固体培养基,多次纯化后得到耐盐的菌株(NY-1),接入斜面30 ℃培养1 d,4 ℃冰箱中保存备用。
1.3.2 菌株NY-1的鉴定
将筛选得到的菌株YN-1接种于SC固体培养基上,30 ℃培养24 h,用肉眼观察菌落形态[15],并按文献[16]对菌株进行革兰氏染色,利用电子显微镜观察。
菌种鉴定采用16S rDNA基因序列分析,使用TaKaRa 16SrDNA Bacterial Identification PCR Kit(Code No. RR176),进行PCR扩增目的片段,以SEQ Forward、SEQ Internal和SEQ Reverse为引物扩增出菌株的基因序列,测序由宝生物工程(大连)有限公司完成。测序结果在NCBI数据库用BLAST软件于GenBank中进行同源性比较[17]。在MEGA 7.0软件选择邻接法(Neighbor-Joining)对菌株的序列进行同源性分析并构建其系统发育树[18]。
1.3.3 菌悬液制备及培养条件
挑取生长良好单菌落接种于SC液体培养基中30 ℃、转速为120 r·min-1下振荡培养24 h,后4 000 r·min-1离心10 min,利用无菌水将菌体细胞反复清洗2~3次,再将菌体细胞重悬于无菌水中,制成每毫升约1.0×108个菌体细胞的菌悬液,4 ℃冰箱中保存备用。
1.3.4 菌株NY-1的生长特性实验
分别在不同的NaCl质量分数(0、10%、15%、20%、25%、30%),不同pH值(5.0、6.0、6.5、7.0、7.5、8.0),不同盐质量分数培养基(SC液体培养基、LB培养基和M63培养基)中,接种2 mL菌悬液,于30 ℃、转速为120 r·min-1的条件下振荡培养2 d。在不同生长期取得的菌悬液,采用分光光度计,测定菌液的D600(扣除培养基的D600值),测定3次取平均值。
1.3.5 不同盐度对NY-1胞内阳离子的影响实验
接种2 mL菌悬液于NaCl的质量分数为0%、10%、15%、20%、25%、30%的SC液体培养基中,培养到对数生长期后期,取50 mL于5 000 r·min-1离心15 min,倒掉清液,加入10 mL去离子水与菌泥混匀后于水浴锅内沸水浴10 min,于12 000 r·min-1离心20 min取上清液定容到10 mL为待测样品[19],用ICP测定K+、Na+、Mg2+、Ca2+的含量。
2 结果与分析
2.1 菌种鉴定结果
2.1.1 菌株NY-1的形态学特征
挑取单菌落至平板划线培养,反复挑取分离纯化获得1株耐盐菌株,编号为NY-1,在SC固体培养基上,菌株生长较快,呈乳白色,正反面均匀一致;菌落小,边缘整齐,单菌落为圆形,直径1~2 mm;表面湿润光滑,均匀,有光泽,容易被挑起(图1)。显微镜下观察细胞呈杆状,无芽孢,革兰氏染色阴性(图2)。
图1 菌株NY-1的菌落特征Fig.1 The colony characteristics of strain NY-1
图2 菌株NY-1的革兰氏染色图(1 000×)Fig.2 The Gram-staining of strain NY-1(1 000×)
2.1.2 NY-1的16S rDNA鉴定
对NY-1菌株进行16S rDNA测序分析,结果表明该片段有1 448 bp。将获得的序列在 GenBank中使用Blast软件进行同源性分析,结果表明该序列与Achromobactersp.的16S rDNA序列的同源性高达99%。用MEGA 7.0软件采用邻近法构建系统发育树(图3),结果表明该菌在系统发育树上与Achromobactersp.相似度达99%。综合菌株的形态观察、16S rDNA序列比对结果,可确定NY-1菌株属于无色杆菌属(Achromobactersp.)。
2.2 菌株NY-1的生长特性
2.2.1 不同盐质量分数对菌株NY-1生长的影响
由图4可知,菌株NY-1在0~30%盐质量分数范围内均能生长。CK与不同盐质量分数下菌株NY-1的生长曲线趋势大致相同。CK条件下,NY-1在6~11 h处于对数生长期;不同盐质量分数条件下,0~6 h为停滞期,在6~10 h处于对数生长期。不同盐质量分数对菌株NY-1在4个生长阶段均出现抑制作用。随着盐质量分数增加,对NY-1生长抑制作用增强,生长量持续降低,生长速度明显减缓,25%和30%盐质量分数下,生长量急剧下降。
2.2.2 pH对菌株NY-1生长的影响
由图5可知,菌株NY-1在pH值5.5~8.0范围内均有生长。当pH值小于6.5其生长量都明显降低,这可能是由于每种微生物都有其生长的最适pH值,pH值过高或过低都会影响微生物酶的分泌及活性,从而抑制微生物生长。因此弱碱性条件下最有利于菌株NY-1的生长,最佳生长pH为7.0。

图3 菌株 NY-1的16S rDNA基因序列系统发育树Fig.3 Phylogenetic tree of strain NY-1 based on 16S rDNA gene sequence

图4 不同盐质量分数下NY-1的生长曲线Fig.4 Growth curve of strain NY-1 in different salinity
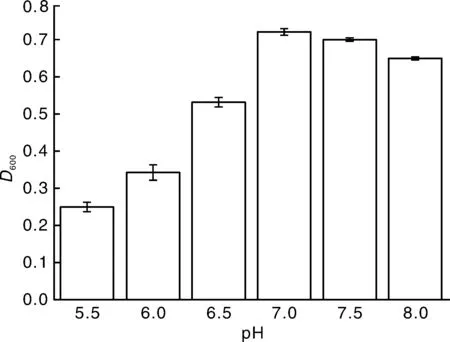
图5 pH对NY-1生长的影响Fig.5 Effects of pH value on the growth of strain NY-1
2.2.3 不同培养基对菌株NY-1生长的影响

图6 不同培养基对NY-1生长的影响Fig.6 Effects of different culture medium on the growth of strain NY-1
由图6可知,NY-1在0~30%盐质量分数的SC培养基、LB培养基、M63培养基中均能生长,具有较强的耐盐能力,在3种培养基中NY-1生长随盐质量分数增加呈现下降趋势,在相同的盐质量分数时,NY-1在LB培养基中的生长量最大。
2.3 不同盐质量分数对NY-1胞内阳离子的影响
由图7可以看出,NY-1在不同的盐质量分数下细胞内的Ca2+和Mg2+的含量都比较低,随着盐质量分数增加,Ca2+和Mg2+浓度均呈现下降趋势,20%~30%盐质量分数范围内,Ca2+和Mg2+浓度趋于稳定;K+浓度呈现先升高后下降趋势,在15%~20%时达到最大;Na+浓度呈现不断上升趋势,且增幅较大。
3 讨论
高盐度污染土壤和废水都抑制传统生物处理中非耐盐微生物的生长代谢,使生物处理效果降低甚至消失[20-21]。因此从长期受盐度污染的环境中筛选耐盐菌株,是修复石油污染盐碱化土壤和处理高盐废水的首要前提[22-24]。本文从危险废物填埋场垃圾渗滤液中获得NY-1菌株,16S rDNA基因序列相似性搜索和系统发育地位的分析结果表明,菌株NY-1与Achromobactersp.、Alcaligenessp. LD114、AchromobacterdenitrificansS1、AchromobacterxylosoxidansAU1011在分子进化上存在着近缘关系(图2)。菌株NY-1与Achromobactersp.关系较为密切,结合形态观察,该菌株为Achromobactersp.。

图7 不同盐质量分数对NY-1胞内阳离子的影响Fig.7 Effects of different salinity on intracellular cations concentration of strain NY-1
本文筛选的Achromobactersp. NY-1菌株可以耐受0~30%的NaCl,最适宜的生长盐度为10%~20%,根据对盐的耐受程度可将嗜盐菌分为6类[25]:非嗜盐菌(以NaCl浓度计,<1.17%)、弱嗜盐菌(1.17%~2.93%)、中等嗜盐菌(2.93%~14.63%)、临界极端嗜盐菌(14.63%~23.38%)、极端嗜盐菌(23.28%~34.48%)、极端耐盐菌(非嗜盐耐盐度达14.63%)。因此,该菌属于典型的极端耐盐菌。耐盐模式菌株H.werneckii和W.ichthyophaga可生长的最高NaCl质量分数分别为29%和30.4%[2]。此外,从环氧树脂废水处理系统的活性污泥中筛选的Bacillussp.和Virgibacillussp.最佳生长条件为:温度30 ℃,pH为7.0,NaCl为30 g·L-1[26]。因此,菌株NY-1具有极强的耐盐性。
具有耐盐能力的无色杆菌成员较少,从原油污染海湾筛选的Achromobactersp.,在NaCl 30 g·L-1,温度28 ℃,pH 7.5条件下生长最佳[4]。本文筛选的NY-1在pH为7.0、盐质量分数为10%~20%的LB培养基中生长最佳。为能在高盐环境中生存,细菌需消耗大量能量调整自身的代谢途径来抵御高盐环境,因此,用于生长繁殖的能量相对减少,导致自身生长缓慢[2];NY-1在LB培养基中生长最好,可能是因LB培养基中含有复杂的营养组成,某些组分可能会被NY-1吸收利用或者对其产生某种生理作用,从而提高其耐盐能力,这与文献报道一致[14]。
高盐胁迫下,大多数微生物在细胞内会合成并积累相容性物质,维持胞内低水平的Na+浓度以免受毒害[27],也可能具有浓缩K+和排斥Na+的能力,平衡细胞内外渗透压,在高盐环境中保持细胞结构稳定并能很好地生存[28]。为了查明NY-1的耐盐机制,本研究测定并分析了NY-1胞内Ca2+、Mg2+、K+和Na+的浓度随盐质量分数的变化,当盐质量分数由0升至20%时,NY-1细胞通过吸收K+和Na+来维持胞内的渗透平衡,同时,NY-1需要通过释放Ca2+和Mg2+来维持细胞内的电中性的环境。当盐质量分数高于20%时,NY-1吸收运输K+的能力增强[29],通过持续向外界释放Na+来抵抗干扰,保证NY-1在高Na+条件下维持正常生长,这与前人研究结果基本符合[19]。菌株NY-1极端耐盐可能还存在其他的调节机制,如将Na+储存在细胞内的某个特殊部位,抑制高盐度对细胞产生的毒害作用,以及胞内在高盐环境会合成并积累相容性物质等,还需进一步研究。另外,该菌株在高盐废水处理、石油污染水体和土壤修复的应用研究还需进行,本研究的结果可为进一步探索该菌株的耐盐机理以及抗盐基因工程菌的研究提供理论及应用基础。

