改善杨梅露酒色泽稳定性的研究
夏其乐,曹 艳,陈剑兵,韩延超,刘瑞玲
(浙江省农业科学院 食品科学研究所,农业农村部果品采后处理重点实验室,浙江省果蔬保鲜与加工技术研究重点实验室,浙江 杭州 310021)
杨梅(MyricarubraSieb. et Zucc.)属于杨梅科杨梅属植物,主产于浙江、福建、江苏等省,其中以浙江栽培品种最多,产量最高,品质最优[1-2]。杨梅酸甜适口,除含有丰富的碳水化合物、膳食纤维和维生素等营养物质外,还富含花色苷、黄酮和多酚类活性成分,具有杀菌消炎、调节人体机能等功效[3-4]。杨梅成熟于6、7月份,采摘期和贮藏期都非常短,极易腐烂,除鲜食外,大量用于加工成果汁、蜜饯和露酒等产品。以水果为原料发酵或浸提加工而成的各类果酒具有一定的营养保健功能,近年来需求量逐渐增加,杨梅露酒色泽诱人、口感香醇,深受江浙一带人们的喜爱。
杨梅露酒诱人的色泽是杨梅所含的花色苷溶出呈色的结果,但花色苷不稳定,导致露酒鲜亮的色泽在加工或者贮藏过程中容易褪去或变成黄褐色,严重影响其商品特性。在溶液体系中,花色苷存在着4种平衡结构:黄烊阳离子(红色)、醌式碱(蓝色)、查尔酮和甲醇式假碱(无色),这4种结构随着溶液pH的变化而相互转化,从而使溶液呈现出不同的颜色[5]。除pH外,花色苷的色泽还受到酶、温度、光照、金属离子、氧气、抗坏血酸甚至花色苷自身浓度和结构的影响[6-8]。庞学群等[9]发现酚类物质被多酚氧化酶氧化形成的醌可加速花色苷的降解。陈健初[10]发现抗坏血酸能显著降低杨梅汁花色苷的稳定性,高浓度糖可延缓其降解,槲皮素能提高其稳定性。氧气、维生素C、高温和光照均可破坏杨梅果汁花色苷稳定性[11-12]。此外,花色苷分子上的糖、甲氧基和羟基对其色泽稳定性均有很大影响,因此,可通过添加能够改变花色苷分子基团的物质提高花色苷稳定性,如辅色素。辅色素可与花色苷发生相互作用而产生增色效应,使吸收光谱图中发生红移,这些物质包括多酚、天然色素、类黄酮、生物碱、氨基酸、有机酸、核苷酸和多糖等[11,13-14],而关于杨梅露酒花色苷的稳定性方面的研究尚未见报道。
本研究以杨梅浸提露酒为原料,通过研究温度、光照及添加不同浓度有机酸、氨基酸、金属盐和天然色素对露酒中花色苷含量及其色泽稳定性的影响,同时比较贮藏30 d后不同条件下露酒的色泽保存率和理化指标,确定最适的杨梅露酒护色工艺,为生产高品质杨梅露酒提供理论指导和技术支持。
1 材料与方法
1.1 材料
供试新鲜荸荠种杨梅采摘于浙江省仙居县,当日冷藏车运回实验室。
95%食用乙醇、壳聚糖、苹果酸、对羟基苯甲酸、乙酸、甘氨酸、L-酪氨酸、L-半胱氨酸、水杨酸钠、乙二胺四乙酸二钠、无水氯化钙、杨梅红色素、桑椹红色素和紫甘薯色素均为国产分析纯试剂或食品添加剂。
1.2 主要仪器
超声清洗器;UV-1800 紫外/可见分光光度计(日本岛津公司);Quick-Brix 90 折光率仪(梅特勒-托利多(上海)仪器公司);FE 20 试验室pH计(梅特勒-托利多(上海)仪器公司);AL 104-IC 电子天平(梅特勒-托利多(上海)仪器公司);Color Quest XE型色差仪(美国Hunter Lab公司),等。
1.3 方法
1.3.1 杨梅露酒浸提
根据前期实验结果[15],将新鲜杨梅清洗沥干后浸渍于调配好浓度的食用乙醇中。杨梅鲜果与食用乙醇的比例1.0∶1.5(m/V),浸提用酒基的乙醇体积分数60%,超声波处理40 min,浸提时间30 d后,添加0.3 g·L-1壳聚糖澄清,过滤得杨梅露酒。
1.3.2 温度对杨梅色泽稳定性的影响
取25 mL酒样分别于55、65、75、85、95 ℃下水浴,保持5 h,每1 h取样一次,用pH示差法在510 nm测定其吸光值,以原酒样为对照,参照张燕等[12]的测定花色苷含量的方法,并计算花色苷保存率。根据张燕等[12]的方法,利用Arrhenius方程的变形式计算花色苷热降解动力学方程,以ln(Ct/C0)=-k×t计算一级动力学反应的速率常数(k)。
1.3.3 光照对杨梅色泽稳定性的影响
取25 mL酒样放在254 nm紫外灯下,为了避免因辐照产热而引起降解,酒样要处于冰水混合物中。让光线与液面呈90°垂直照射,每2 h取样1次,用pH示差法在510 nm下测定其吸光值,以原酒样为对照,按照张燕等[12]的方法计算色泽保存率。
1.3.4 辅色素的添加
有机酸对色泽稳定性的影响:取50 mL酒样,添加0、0.5、1.0、1.5 g·L-1苹果酸、对羟基苯甲酸和乙酸,并用紫外分光光度计于510 nm处测定其吸光值,色差仪测定其L*、a*、b*值。根据比尔定律,吸光值与花色苷浓度成正比,因此可以用吸光值表示花色苷浓度[16]。遮光存放于阴暗处,30 d后再测定吸光值及色差。
氨基酸对色泽稳定性的影响:取50 mL已调好的露酒,添加0、0.03、0.06、0.09 g·L-1的甘氨酸、L-酪氨酸和L-半胱氨酸,并用紫外分光光度计于510 nm处测定其吸光值,色差仪测定其L*、a*、b*值,遮光存放于阴暗处,30 d后再测定吸光值及色差。
金属盐对色泽稳定性的影响:取50 mL已调好的露酒,添加0、0.005、0.010、0.015 g·L-1的水杨酸钠、乙二胺四乙酸二钠和无水氯化钙,并用紫外分光光度计于510 nm处测定其吸光值,色差仪测定其L*、a*、b*值,遮光存放于阴暗处,30 d后再测定吸光值及色差。
天然色素对色泽稳定性的影响:取50 mL已调好的露酒,添加0、0.02、0.04、0.06 g·L-1的杨梅红色素、桑椹红色素、紫甘薯色素,并用紫外分光光度计于510 nm处测定其吸光值,色差仪测定其L*、a*、b*值,遮光存放于阴暗处,30 d后再测定吸光值及色差。
1.3.5 色泽保存率的计算
参照方忠祥等[17]的方法,利用分光光度计于510 nm处测定不同处理条件下杨梅露酒存放第1天和第30天的吸光值,计算色泽保存率。
1.4 统计学方法
采用Excel 2007和IBM SPSS Statistics 20软件进行数据分析,每组重复3次,结果以均值±标准差(means±SD)表示,试验数据采用IBM SPSS Statistics 20进行正交设计和差异分析,P<0.05表明差异显著。
2 结果与讨论
2.1 温度对杨梅色泽稳定性的影响
杨梅露酒经不同温度处理后,其中花色苷保存率随时间变化规律如图1所示。从图中可以看出,55 ℃加热前4 h内花色苷浓度略有上升,表明55 ℃不会引起杨梅花色苷的大量降解,可能还可以促进其稳定或与大分子相结合的花色苷的释放。当处理温度继续升高,花色苷保存率随着处理温度的升高和处理时间的延长整体呈下降趋势,95 ℃加热5 h后花色苷损失约为73.3%。较低浓度的花色苷在一定温度范围内可发生自聚合作用,且自聚合作用受浓度、光照、温度等因素的影响较大[18-19],而55 ℃可能是杨梅花色苷自聚集的最适温度,随着温度继续升高,花色苷的稳定性逐渐下降,降解速率加快。
当温度大于65 ℃时,杨梅露酒的-ln(Ct/C0)与热处理时间t之间表现较好的线性关系,如图2所示,表明杨梅露酒在存放期间(3个月内)花色苷降解满足一级动力学方程,与已有报道结果一致[20]。根据Arrhenius方程计算得到杨梅露酒中花色苷的热降解活化能E0为7.23×104kJ·mol-1,大于已报道的不同pH和氧浓度条件下杨梅汁花色苷的热降解活化能[21]。由此表明,虽然杨梅露酒中花色苷浓度在存放3个月后降低,但其稳定性提高。
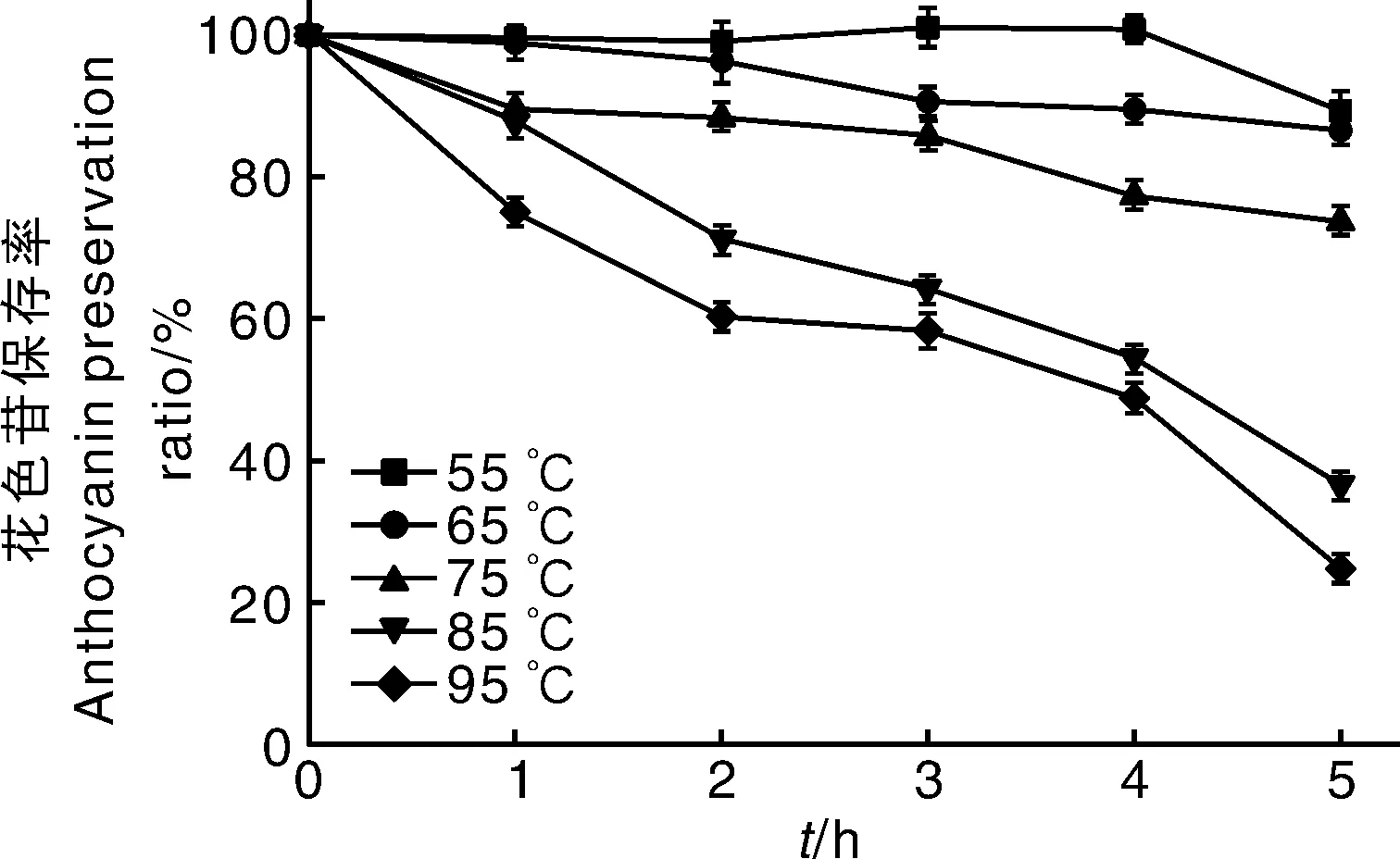
图1 花色苷保存率在不同处理温度和时间条件下的变化规律Fig.1 Changing patterns of the anthocyanins preservation ratio with different temperature and time
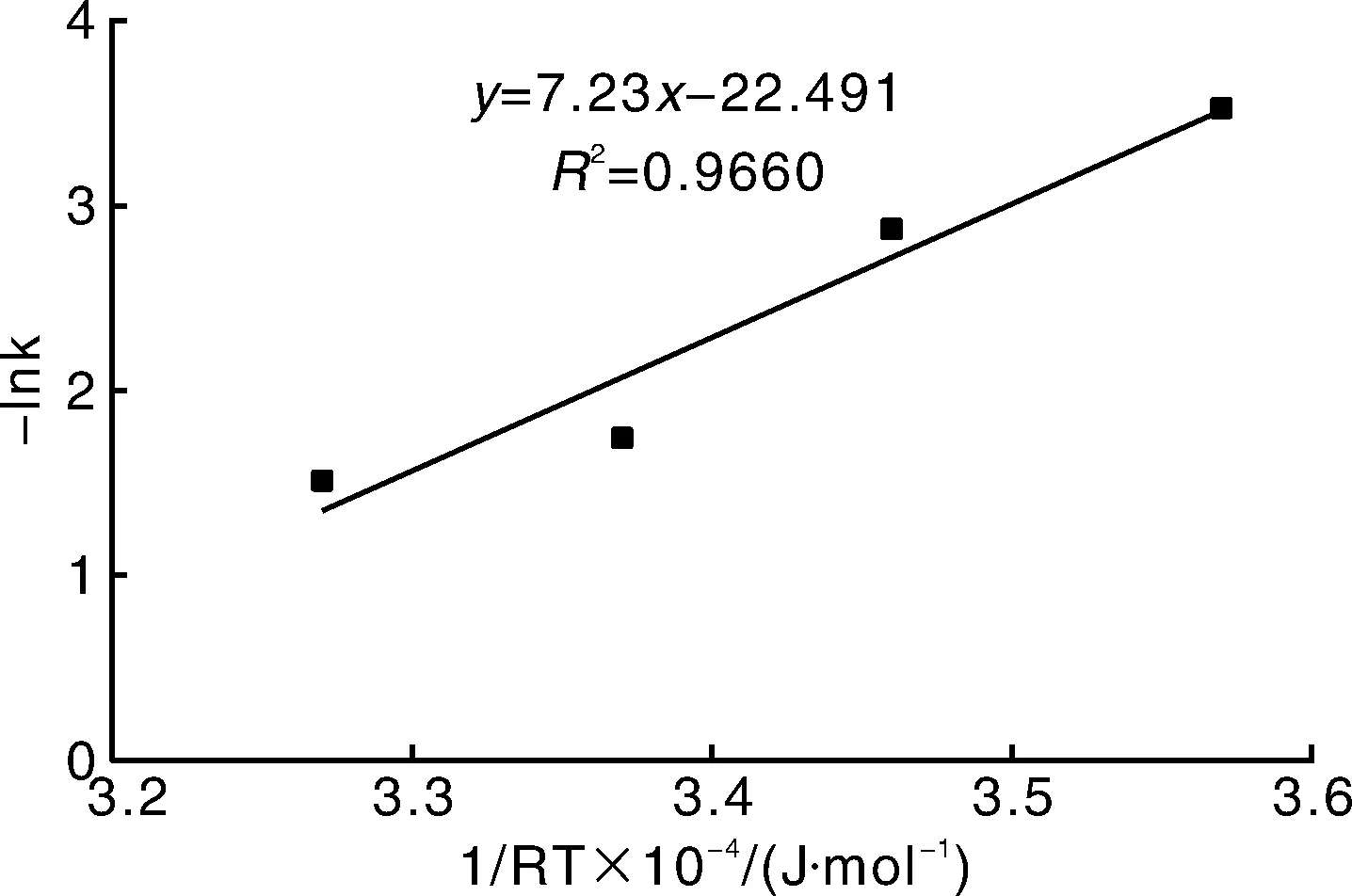
图2 花色苷降解表观速率常数与温度的关系Fig.2 Relationship between anthocyanin degradation apparent rate constant and temperature
2.2 光照对杨梅色泽稳定性的影响
杨梅露酒经紫外照射后其中花色苷含量随时间变化如图3所示。从图中可以看出,相比于温度对花色苷稳定性的影响,光照引起的花色苷的降解相对较平缓。随着紫外照射时间的延长,花色苷损失率逐渐加大,尤其是当照射时间超过4 h之后,花色苷含量呈直线下降,照射10 h即可使其损失20%。由此表明,杨梅露酒应尽量避光保存,不可在光照条件下存放超过4 h。
2.3 辅色素对杨梅露酒色泽稳定性的影响
2.3.1 有机酸对杨梅露酒色泽稳定性的影响
向杨梅露酒中添加不同浓度苹果酸、乙酸和对羟基苯甲酸后,杨梅露酒在510 nm处吸光值(D510)和色差变化如表1所示。从表中可以看出,随着有机酸浓度的增加,D510和色差a*值、b*值逐渐增大,当有机酸的添加量为1.5 g·L-1时,D510和色差a*值、b*值与对照差异显著(P<0.05),以添加1.5 g·L-1乙酸条件下的D510和色差a*值、b*值变化最显著,可能是因为花色苷在酸性环境中稳定性增强[22]。此外,在强酸性环境中(pH<2),花色苷元以黄烊阳离子的形式存在,因此其红色越鲜艳[5]。
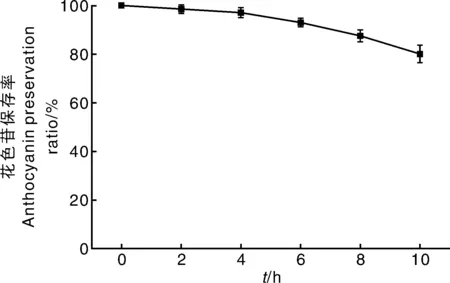
图3 花色苷保存率与光照时间的关系Fig.3 Relationship between anthocyanins preservation ratio and lighting time
添加不同有机酸条件下,杨梅露酒避光贮藏30 d后的色泽保存率随着有机酸浓度的升高而增大,以添加1.5 g·L-1对羟基苯甲酸时效果最显著,色泽保存率达到83.22%,比对照提高16.52百分点,如表1所示。因此,杨梅露酒中添加适量有机酸有助于改善其色泽稳定性。而对羟基苯甲酸除可降低露酒pH外,与露酒中醇生成的酯类还可用作食品的防腐剂和杀菌剂,可能也是其提高色泽稳定性的原因之一[23]。
表1有机酸对杨梅露酒色泽稳定性的影响
Table1Effect of organic acids on color stability of bayberry integrated alcoholic beverages

试剂Reagents用量Dose/(g·L-1)D510L*a*b*色泽保存率CPR/%空白Control00.464±0.001 a73.21±0.41 a20.14±0.28 a29.98±0.12 a66.70±0.86 a苹果酸 Malic acid0.50.469±0.012 a71.38±0.38 a20.98±0.07 a30.32±0.22 a70.31±0.48 a1.00.477±0.011 a71.12±0.27 a21.67±0.56 a30.98±0.23 a73.61±0.09 b1.50.492±0.021 b70.78±0.45 a22.14±0.44 b31.27±0.41 a76.30±0.39 b乙酸 Acetic acid0.50.472±0.013 a71.22±0.61 a22.32±0.88 a31.35±0.01 a71.44±1.02 a1.00.483±0.017 a70.89±0.86 a23.14±0.21 b32.48±0.02 a74.00±0.81 b1.50.503±0.020 b70.11±1.12 b24.47±0.36 b33.17±0.01 b75.80±0.32b对羟基苯甲酸0.50.468±0.024 a72.13±0.14 a20.31±0.11 a30.62±0.21 a72.94±0.45 aHydroxybenzoic acid1.00.476±0.011 a72.16±0.04 a21.37±0.29 a31.28±0.17 a75.31±0.66 a1.50.493±0.019 b71.39±0.77 a22.69±0.28 b31.97±0.18 a83.22±0.78 c
色泽保存率为存放30 d后的吸光值与保存前之比;同列不同行数据后没有相同小写字母表示差异显著(P<0.05)。下同。
Color preservation ratio (CPR) was the ratio of the UV absorption values of bayberry integrated alcoholic beverage stored for 30 days and 1 day. The values in the same column with different lower-case letters showed significant difference (P<0.05). The same as below.
2.3.2 氨基酸对杨梅露酒色泽稳定性的影响
添加不同浓度甘氨酸、L-酪氨酸和L-半胱氨酸条件下在510 nm处吸光值(D510)和色差变化规律如表2所示。当甘氨酸和L-酪氨酸添加量达到90 mg·L-1时,杨梅露酒D510显著增大(P<0.05),而添加L-半胱氨酸时的D510基本没有发生变化。此外,三种氨基酸对杨梅露酒a*和b*色差值的影响均不显著(P>0.05)。添加不同浓度甘氨酸、L-酪氨酸和L-半胱氨酸的杨梅露酒避光贮藏30 d后的色泽保存率如表2所示。甘氨酸和L-酪氨酸添加量与杨梅露酒色泽保存率呈正相关,最大可提高5.40百分点,而L-半胱氨酸对其色泽保存率基本没有影响。虽然已有相关研究表明氨基酸也是一种有效的辅色素[11],但这3种氨基酸对杨梅露酒的护色效果并不明显,可能是由于酒样中花色苷的浓度较低,也可能是氨基酸的辅色作用可能具有一定的样品选择性。
2.3.3 金属盐对杨梅露酒色泽稳定性的影响
由表3可知,添加水杨酸钠、乙二胺四乙酸二钠和无水氯化钙均可使杨梅露酒吸光值和色度增加,其中添加水杨酸钠后吸光值的提高最为明显,露酒D510、色差a*值和贮存期间的色泽保存率均有显著提高;氯化钙引起露酒色差a*值增大但差异不显著(P>0.05),且对贮存期间色泽的保存率没有显著改善作用;添加乙二胺四乙酸二钠对露酒D510和色差a*值的变化均不明显,但对其短期色泽保存率有显著提高,增加了12.82百分点。这可能是由于乙二胺四乙酸二钠是一种螯合剂,与花色苷结合后使其疏水性增大,提高其稳定性[5]。因此,较高浓度的水杨酸钠或乙二胺四乙酸二钠可提高杨梅露酒色泽稳定性。
表2氨基酸对杨梅露酒色泽稳定性的影响
Table2Effects of amino acids on color stability of bayberry integrated alcoholic beverages
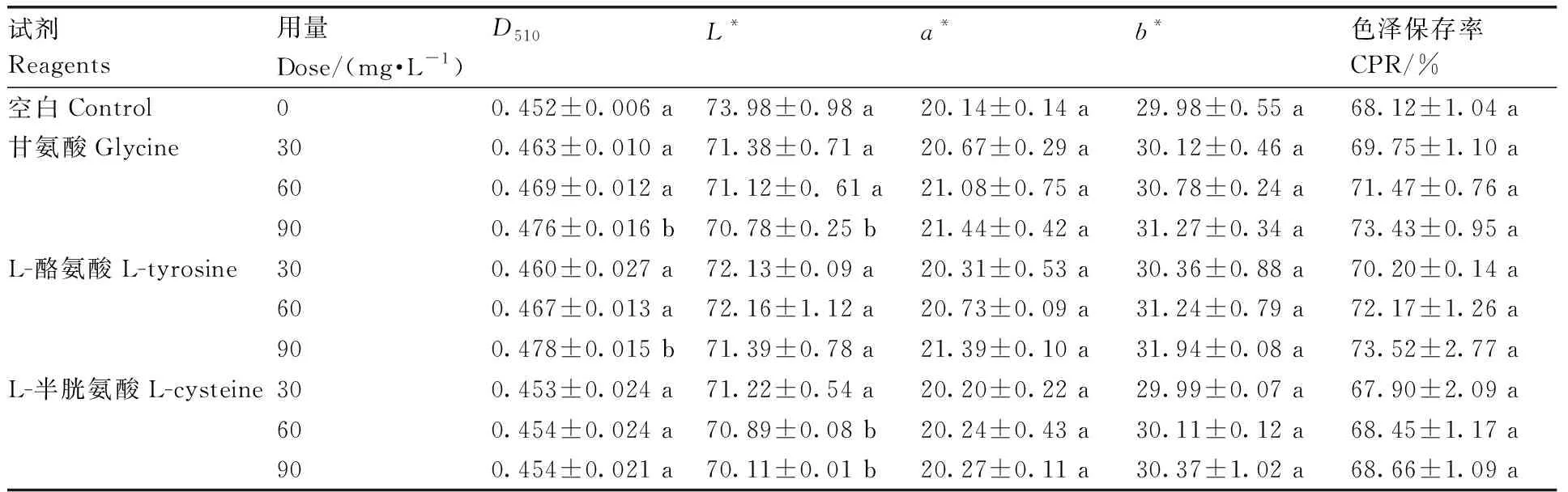
试剂Reagents用量Dose/(mg·L-1)D510L*a*b*色泽保存率CPR/%空白Control00.452±0.006 a73.98±0.98 a20.14±0.14 a29.98±0.55 a68.12±1.04 a甘氨酸Glycine 300.463±0.010 a71.38±0.71 a20.67±0.29 a30.12±0.46 a69.75±1.10 a600.469±0.012 a71.12±0. 61 a21.08±0.75 a30.78±0.24 a71.47±0.76 a900.476±0.016 b70.78±0.25 b21.44±0.42 a31.27±0.34 a73.43±0.95 aL-酪氨酸L-tyrosine300.460±0.027 a72.13±0.09 a20.31±0.53 a30.36±0.88 a70.20±0.14 a600.467±0.013 a72.16±1.12 a20.73±0.09 a31.24±0.79 a72.17±1.26 a900.478±0.015 b71.39±0.78 a21.39±0.10 a31.94±0.08 a73.52±2.77 aL-半胱氨酸L-cysteine300.453±0.024 a71.22±0.54 a20.20±0.22 a29.99±0.07 a67.90±2.09 a600.454±0.024 a70.89±0.08 b20.24±0.43 a30.11±0.12 a68.45±1.17 a900.454±0.021 a70.11±0.01 b20.27±0.11 a30.37±1.02 a68.66±1.09 a
表3金属盐对杨梅露酒色泽稳定性的影响
Table3Effect of metal salts on color stability of bayberry integrated alcoholic beverages
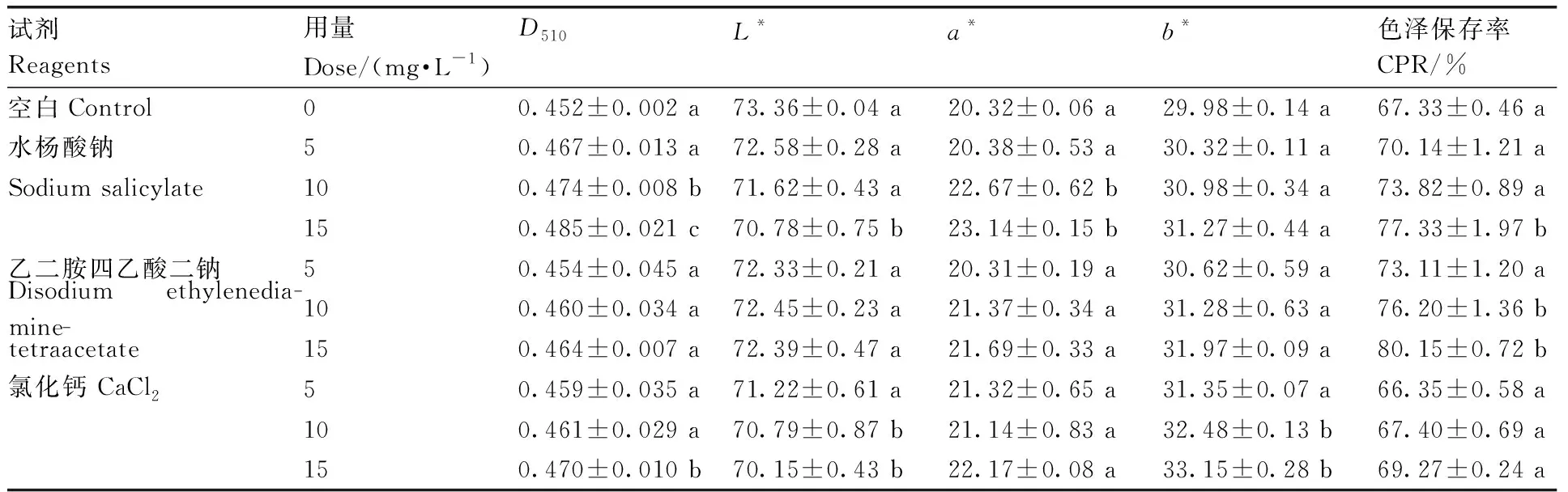
试剂Reagents用量Dose/(mg·L-1)D510L*a*b*色泽保存率CPR/%空白Control00.452±0.002 a73.36±0.04 a20.32±0.06 a29.98±0.14 a67.33±0.46 a水杨酸钠50.467±0.013 a72.58±0.28 a20.38±0.53 a30.32±0.11 a70.14±1.21 aSodium salicylate100.474±0.008 b71.62±0.43 a22.67±0.62 b30.98±0.34 a73.82±0.89 a150.485±0.021 c70.78±0.75 b23.14±0.15 b31.27±0.44 a77.33±1.97 b乙二胺四乙酸二钠50.454±0.045 a72.33±0.21 a20.31±0.19 a30.62±0.59 a73.11±1.20 aDisodium ethylenedia-mine-100.460±0.034 a72.45±0.23 a21.37±0.34 a31.28±0.63 a76.20±1.36 btetraacetate150.464±0.007 a72.39±0.47 a21.69±0.33 a31.97±0.09 a80.15±0.72 b氯化钙 CaCl250.459±0.035 a 71.22±0.61 a21.32±0.65 a31.35±0.07 a66.35±0.58 a100.461±0.029 a70.79±0.87 b21.14±0.83 a32.48±0.13 b67.40±0.69 a150.470±0.010 b70.15±0.43 b22.17±0.08 a33.15±0.28 b69.27±0.24 a
2.3.4 天然色素对杨梅露酒色泽稳定性的影响
添加不同浓度天然色素作为辅色素对杨梅露酒的护色作用如表4所示。从表中可看出,杨梅色素、紫甘薯色素和桑椹红色素均对杨梅露酒的色泽具有保护作用,D510和色差a*值均有不同程度上升,尤其是添加杨梅色素和桑椹红色素条件下,D510和色差a*值均比对照组显著升高(P<0.05)。但是,随着色素浓度的增加,亮度L*值减少,肉眼观察的结果为酒体色泽略暗,呈暗红色,其中桑椹红色素的增色效果最明显。添加辅色素一方面可使酒中花色苷浓度增大,使得D510和色差a*值增长明显,而且其色泽保存率也显著提高;另一方面辅色素可能与露酒中的花色苷之间发生了自聚作用,增加了花色苷的疏水作用,提高了花色苷的稳定性[24],且花色苷在乙醇溶液中的自聚合作用更为显著[25]。不同来源的花色苷结构不同,花色苷分子间的交联作用会增强花色苷的稳定性并提高其色度,且辅色素的色素与花色苷的摩尔比越大,其分子间共色作用越明显[26]。因此,添加杨梅色素和桑椹红色素能够明显改善露酒色泽、提高色泽保存率,其中以添加60 mg·L-1桑椹红色素的效果最为明显。
表4天然色素对杨梅露酒色泽稳定性的影响
Table4Effect of natural pigment on color stability of bayberry integrated alcoholic beverages

试剂Reagents用量Dose/(mg·L-1)D510L*a*b*色泽保存率CPR/%空白Control00.459±0.001 a73.28±0.02 a20.07±0 a29.74±0.06 a64.5±1.12 a杨梅色素200.503±0.008 a69.23±0.14 a34.66±0.023 b23.32±0.24 a74.2±1.42 bBayberry pigment400.567±0.012 b67.12±0.23 a46.41±0.31 c44.68±0.09 b78.6±0.85 b600.623±0.008 c 62.78±0.25 b53.24±0.24 d41.19±0.14 b84.3±0.16 c紫甘薯色素200.491±0.018 a 70.23±0.18 a20.56±0.16 a16.62±0.16 d69.8±0.23 aPurple sweet400.520±0.024 a68.36±0.34 a21.33±0.09 a22.26±0.25 a77.4±0.42 bpotato pigment600.538±0.031 a65.39±0.25 a22.79±0.12 a24.47±0.21 a87.3±0.11 d桑椹红色素200.579±0.014 a70.24±0.28 a47.26±0.21 c25.36±0.32 a79.8±0.10 bMulberry red pigment400.686±0.033 b64.81±0.31 b55.41±0.54 d43.38±0.16 b87.9±0.15 d600.723± 0.015 c53.13±0.17 c61.53±0.39 e48.27±0.27 e91.5±0.34 e
3 结论
本研究对杨梅露酒中花色苷在不同温度和光照时间条件下的稳定性进行了研究,发现高温对杨梅露酒中花色苷的破坏性强于光照,花色苷热降解满足一级动力学方程。通过比较添加不同浓度有机酸、金属盐、氨基酸和辅色素条件下杨梅露酒色差变化及贮存期间色泽保存率,确定了杨梅露酒加工过程中的最适护色工艺。添加1.5 g·L-1对羟基苯甲酸的色泽保存率达到83.22%,比对照提高了16.52百分点;添加较高浓度的水杨酸钠和乙二胺四乙酸二钠可使露酒色泽保存率提高10.00~12.82百分点;添加60 mg·L-1的桑椹红色素对杨梅露酒的辅色作用最为显著,贮藏3个月后,杨梅露酒的色泽保存率为91.5%,比对照提高27.0百分点。

