脂联素基因rs266729(-11377C/G)位点多态性与血压对钠、钾反应性的相关性研究
吴冠吉,牟建军,刘富强,蒋 伟,张 敏
(1. 西安交通大学附属西安市中心医院心血管内科,陕西西安 710003;2. 西安交通大学第一附属医院心血管内科,陕西西安 710061)
脂联素(adiponectin, APN)是白色脂肪组织分泌的一种激素蛋白,是目前发现的唯一与体脂含量呈负相关的脂肪细胞因子。研究表明,APN具有抗炎、抗动脉粥样硬化、增加胰岛素敏感性等广泛的生物学活性[1-3]。新近的临床研究提示,低APN水平是高血压发生的重要危险因素,且这种作用独立于胰岛素抵抗和糖尿病之外[4]。血浆APN水平在原发性高血压组明显低于血压正常对照组,并且与收缩压、舒张压呈显著负相关[5-6]。APN基因多态性45T/G、276G/T、I164/T与高血压的相关性研究在国内外已有报道。日本学者研究发现,日本人群中APN I164/T突变的个体中携带TC基因型的个体表现出较低的血浆APN浓度,并且大多数C等位基因携带者患有高血压[7]。对中国香港人群研究发现,APN单核苷酸多态性(single nucleotide polymorphism, SNP)rs266729(-11377C/G)与原发性高血压具有明显相关性[8]。然而到目前为止,有关APN基因多态性与血压盐敏感性关系的研究尚未见报道。本文通过慢性盐负荷及补钾干预试验,观察高盐摄入以及补钾对血压正常个体的血压、血浆APN水平的影响,并进一步研究APN基因rs266729(-11377C/G)位点多态性与血压对钠、钾反应性的关系,探讨APN及在盐敏感性高血压形成中的作用。
1 对象与方法
1.1研究对象陕西眉县农村汉族人群中,选择年龄18~60岁,收缩压130~160 mmHg、舒张压85~100 mmHg,性别不限并且未服用降压药物治疗的自愿者作为先证者,先证者及其同胞、配偶及子女参与慢性盐负荷饮食干预试验,所有参与者均签署知情同意书。共入选342例,年龄(40.3±9.1)岁,其中男性182例,女性160例。排除标准:①严重心血管疾病和肝脏、肾脏、糖尿病等急慢性疾病;②炎症感染性疾病;③影响血压或电解质代谢的内分泌疾病;④孕妇,经常饮酒、吸烟者;⑤不愿在知情同意书上签字以及不能够坚持完成试验者。
1.2方法
1.2.1 基线资料调查和饮食干预 连续3 d基线资料调查,包括病史询问,测量体质量、身高、腰围、臀围、血压,采集1次空腹静脉血样,收集1次24 h尿、2次夜尿后进行为期3周的慢性盐负荷及补钾饮食干预。采取统一管理、集体配餐的方式,分3个阶段进行:①低盐阶段(盐3 g/d),相当于(钠51.3 mmol/d)干预1周;②高盐阶段(盐18 g/d),相当于(钠307.8 mmol/d)干预1周;③高盐补钾阶段(钾60 mmol/d和钠307.8 mmol/d),干预1周。为确保摄盐量精确,现场配备专业厨师,加工的食物本身不含盐和任何含盐制品,就餐时由营养监督员负责将定量的盐包撒入食物中,并监督受试对象将食物吃完。
1.2.2 血压测量 在基线调查和每个干预阶段的第2、5、6、7天测量血压,受试者静坐休息5 min后采用英国产随机零点血压计测量。按照Korotkoff 听音法量3次血压,每次测量间隔30 s,求其平均值。参与血压测量的工作人员均经过统一培训并通过合格认证考试。参考国外慢性盐负荷试验中盐敏感性(salt sensitivity, SS)判断标准[9]:于高盐(high-sodium, HS)饮食末平均动脉压(MAP)较低盐(low-sodium, LS)饮食期MAP升高幅度≥10%者为盐敏感者(SS),<10%则为盐不敏感者(NSS)。MAP=舒张压+1/3(收缩压-舒张压)。
1.2.3 血、尿标本的收集 每个干预阶段的第5、6、7天,收集3次尿标本(1次24 h尿,2次夜尿),各干预阶段的第6天留取血标本。血标本采集:清晨空腹静脉采血,每次采血量为2管(4 mL非抗凝和4 mL EDTA抗凝),2 600 r/min离心15 min,分离血清、血浆标本于-80 ℃冷冻保存待测。尿标本收集:分发给参加者24 h或夜尿收集说明和收集容器,使用量筒测量体积,吸取5 mL的尿标本分别转移至每个尿贮存管置于-80 ℃冰箱保存待测。如24 h尿总量小于500 mL,或者收集时间小于22 h,或者总尿肌酐小于7 mg/kg被认为24 h尿收集不全,弃用,重新留取。
1.2.4 APN基因分型 采用ReadyAmpTM基因组DNA纯化系统(北京普洛麦格生物技术有限公司)纯化外周血DNA。运用连接酶特异检测技术(LDR-PCR)对APNrs266729位点进行基因分型:PCR引物、探针由上海捷瑞生物工程有限公司合成,Taq酶、DNTP为Fermentas(MBI)公司产品,TaqDNA ligase由NEB(www.neb-china.com/)公司提供,PCR仪为ABI 9700(上海奥然科贸有限公司)。
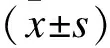
2 结 果
2.1受试者的一般特征和饮食干预后的血压变化共纳入受试者342例(表1)。其中检出SS 130例(男性66例,女性64例),NSS 212例(男性116例,女性96例),盐敏感检出率为38%。先证者基线期收缩压、舒张压、平均动脉压水平高于同胞、配偶及子女,父母基线期收缩压水平最高;饮食干预后血压在低盐期下降,高盐期升高,高盐补钾期再次下降(表2)。
表1受试者的一般特征
Tab.1 General characteristics of the participants

组别例数年龄(岁)男性(%)BMI(kg/m2)先证者10240.5±7.669.623.0±2.8同胞17239.4±7.350.022.3±2.9配偶1947.4±6.122.222.5±3.2子女4923.3±7.146.819.9±2.5父母18666.1±8.247.820.4±2.6
BMI:体质量指数。
表2饮食干预后的血压变化
Tab.2 BP responses to dietary intervention


组别血压基线期低盐期高盐期高盐补钾期先证者SBP140.6±11.0131.5±10.0∗138.4±10.4#131.8±8.6△DBP90.8±7.984.9±9.3∗88.3±8.1#85.1±7.7△MAP107.4±8.2100.4±9.0∗104.9±8.5#100.6±7.4△同胞SBP127.4±10.5123.6±9.1∗128.5±11.1#123.2±8.9△DBP70.0±8.266.4±7.7∗68.6±9.366.1±7.9MAP89.1±8.585.4±7.6∗88.5±9.5#85.0±7.8△配偶SBP128.6±12.2122.5±7.7∗ 128.4±10.9#122.8±9.4△DBP70.6±6.967.1±5.8∗68.6±7.565.9±7.1MAP89.9±7.985.6±5.4∗88.5±7.584.8±7.1△子女SBP102.4±10.799.9±9.4 101.7±10.0100.4±9.6DBP62.9±8.760.2±8.360.4±8.359.5±8.0MAP76.1±9.073.5±8.374.3±8.473.2±8.1父母SBP143.6±21.6---DBP90.7±10.8---MAP108.3±13.4---
SBP:收缩压;DBP:舒张压;MAP:平均动脉压。与基线期比较,*P<0.05;与低盐期比较,#P<0.05;与高盐期比较,△P<0.05。
2.2受试者各阶段24h尿钠、钾变化与基线期比较,尿钠排泄量在低盐期明显下降,在高盐期明显升高;此外,补钾不仅能够增加钾的排泄量,而且能轻微促进钠的排泄(表3)。
2.3Hardy-Weinberg平衡吻合度检验rs266729(-11377C/G)位点的CC、CG和GG基因型频率分别为50%、43.58%和6.42%,C和G等位基因的频率分别为71.8%和28.2%。通过Hardy-Weinberg检验,χ2=3.67,P>0.05,说明该基因型频率分布符合Hardy-Weinberg平衡,提示该样本来自一遗传平衡的总体。
2.4脂联素rs266729基因多态性与血压钠、钾反应性的相关性经单个位点家系关联性分析(single-marker FBAT analysis)结果显示:rs266729(-11377C/G)C等位基因单位点多态性与盐敏感性的遗传易感性的关联有统计学意义(Z=2.320,P=0.020);C等位基因单位点多态性与血压钾反应性的遗传易感性的关联亦有统计学意义(Z=2.325,P=0.020,表4)。
表3受试者干预各期24h尿钠、钾排泄量的变化
Tab.3 Effects of the dietary intervention on 24 h urinary sodium and potassium excretions


组别24h尿钠/钾排泄量(mmol)基线期 低盐期 高盐期 高盐补钾期 先证者钠228.0±11.654.9±6.8∗317.0±21.8∗#329.0±24.2∗#钾36.8±6.831.4±8.933.4±7.896.8±9.6∗#△同胞钠213.0±16.453.6±5.4∗324.0±28.6∗#331.0±25.9∗#钾41.1±9.139.8±7.636.6±9.189.3±11.5∗#△配偶钠218.0±20.852.8±6.7∗328.0±20.5∗#324.0±28.4∗#钾39.4±12.334.2±6.732.2±8.294.6±8.6∗#△子女钠115.0±23.458.2±7.4∗319.0±25.1∗#327.0±21.8∗#钾45.6±18.740.5±9.739.8±9.298.7±10.7∗#△
与基线期比较,*P<0.01;与低盐期比较,#P<0.01;与高盐期比较,△P<0.01。
表4脂联素rs266729基因多态性与血压及其盐敏感性的关联性分析
Tab.4 Association between SNP rs266729 polymorphism and salt sensitivity

变量等位基因等位基因频率fam#S-E(S)Var(S)ZP值SBPC0.71855-85.1876084.091-1.0920.274G0.2825585.1876084.0911.0920.274DBPC0.71811-36.040675.236-1.3870.165G0.2824931.4332576.9840.6190.535MAPC0.71855-73.3773767.366-1.1950.231G0.2825573.3773767.3661.1950.231SS-10C0.71830 12.41828.642 2.3200.020G0.28230-12.41828.642-2.3200.020SK-10C0.71819 11.62624.996 2.3250.020G0.28219-11.62624.996-2.3250.020
SBP:收缩压;DBP舒张压;MAP平均动脉压;SS-10:血压钠反应性,盐敏感组MAP(HS)-MAP(LS)≥10%;SK-10:血压钾反应性,盐敏感组补钾MAP下降≥10%;fam#:等位基因关联性分析中参与分析的能够提供信息的家系数目,当参与分析的有效家系数不足10家,将不计算统计量;S:在无效假设成立情况下检验统计量;E(S)和Var(S):检验统计量的预测值和方差;Z:对E(S)和Var(S)标准化正态转换后所获得的S值,只有当Z值为正且P<0.05时才表示该基因型与变量间有遗传学关联。
3 讨 论
1995年,SCHERER等[10]首次从幼鼠脂肪细胞中克隆出APN cDNA,并将APN称Acrp30,后又称AdipoQ,GBP28,apM1。APN基因的mRNA,是脂肪组织中含量最丰富的基因转录产物,具有脂肪组织特异性,故又称为APN基因(apM1)。全基因扫描显示apM1位于3q27区域,全长17 kb,包含3个外显子和2个内含子。文献报道apM1的3q27区域是2型糖尿病和代谢综合征的易感位点[11]。
越来越多的学者认为,APN基因多态性在高血压的发病机制中也可能起到重要的作用。目前关于APN基因多态性与高血压的相关性研究主要集中在45T/G、276G/T、I164/T等多态性上。IWASHIMA等[7]对先前已经在日本人群中报道的与APN浓度有关的两个基因多态性研究发现,I164/T突变的个体中携带TC基因型的个体表现出较低的血浆APN浓度,并且大多数C等位基因携带者患有高血压。此外,TC基因型与高血压之间具有强的相关性。相比之下,G276T基因突变未发现与APN浓度或高血压之间有明显的相关性。WU等[12]对12项研究进行Meta分析结果表明,尽管APN 45T/G、276G/T多态性与高血压无明显相关性,但276G/T杂合突变增加循环中APN水平并且升高血压,尤其在高血压患者中。贾玫等[13]应用变性高效液相色谱分析法研究显示,APN基因启动子区rs266729(-11377C/G)位点多态性与原发性高血压具有相关性,并且G等位基因与收缩压、体质量指数、腰臀比呈正相关,提示基因rs266729(-11377C/G)位点多态性可能增加原发性高血压的遗传风险。ONG等[8]研究发现在中国香港人群中,rs266729(-11377C/G)位点多态性与原发性高血压具有明显相关性,且这种相关性不受性别影响。
新近的人群及动物研究表明,盐摄入可调节APN水平。LELY等[14]对35例健康男性进行为期7 d的低盐饮食干预,发现血浆APN水平明显下降。KAMARI等[5]在SD大鼠中发现,高盐摄入增加血浆APN水平,并独立于血压之外。认为盐负荷可能诱导体内炎症状态,从而升高APN水平。本课题组之前对盐敏感者的干预试验发现,血压正常的盐敏感者在摄入高盐后,可导致血压升高,但血浆APN的浓度无明显变化,而盐不敏感组血浆APN的浓度明显升高。提示两组受试者血浆APN浓度对高盐刺激后的反应存在差异,说明APN产生可能是对盐负荷的一种保护性反应。与盐不敏感者相比,即使血压正常的盐敏感者在高盐饮食下,也存在与盐负荷相关的血浆APN水平下降,且这种变化参与了高血压的发生发展[15-16]。本研究发现,APN基因启动子区rs266729(-11377C/G)位点多态性与血压的钠、钾反应性均具有明显相关性。提示APN基因启动子区rs266729(-11377C/G)位点多态性也可能是血压盐敏感性的一个易感基因。这可能是血压正常的盐敏感者高盐负荷下APN增高反应不足,盐敏感性高血压患者血浆APN水平明显降低的重要原因。
不同种族、不同地域的人群携带基因可能存在数量和性状的差异,ZHAO等[17]对35项研究进行的荟萃分析结果显示,APN基因启动子区rs266729(-11377C/G)多态性与血压无明显相关性,上述结果的不一致可能归因于民族习惯、环境因素和研究方法的差异。本研究中APN基因多态性的研究对象为陕西关中地区汉族人群,为小样本研究,缺乏一定的代表性。关于APN基因变异与血压盐敏感性之间的关系还有待于更大样本量及分子遗传学方面的研究。

