1-磷酸鞘氨醇对2型糖尿病小鼠胰岛β细胞损伤的保护作用
隋 婧,和一之,邓 梅,赵心蕊,施秉银
(1. 西安交通大学第一附属医院内分泌科涉外病房,陕西西安 710061;2. 西安市第三医院内分泌科,陕西西安 710018;3. 山东省单县中心医院内分泌科,山东单县 274300;4. 西安交通大学第二附属医院风湿免疫科,陕西西安 710004;5. 西安交通大学第一附属医院内分泌科,陕西西安 710061)
2型糖尿病(type 2 diabetes mellitus, T2DM)是一种多病因的内分泌代谢性疾病,表现为慢性高血糖,伴随因胰岛素分泌或(和)作用缺陷引起的葡萄糖、脂肪和蛋白质代谢紊乱。近年来,随着经济的快速发展,人们的生活方式逐渐改变,人口老龄化日益严重,T2DM的发病率迅速增加,发病年龄更趋年轻化,严重危害公共健康。中国最新糖尿病流行病学调查结果显示,在年龄≥20岁的中国人群中,糖尿病和糖尿病前期患病率分别高达10.9%和35.7%[1]。T2DM是一种缓慢进展性疾病,其发病的中心环节是胰岛素抵抗和胰岛β细胞分泌功能缺陷。胰岛素抵抗发生在T2DM前期,于糖耐量减低或糖尿病发生时达高峰并贯穿在T2DM的全过程,而β细胞分泌功能缺陷导致对胰岛素抵抗的失代偿则是T2DM发病的必要条件。因此,深入探讨改善T2DMβ细胞功能的机制,探讨更有效的治疗措施已成为当今内分泌学界十分重要的研究课题。
1-磷酸鞘氨醇(sphingosine-1 phosphate, S1P)是细胞膜鞘磷脂的代谢产物之一,近年的研究发现,S1P在心血管疾病、肿瘤、T2DM胰岛β细胞的存活和功能调节方面发挥着重要作用[2-3]。S1P既可以作为细胞信号转导的第二信使直接发挥促存活作用,还可与不同的S1P受体(S1PR)结合并通过与G蛋白偶联而发挥作用,介导细胞迁移、增殖和存活[4-5]。S1PR是内皮分化基因家族(EDG家族)中的成员之一,均为G蛋白偶联受体[6]。目前,已经发现了5种S1PR受体亚型,包括S1PR1(EDG1)、S1PR2(EDG5)、S1PR3(EDG3)、S1PR4(EDG6)和S1PR5(EDG8)[7]。S1PR1-3广泛表达于各种组织和细胞[8-10],相比而言,S1PR4和S1PR5表达较局限,S1PR4仅表达于淋巴组织和肺,S1PR5仅表达于神经组织[10-11]。目前,S1P及S1PR在体外动物模型中调控胰岛β细胞功能的作用机制仍不清楚,也尚无相关文献报道S1PR在小鼠胰腺及胰岛组织中表达及定位情况。因此,本研究观察S1P对高脂饮食联合小剂量链脲佐菌素(STZ)诱导的T2DM小鼠胰岛β细胞的增殖及凋亡情况和对血糖及胰岛素分泌的影响,并通过对胰腺组织进行S1PR1-3蛋白的免疫组化染色,观察其在T2DM小鼠胰腺中的表达定位情况及与正常小鼠的表达差异,进一步研究S1P对糖尿病胰岛β细胞损伤的保护作用。
1 材料与方法
1.1材料SPF级4周龄雄性C57BL/6J小鼠40只,体质量16~20 g,购自西安交通大学医学部实验动物中心,许可证号:SCXK(陕)2012-003。STZ、S1P(美国Sigma公司,S0130),小鼠抗Ki67单克隆抗体(美国BD Biosciences公司,BD550609),兔抗Insulin多克隆抗体、兔抗S1P3多克隆抗体、(美国Santa Cruz公司,sc-9168、sc-30024),兔抗S1P1多克隆抗体(美国Abcam公司,ab11424),兔抗S1P2多克隆抗体(美国Bio World公司,BS2594),SP免疫组化试剂盒、浓缩型DAB试剂盒(北京中杉金桥生物技术有限公司,SP-9000、ZLI-9017),TUNEL试剂盒(罗氏公司,11684817910),碘[125I]胰岛素放射免疫分析药盒(北京北方生物技术研究所),血糖仪及配套试纸(罗氏公司,Accu-Chek Performa)。
1.2T2DM小鼠模型的建立SPF级雄性C57BL/6J小鼠(n=30)先喂食高脂饲料(上海普路腾生物科技有限公司,配方:繁殖鼠料54.6%,猪油16.9%,蔗糖14%,酪蛋白10.2%,预混料2.1%,麦芽糊精2.2%),于第4周末,禁食(不禁水)14 h,取STZ溶于0.1 mol/L的pH 4.2~4.5的柠檬酸缓冲液中,按照120 mg/kg剂量行腹腔注射。STZ配制的全部操作过程需在冰浴上进行,30 min内完成整个STZ注射过程。同时设空白对照组(普通饲料喂养),注射同体积的柠檬酸缓冲液。注射后造模组和对照组分别继续喂食相应饲料3周。在第7周末时,小鼠禁食(不禁水)14 h后,用灭菌的小剪刀剪尾取血,使用血糖仪测定血糖,血糖≥11.1 mmol/L被认为T2DM模型复制成功。饲养过程中保证充足的水和食物,并每天更换鼠笼和垫料1次。
1.3分组及S1P药物干预方案T2DM造模组(n=26,1.2中造模时30只小鼠中2只死亡,2只未成模)按血糖高低随机分为3组:S1P高剂量组(S1PH组,n=9);S1P低剂量组(S1PL组,n=9);糖尿病模型对照组(DC组,n=8)。另外,正常对照组小鼠(NC组,见1.2中处理,n=10)。将S1P 1 mg溶于1 mL甲醇中制成S1P储存液,分装后―20 ℃避光保存,用PBS稀释成工作浓度。各组每日腹腔注射进行干预治疗:S1PH组(100 μg/kg)及S1PL组(20 μg/kg);DC组及NC组给予相应体积的甲醇+PBS,共3周。各组小鼠均自由饮水、饮食(S1PH组、S1PL组、DC组继续饲喂高脂饲料,NC组饲喂普通饲料),每周监测摄食量、饮水量、体质量及血糖。
1.4葡萄糖耐量试验(IPGTT) 给药3周后,各组小鼠禁食(不禁水)8 h后称重,小鼠尾静脉取血作为0 min的血糖值(BG0),后每只小鼠给予200 g/L葡萄糖注射液按2 g/kg体质量剂量腹腔注射,并于给予葡萄糖后30、60、120 min尾静脉取血,用血糖仪测相应时点的血糖值[30 min(BG30)、60 min(BG60)、120 min(BG120)],并用公式计算IPGTT曲线下面积(areas under curve, AUC):AUC=1/4(BG0)+1/2(BG30)+3/4(BG60)+1/2(BG120)。
1.5空腹血清胰岛素(FINS)的测定将连续给药3周的各组小鼠禁食(不禁水)过夜,摘眼球取血,3 000 r/min离心10 min后,分离血清保存。按照北京北方生物技术研究所的碘[125I]胰岛素放射免疫分析药盒说明书进行操作。计算胰岛素抵抗指数(HOMA-IR)[12]:HOMA-IR=(FBG×FINS)/22.5。
1.6HE染色和免疫组化染色处死小鼠后取胰腺,100 mL/L甲醛溶液固定24 h,常规制作5 μm厚石蜡切片,HE染色并观察形态学改变。
免疫组化染色采用SP法,分别用胰岛素抗体(1∶1 400)、Ki67抗体(1∶200)、S1PR1抗体(1∶400)、S1PR2抗体(1∶150)、S1PR3抗体(1∶40)进行免疫组化染色。操作按试剂盒说明书进行。胰岛素、S1PR1、S1PR2、S1PR3免疫组化结果以Image pro Plus 6.0图像分析软件进行半定量分析,计算机自动测定并计算每个胰岛内阳性染色累积吸光度(IA)值和相应胰岛的面积(area),蛋白相对量以平均吸光度(IA/area)表示。Ki67染色后,增殖细胞核染为深棕色,每个胰岛中的细胞增殖率(%)=细胞增殖数/细胞总数×100%。每张切片应计数3~5个胰岛,取平均值。
1.7TUNEL染色胰腺组织细胞凋亡染色用罗氏公司的TUNEL试剂盒进行操作,染色后,凋亡的细胞核染为深棕色。每个胰岛中的细胞凋亡率(%)=细胞凋亡数/细胞总数×100%。每张切片应计数3~5个胰岛,取平均值。
2 结 果
2.1S1P对小鼠空腹血糖的影响分别在造模成功后(0周)及S1P给药1周、2周、3周检测小鼠的空腹血糖。模型组小鼠的空腹血糖明显高于正常对照组(P<0.01);给药3周后,S1P给药两组血糖值均较模型对照组下降,但差异无统计学意义(P>0.05,表1)。
表1各组小鼠空腹血糖的变化
Tab.1 Changes of fasting blood glucose in mice in each group

mmol/L)
与NC组比较,**P<0.01。
2.2S1P对小鼠IPGTT的影响在给药3周后,IPGTT实验观察S1P对T2DM小鼠糖代谢及胰岛β细胞功能调节的影响,结果显示,正常对照组在腹腔注射葡萄糖溶液120 min后体内血糖基本恢复到了注射葡萄糖前的正常水平;模型对照组在腹腔注射葡萄糖后60 min内血糖水平持续上升,此后小鼠血糖一直处于较高水平;S1P给药的两组小鼠在腹腔注射葡萄糖60 min血糖值达到最高,此后血糖值较模型对照组有下降趋势,但是下降不显著(P>0.05,图1)。各组小鼠AUC结果显示,DC组AUC较NC组AUC明显增高(P<0.01),S1P给药两组AUC较模型对照组稍有下降,但是下降不显著(P>0.05,表2)。

图1S1P对小鼠IPGTT的影响
Fig.1 Effect of S1P on IPGTT in mice
2.3S1P对小鼠空腹血清胰岛素(FINS)及HOMA-IR的影响各组之间FINS差异无统计学意义(P>
0.05),符合T2DM小鼠与同龄正常小鼠相比胰岛素水平不降低的特点。与空白对照组相比,T2DM模型各组小鼠的HOMA-IR指数水平均增高(P<0.01),说明小鼠出现胰岛素抵抗。其中S1P给药两组的HOMA-IR指数较模型对照组稍有下降,但是下降不显著(P>0.05,表2)。
表2各组小鼠的FINS、AUC及HOMA-IR比较
Tab.2 Comparision of FINS, AUC and HOMA-IR in each group

组别nFINS (mIU/L)HOMA-IRAUCNC组107.51±2.602.68±0.9823.25±1.68DC组88.37±2.316.56±2.80∗∗53.56±5.76∗∗S1PL组98.39±1.935.82±1.44∗∗51.70±6.45∗∗S1PH组97.53±2.495.14±1.71∗∗50.82±6.99∗∗
与NC组比较,**P<0.01。
2.4胰岛组织形态学观察及胰岛素免疫组化正常对照组小鼠胰岛呈圆形或椭圆形细胞团,胰岛细胞大小均一,排列整齐,细胞界限清楚,胞核居中清晰可见。模型对照组小鼠胰岛细胞形态不规则,大小不一,体积增大,排列松散,细胞核呈偏心分布。胰岛素阳性染色细胞数量减少,且染色比正常对照组浅,提示造模后,胰岛β细胞出现明显的损伤。与模型对照组相比,S1P给药两组的胰岛病变减轻,胰岛结构较清晰,形态较规整,排列较整齐。胰岛素阳性染色颗粒增加,棕黄色染色较深(图2)。
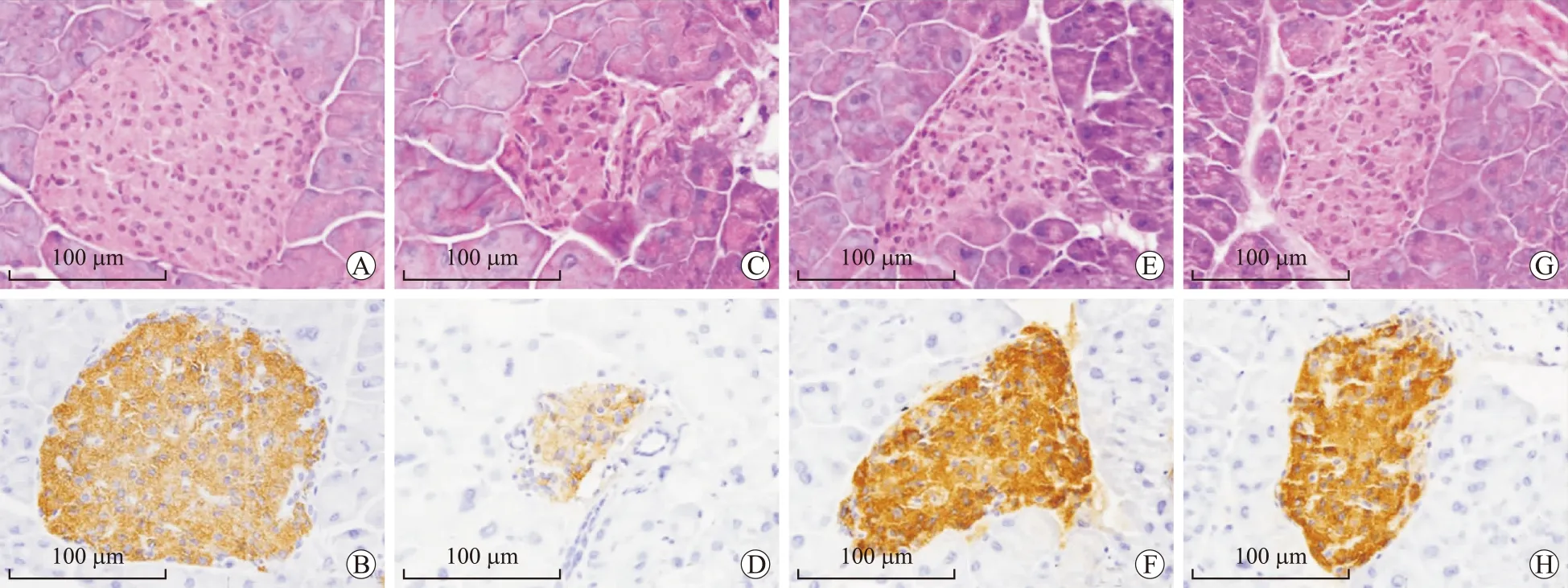
图2胰岛HE染色及胰岛素免疫组化染色
Fig.2 HE staining of islet and immunohistochemical staining of insulin in mouse islets
A、C、E、G:HE染色(×400);B、D、F、H:胰岛素免疫组化染色(×400);A、B:NC组;C、D:DC组;E、F:S1PL组;G、H:S1PH组。标尺:100 μm。
2.5小鼠胰岛β细胞增殖活性测定Ki67免疫组化阳性信号表现为细胞核呈棕黄色,细胞膜及细胞质不着色。各组小鼠胰岛中Ki67的表达率均较低,相比较而言,正常对照组胰岛内Ki67染色阳性细胞稍多,而模型对照组几乎无阳性细胞,S1P给药两组小鼠胰岛中可见少量Ki67染色阳性细胞,较模型对照组显著升高(P<0.05,图3、表3),提示S1P有促进胰岛β细胞增殖的作用。

图3各组小鼠胰岛Ki67免疫组化染色
Fig.3 Immunohistochemical staining of Ki67 in mouse islet cells in each group (×400)
A:NC组;B:DC组;C:S1PL组;D:S1PH组。箭头:阳性染色。标尺:100 μm。
2.6小鼠胰岛β细胞凋亡情况TUNEL检测可见发生凋亡的胰岛细胞核呈棕黄色,未发生凋亡的胰岛细胞核呈蓝色。模型对照组小鼠胰岛中可见大量棕色TUNEL染色阳性的凋亡细胞,与正常对照组相比差异有统计学意义(P<0.01)。S1P给药两组小鼠胰岛中凋亡细胞较模型对照组减少,差异有统计学意义(P<0.05),提示S1P具有抑制胰岛β细胞凋亡的作用(图4、表3)。
2.7S1PR1、S1PR2、S1PR3蛋白在T2DM小鼠胰腺中的表达情况S1PR1、S1PR2、S1PR3蛋白阳性信号均位于胰岛细胞的胞质和胞膜,与连续切片的胰岛素染色阳性细胞定位一致,说明S1PR1、S1PR2、S1PR3蛋白表达于胰岛β细胞,在胰腺外分泌部几乎不表达。其中S1PR1及S1PR2蛋白在T2DM小鼠的胰岛中的表达较正常对照组明显升高(P<0.01及P<0.05),S1PR3蛋白在糖尿病小鼠及正常对照组小鼠中表达无差异(P>0.05,图5~图7)。
表3各组小鼠胰岛细胞增殖率及凋亡率变化
Tab.3 Proliferation rate and apoptosis rate of islet cells in all groups

(%)
与NC组相比,**P<0.01;与DC组相比,#P<0.05。

图4各组小鼠胰岛TUNEL染色
Fig.4 TUNEL assay of apoptotic cells in the mouse islets in all groups (×400)
A:NC组;B:DC组;C:S1PL组;D:S1PH组。箭头:阳性染色。标尺:100 μm。
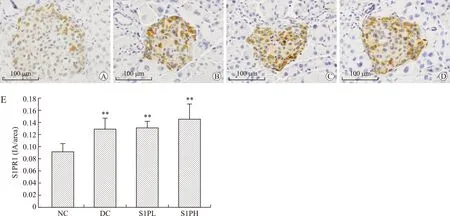
图5各组小鼠胰腺中S1PR1免疫组化染色情况
Fig.5 Immunohistochemical staining of S1P receptor S1PR1 (×400)
A:NC组;B:DC组;C:S1PL组;D:S1PH组;E:各组S1PR1平均IA比较,**P<0.01。标尺:100 μm。
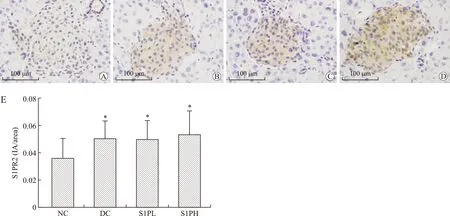
图6 各组小鼠胰腺中S1PR2免疫组化染色情况
Fig.6 Immunohistochemical staining of S1PR2 in mouse pancreas in all groups (×400)
A:NC组;B:DC组;C:S1PL组;D:S1PH组;E:各组S1PR2平均IA的比较。∗P<0.05。标尺:100μm。
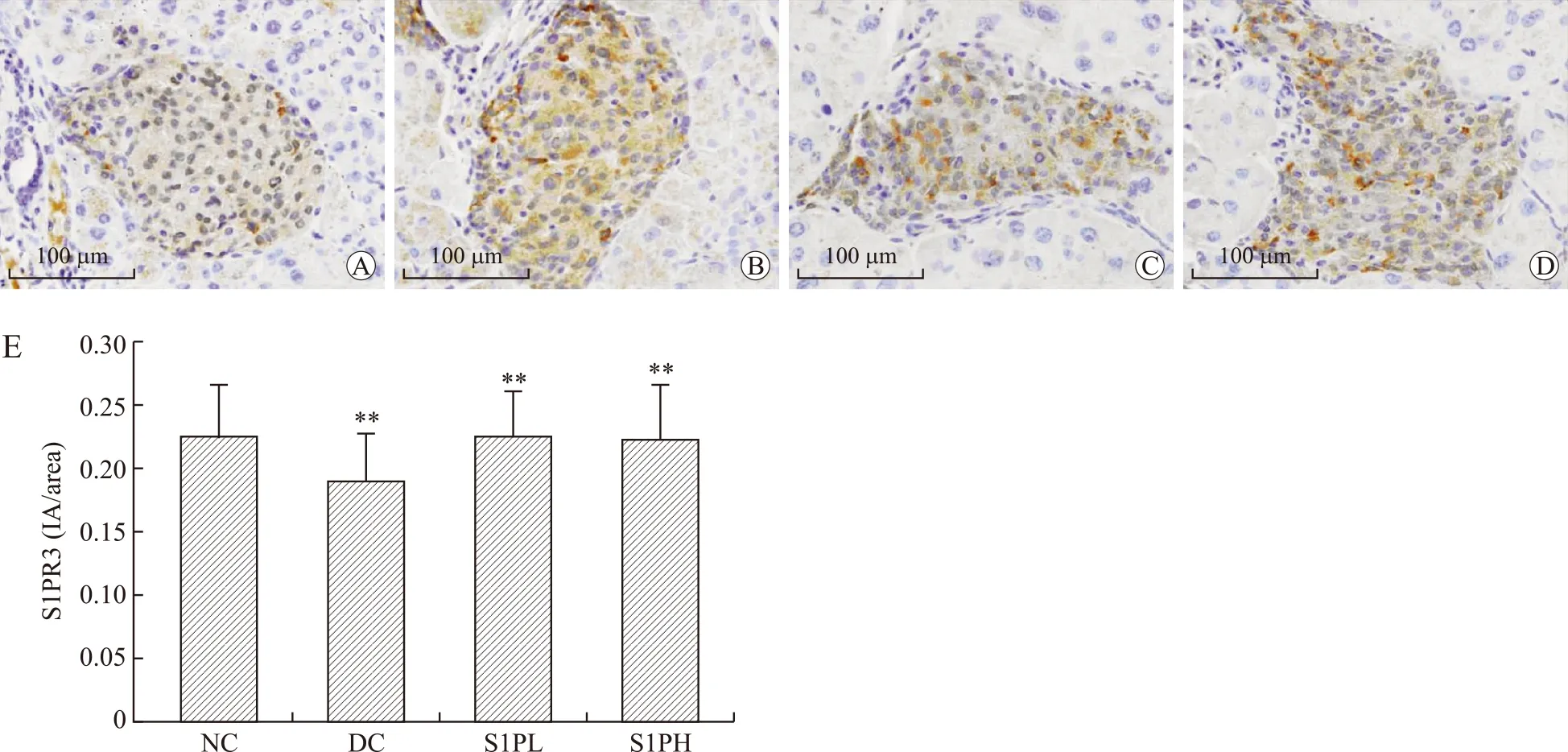
图7 各组小鼠胰腺中S1PR3免疫组化染色情况
Fig.7 Immunohistochemical staining of S1PR3 in mice of all groups (×400)
A:NC组;B:DC组;C:S1PL组;D:S1PH组;E:各组S1PR3平均IA的比较。∗∗P<0.01。标尺:100μm。
3 讨 论
“鞘脂变阻器”通路是近年来许多研究者重视的一条有关细胞存活、增殖和凋亡的信号途径。神经鞘脂类是细胞膜的结构成分之一,细胞内鞘脂代谢平衡是细胞稳态的重要方面,在调控细胞增殖、存活、迁移、凋亡及新生血管形成等方面发挥着重要的作用[3,6,13]。鞘磷脂代谢产物如神经酰胺(ceramide,Cer)、鞘氨醇(sphingosine, Sph)、S1P可作为第一信使和(或)第二信使调控着多种生理性和病理性的细胞生命活动,在糖尿病、肿瘤、炎症、动脉粥样硬化和骨质疏松等的发生发展中发挥着重要作用[14-15]。鞘氨醇激酶(sphingosine kinases, SphK)是调控细胞内Cer、Sph和S1P代谢平衡的关键酶。研究发现,Cer和Sph是细胞增殖的负调控因子,能够抑制细胞生长,终止细胞周期过程,促进细胞凋亡;而其进一步的代谢物S1P则刺激细胞生长、增殖和存活,抑制细胞凋亡[3,13]。Cer和Sph向着S1P的方向转化,而S1P在一定条件下也可以向着相反方向转换,Cer/Sph与S1P之间构成了一个动态平衡的关系,这个动态平衡控制着神经鞘脂类的代谢通路,决定着细胞的生死存亡,这种反向调节作用被形象地称作“鞘脂变阻器”[3]。
“鞘脂变阻器”在胰岛β细胞的存活和功能调节方面均发挥重要的作用。研究表明,SphK和S1P表达于INS-1胰岛素瘤细胞系和大鼠的胰岛组织,在分离的大鼠胰岛内,SphK催化S1P生成,促进细胞存活,抑制细胞凋亡[6,16]。此外,在经过S1PR激动剂FTY720治疗的db/db小鼠胰腺中的胰岛面积大于对照组的2倍,提示FTY720能防止胰岛损伤和通过抑制胰岛β细胞凋亡和促进β细胞存活而保护β细胞[17]。既往研究显示,S1P在β细胞中调节葡萄糖刺激的胰岛素分泌,在克隆的仓鼠β细胞系HIT-T15及离体小鼠胰岛中,S1P通过激活磷脂酶C(PLC)能明显的刺激β细胞呈葡萄糖依赖的胰岛素分泌[18]。本研究首次在T2DM小鼠模型中探索外源性S1P对胰岛β细胞的保护作用,结果显示,在高脂饮食联合小剂量STZ诱导的T2DM小鼠模型上腹腔注射S1P溶液后能抑制胰岛β细胞凋亡,促进增殖,与既往研究结果一致。经过S1P治疗后的小鼠与模型对照组相比,HE染色及胰岛素免疫组化染色显示胰岛病变较轻,胰岛数量增多,体积增大,结构较清晰,胰岛内细胞数目增多,排列较整齐,形态较规整,提示S1P可以改善T2DM小鼠胰岛β细胞形态。给小鼠腹腔注射S1P后,空腹血糖、葡萄糖耐量、HOMA-IR均较模型对照组改善,提示S1P对胰岛β细胞损伤具有保护作用,S1P信号通路可能是未来治疗糖尿病的潜在靶点。
虽然本研究及既往研究均表明,S1P可能促进胰岛β细胞增殖,抑制凋亡,但是目前S1P的作用机制以及受体类型仍不清楚[14,19],仍需进一步研究S1P和它的受体亚型在胰岛β细胞中的作用以明确S1P调节β细胞功能的机制。因此,本研究首先探讨S1PR在胰岛组织的表达情况及糖尿病时S1PR的表达变化,从而初步筛选出可能与糖尿病关系密切的受体亚型。结果显示,大鼠胰岛细胞表达S1P1、S1P2、S1P3、S1P4的mRNA,但不表达S1P5,胰岛细胞瘤INS-1细胞系只表达S1P1、S1P2、S1P3的mRNA[20-21]。而S1PR在小鼠胰岛组织的表达仍未知。本实验对高脂饮食加STZ诱导的T2DM小鼠胰腺组织进行S1PR1、S1PR2、S1PR3蛋白的免疫组化染色,结果显示,S1PR1、S1PR2、S1PR3蛋白均表达于小鼠胰腺中,且仅仅表达于胰岛细胞,并与连续切片的胰岛素染色阳性细胞定位一致,说明表达于胰岛β细胞,而在胰腺组织外分泌部不表达。其中S1PR1及S1PR2蛋白在T2DM小鼠的胰岛中的表达较正常对照组表达明显升高,而S1P给药两组及模型对照组之间表达差异无统计学意义;S1PR3蛋白在糖尿病小鼠及正常对照组小鼠中表达无差异。本实验结果提示,S1P的受体亚型S1PR1及S1PR2可能在T2DM的发病机制及病理生理改变中发挥着一定的作用。推测S1P可能是通过与S1PR1及S1PR2受体结合,介导S1P通路激活,进而抑制β细胞凋亡、促进增殖,促进胰岛素分泌,发挥对糖尿病胰岛β细胞的保护作用,其作用方式及相关信号通路有待进一步的研究发现。但S1P腹腔注射并未有使胰岛中S1PR量改变的作用。
本研究首次从形态学方面观察了S1PR1、S1PR2、S1PR3蛋白在正常C57BL/6J小鼠胰腺及高脂饮食联合小剂量STZ诱导的T2DM小鼠胰腺中的表达,并定位了这3个蛋白在胰岛中的表达,推测S1P可能是通过与S1PR1受体及S1PR2受体结合,介导S1P通路激活,进而抑制β细胞凋亡、促进增殖,促进胰岛素分泌,发挥对糖尿病胰岛β细胞损伤的保护作用。总之,本研究结果进一步肯定了S1P信号通路参与T2DM的发生发展过程,也为深入研究糖尿病的发病机制和可能的药物靶点提供了依据,为糖尿病的防治提供新思路。

