茶多酚对糖尿病心肌病大鼠心功能的保护作用及其机制
郑梦莹,李 燕,刘敬禹
(1. 锦州医科大学附属第三医院,辽宁锦州 121000;2. 新乡医学院第一附属医院,河南新乡 453100)
糖尿病心肌病(diabetic cardiomyopathy, DCM)是诱发糖尿病人群心力衰竭的主要危险因素[1]。DCM被定义为心肌的结构和功能异常,独立于冠状动脉疾病或高血压[2]。DCM的潜在细胞和分子机制仍然知之甚少,是多因素且复杂的病理生理学过程,涉及氧化应激、神经激素激活、炎症、钙稳态受损、线粒体损伤、心肌细胞凋亡和自噬[3]。尽管药物可控制血糖并改善心功能不全,但其发病率却不断上升[4]。因此,需要进一步探索DCM的潜在发病机制并开发新药。
绿茶中含有许多称为儿茶素的多酚,研究发现绿茶多酚(green tea polyphenol, GTP)具有清除活性氧自由基的作用,能改善心脏肥大和纤维化以及动脉粥样硬化的发展[5]。GTP是一种有效的抗氧化化合物,已有实验研究证明,其比维生素C、E,迷迭香提取物和姜黄素有更强的抗氧化保护作用[6]。在某些条件下,GTP可以改善DNA的自由基损伤。尽管有证据表明GTP参与改善心脏相关疾病,但很少有关于GTP和DCM的研究报道。
巨自噬(以下称为自噬)是在应激状态下细胞利用溶酶体降解自身受损的细胞器和大分子物质的过程。一般认为自噬对维持正常的心脏功能和形态学至关重要[7]。在基线时,自噬能清除蛋白聚集和损伤;在缺血时,自噬被激活使代谢基质再循环以维持心肌生存[8]。据报道,在OVE26小鼠心脏中自噬被抑制,而采用二甲双胍治疗可恢复OVE26小鼠的心脏自噬,有效预防心肌损伤[9-10]。这表明自噬可能在1型糖尿病模型的心脏中起保护作用。研究表明,GTP可诱导自噬[11],但自噬在GTP预防DCM中的作用尚不清楚。
因此,本研究探讨了GTP对DCM的体内心脏保护作用;拟通过建立DCM模型,并用GTP或氯喹(CQ,自噬抑制剂)进行相应的治疗处理以阐明GTP对DCM的作用。
1 材料与方法
1.1实验动物75只雄性SD大鼠,体质量(160±20)g,6~8周龄。本研究经锦州医科大学第三附属医院伦理委员会批准,按照锦州医科大学动物保健委员会制定的动物护理原则进行饲养。
1.2 Ⅰ型糖尿病(T1DM)诱导和实验分组按体质量给予大鼠腹膜内注射60 mg/kg链脲佐菌素(STZ,0.1 mmol/L柠檬酸缓冲液稀释)诱导建模T1DM。空腹血糖>16.8 mmol/L表示糖尿病诱导成功,T1DM造模成功率62.5%,死亡率11.3%。
将诱导成功的大鼠(47只)随机分为糖尿病组(DM,n=12),GTP组(DM+GTP,n=12),GTP+CQ组(DM+GTP+CQ,n=11),CQ组(DM+CQ,n=12)。另设正常对照组(NG,n=15),未注射STZ,仅注射柠檬酸缓冲液。各组分别灌胃14周。NG组和DM组在相同时间灌胃等体积蒸馏水,CQ组灌胃CQ溶液[Sigma公司,50 mg/(kg·d),溶于9 g/L生理盐水中]。GTP(批号Y1502,美国Sigma公司)溶于蒸馏水中,根据文献[12]按400 mg/(kg·d)GTP灌胃,而GTP+CQ组灌胃等量的CQ和GTP混合溶液。
1.3血压和超声心动图检查灌胃14周,用动物全身体积描记器(BP2000,美国Apex公司)测量心率(HR)、收缩压(SBP)和舒张压(DBP)和平均动脉压(MAP)。吸入30 mL/L异氟烷麻醉大鼠后,使用Philips IE33超声系统(Philips IE33,Philips Medical Systems, Holland)测量经胸超声心动图,并从二维超声心动图获得相关心动参数。所有的测量重复6~8个连续的心动周期。
1.4生化分析检测测量血压和超声心动图检查后,自大鼠股动脉采血后,处死。称体质量(BW),测量胫骨长度(TL)。取心脏组织并-80 ℃储存。采用Beckman CX-7生化自动分析仪(美国CA公司)检测脂代谢相关指标。使用ELISA试剂盒(北京康肽生物科技有限公司)检测血清和尿白蛋白和血清血红蛋白A1c(HbA1C)水平。
1.5HE染色及透射电子显微镜(TEM)观察将心脏沿心室中间水平横向平分,取部分左心室组织,常规处理制成4 μm切片,HE染色,Eclipse 80i显微镜(日本尼康公司)观察形态学变化并保存图像;部分左心室组织常规制作电镜切片,电子显微镜(JEM-2000EX TEM,日本东京)下观察并拍摄图像。
1.6Westernblot检测取左心室心肌组织提取组织蛋白,20 μg上样进行凝胶电泳(100~200 g/L Tricine梯度)后,转至纤维蛋白膜,再分别滴加一抗:兔多克隆LC3-Ⅱ(1∶500),p-GSK3β(1∶200),LC3-Ⅰ(1∶500),BECN1(1∶200),MYC(1∶200),SQSTM1(1∶100),p-MTOR(1∶200),MTOR(1∶200),CTNNB1(1∶100),GSK3β(1∶200),TCF4(1∶500)抗体和抗GAPDH兔多克隆(1∶1 000),4 ℃过夜后,滴加IgG辣根过氧化物酶二抗孵育后,常规显色、观察。将靶向条带归一化至GAPDH以确定目的蛋白的相对表达。

2 结 果
2.1各组大鼠的一般特征DM组大鼠血糖和HbA1C水平较NG组显著升高(P<0.05),而血清胰岛素和体重水平较NG组显著降低(P<0.05)。GTP组的尿白蛋白和血清甘油三酯浓度较DM组显著降低(P<0.05)。此外,不同组间血清白蛋白、TC浓度、心率和血压水平差异无统计学意义(P>0.05,表1)。
表1各组大鼠的一般特征
Tab.1 General characteristics of the rats
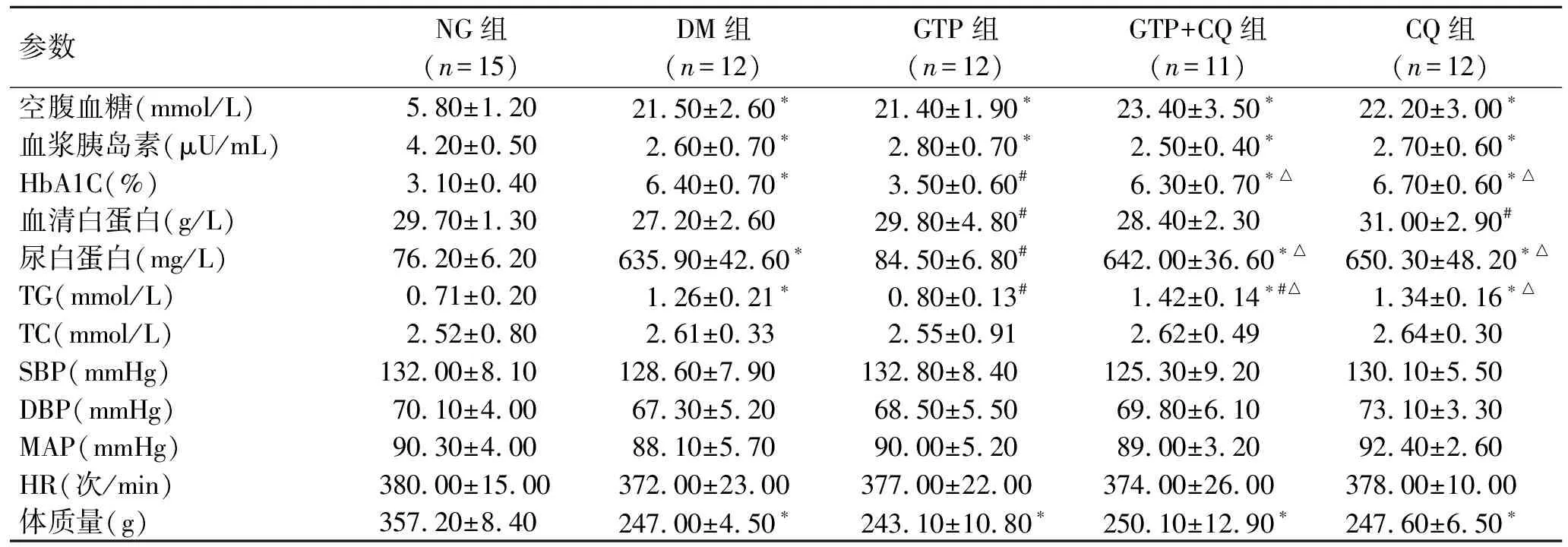
参数NG组(n=15)DM组(n=12)GTP组(n=12)GTP+CQ组(n=11)CQ组(n=12)空腹血糖(mmol/L) 5.80±1.2021.50±2.60∗21.40±1.90∗23.40±3.50∗22.20±3.00∗血浆胰岛素(μU/mL)4.20±0.502.60±0.70∗2.80±0.70∗2.50±0.40∗2.70±0.60∗HbA1C(%)3.10±0.406.40±0.70∗3.50±0.60#6.30±0.70∗△6.70±0.60∗△血清白蛋白(g/L)29.70±1.3027.20±2.6029.80±4.80#28.40±2.3031.00±2.90#尿白蛋白(mg/L)76.20±6.20635.90±42.60∗84.50±6.80#642.00±36.60∗△650.30±48.20∗△TG(mmol/L) 0.71±0.201.26±0.21∗0.80±0.13#1.42±0.14∗#△1.34±0.16∗△TC(mmol/L)2.52±0.802.61±0.332.55±0.912.62±0.492.64±0.30SBP(mmHg)132.00±8.10128.60±7.90132.80±8.40125.30±9.20130.10±5.50DBP(mmHg)70.10±4.0067.30±5.2068.50±5.5069.80±6.1073.10±3.30MAP(mmHg)90.30±4.0088.10±5.7090.00±5.2089.00±3.2092.40±2.60HR(次/min)380.00±15.00372.00±23.00377.00±22.00374.00±26.00378.00±10.00体质量(g)357.20±8.40247.00±4.50∗243.10±10.80∗250.10±12.90∗247.60±6.50∗
与NG组比较,*P<0.05;与DM组比较,#P<0.05;与GTP组比较,△P<0.05。
2.2GTP改善了T1DM大鼠的心脏功能各组代表性二维超声心动图见图1所示。与对照组相比,左心室舒张末期/收缩期直径(LVED与LVEDd)、左心室收缩期和舒张期室间隔直径(LVIVs与LVIVd)、舒张期左心室后壁厚度(LVPWD)及左心室舒张末期容积/收缩期容积(EDV/ESV)水平较高,而左心室射血分数(EF%)、左心室射血分数不足(FS%)和早期与晚期二尖瓣血流速度峰值比(E/A)比值减少,表明糖尿病大鼠的心脏功能受损;采用GTP治疗14周可改善心脏功能受损,但加入CQ治疗逆转了GTP对心脏功能的保护作用(图2)。


图1 各组大鼠代表性二维超声心动图Fig.1 Representative two-dimensional echocardiograms of each groupA:NG组;B:DM组;C:GTP组;D:GTP+CQ组;E:CQ组。

图2各组大鼠二维超声心动参数的比较
Fig.2 Two-dimensional echocardiographic parameters of each group
A:左心室舒张末期/收缩期直径;B:左心室收缩期和舒张期室间隔直径;C:左心室舒张末期容积/左心室收缩期容积;D:左心室射血分数和左心室射血分数不足所占比例;E:舒张期左心室后壁厚度;F:早期和晚期二尖瓣血流速度峰值比。与NG组比较,*P<0.05;与DM组比较,#P<0.05;与GTP组比较,△P<0.05。
2.3GTP减轻T1DM大鼠的心脏肥大、纤维化和超微结构异常HE染色显示,DM组的心肌组织学发生显著改变,如心肌细胞紊乱、细胞间边界不明显和细胞核大小不规则(图3)。透射电镜分析显示,NG组大鼠心脏肌原纤维排列整齐,有规则连续的肌节,肌原纤维间线粒体纵向分布正常;相反,DM组的左心室组织表现出破坏的肌原纤维和错位和聚集的线粒体(图4)。这些发现表明糖尿病大鼠的心脏结构受损。与DM组相比,GTP显著改善了糖尿病大鼠异常的心肌组织形态和纤维化(图3、图4)。
HE染色和透射电镜分析显示,与GTP + CQ组相比,CQ组的心脏组织结构存在显著恶化(图3、图4)。此外,CQ逆转了GTP对心脏功能的保护作用(图5)。总之,这些结果显示,GTP可能通过调节自噬来改善糖尿病大鼠受损的心脏功能和组织学异常。

图3大鼠心肌组织HE染色结果
Fig.3 HE staining of left ventricular tissue (×400)
A:NG组;B:DM组;C:GTP组;D:GTP+CQ组;E:CQ组。
2.4GTP促进T1DM大鼠心肌细胞自噬与NG组相比,DM组中LC3-Ⅱ/Ⅰ比值和BECN1表达显著降低(P<0.05),SQSTM1水平显著增加(P<0.05);同时,CQ组的LC3-Ⅱ/Ⅰ比值、BECN1和SQSTM1蛋白水平与DM组相比无明显变化,表明糖尿病大鼠心肌细胞自噬体形成受损;此外,与DM组相比,GTP治疗增加了LC3-Ⅱ/Ⅰ比值和BECN1蛋白表达水平,并降低了SQSTM1的蛋白水平;值得注意的是,CQ和GTP联合治疗可进一步增加LC3-Ⅱ/Ⅰ和SQSTM1的蛋白水平(图5)。总之,这些结果表明,GTP可部分恢复STZ诱导的糖尿病大鼠心肌细胞中的自噬缺陷。

图4 各组大鼠代表性左心室组织的TEM观察结果Fig.4 Representative TEM of left ventricular specimens in each group (×12000)A:NG组;B:DM组;C:GTP组;D:GTP+CQ组;E:CQ组。

图5Westernblot检测不同组间T1DM大鼠心肌细胞自噬蛋白的表达变化
Fig.5 Western blot analysis of autophagic indicators among different groups (n=6)
与NG组比较,*P<0.05;与DM组比较,#P<0.05;与GTP组比较,△P<0.05。
2.5GTP抑制T1DM大鼠心肌细胞中β-catenin/TCF4/GSK-3β和MTOR信号DM组β-catenin、TCF4和MYC的蛋白表达均较NG组显著上调(P<0.05),并且p-GSK3β/GSK3β和p-MTOR/MTOR的比值较NG组显著提高(P<0.05)。与DM组相比,GTP组的β-catenin、TCF4和MYC蛋白表达水平及p-GSK3β/GSK3β和p-MTOR/MTOR的比值均显著降低(P<0.05,图6)。
3 讨 论
最近,有多篇研究报道认为,GTP的一些有益保护作用可能是通过调节自噬来介导的[13]。然而,GTP对自噬的影响似乎是组织特异性的。在巨噬细胞中,GTP促进内毒素诱导的HMGB1(一种晚期致死性炎症因子)的自噬性降解[14]。GTP的自噬促进作用也发生在牛主动脉内皮细胞中,并解释其降低脂质积聚[13]。然而,在人类视网膜色素上皮细胞中,GTP通过下调自噬减少UVB光诱导的视网膜损伤[15]。虽然GTP对心肌细胞损伤也有保护作用,但尚不清楚是否调节心脏自体吞噬来介导这些效应。本研究发现,GTP通过调节β-catenin/TCF4/GSK-3β通路和MTOR通路可恢复DCM大鼠受损的心肌细胞自噬。
DCM的特征是左心室肥厚、心肌重塑和舒张/收缩功能障碍及心肌纤维化,最终进展为心力衰竭[16]。先前的研究已经证明GTP与心脏肥大和纤维化有关[17]。在心力衰竭患者和动物模型中,补充GTP改善了心脏功能障碍和结构异常[18]。本研究发现,用GTP治疗改善了心脏舒张和收缩功能并减轻了T1DM大鼠心脏中的心室肥大和纤维化,与既往的研究结果一致。
心脏组成性自噬对维持正常心脏结构和功能是必要的。在成年小鼠中,心脏特异性缺乏自噬相关的Atg5引起心脏功能障碍并破坏心脏结构[19]。本研究中,T1DM大鼠心脏中的自噬受到抑制,自噬体减少,LC3-Ⅱ/Ⅰ比值、BECN1蛋白水平下降,并增加SQSTM1蛋白表达的水平。

图6 不同组间糖尿病大鼠心脏中的β-cate-nin/TCF4/GSK-3β和MTOR信号蛋白的表达
Fig.6 Western blot analysis of the proteinexpress-sions of β-catenin/TCF4/GSK-3β and MTOR sig-naling pathway in different groups (n=6)
与NG组比较,∗P<0.05;与DM组比较,#P<0.05;与GTP组比较,△P<0.05。
GTP可以在不同条件下诱导自噬,在雄性C57BL/6小鼠的肝脏缺血再灌注损伤中,GTP预处理显著增强自噬通量并减弱再灌注损伤[20-21]。这提示用GTP治疗可以恢复体内受损的心脏自噬。此外,用CQ抑制剂可消除GTP对糖尿病大鼠心肌损伤的保护作用,并增加LC3-Ⅱ/Ⅰ的蛋白表达水平。CQ为自噬体-溶酶体抑制剂,自噬体积累和LC3-Ⅱ/Ⅰ水平增加表明GTP促进自噬的形成。上述数据表明,糖尿病引起的心脏自噬抑制可能在DCM的发病机制中起作用,而GTP可能通过增强自噬来防止DCM。
有研究表明,Wnt/β-catenin信号通路与心脏重塑、心肌梗塞、心力衰竭和心律失常的病理过程有关[22],其信号通路的过度激活牵涉DCM的发展[23]。经典的β-catenin信号通路的活化主要表现为β-catenin在细胞质中增多,进一步转移到细胞核中与T细胞因子/淋巴增强因子共同作用,启动Wnt靶标下游基因转录[22]。GSK-3β能够促进β-catenin降解。此外,在几种不同肿瘤模型中,研究人员已经证明β-catenin信号的激活可以通过抑制GSK-3β而激活雷帕霉素靶蛋白(MTOR)的哺乳动物靶点[24]。MTOR参与调节成年人的心脏功能,并作为调节自噬途径的关键组成部分[25]。本研究发现,STZ诱导14周后,糖尿病心脏中β-catenin、TCF4和MYC的mRNA和蛋白水平明显升高,并且糖尿病增加了GSK3β和MTOR的磷酸化。这些发现提示β-catenin/TCF4/GSK-3β/MTOR信号可能参与了DCM的发展。而用GTP治疗可抑制心脏中的β-catenin/TCF4/GSK-3β/MTOR信号,改善心肌细胞的自噬缺陷。
总之,本研究结果表明,GTP的施用有效改善了T1DM大鼠心脏功能、心肌肥大和间质纤维化,其作用机制可能通过抑制β-catenin/TCF4/GSK-3β/MTOR信号通路,与恢复心肌细胞中的自噬缺陷有关。

