二甲双胍治疗对多囊卵巢综合征模型大鼠卵巢中Fas/FasL表达的影响
田 宏,欧阳远朔,丁上书,王 蕊,孔 宁,王子阳,申 琳,路 明,张晓田,武 捷,胡海波,周劲松
(1. 西安交通大学医学部基础医学院人体解剖与组织胚胎学系,陕西西安 710061;2. 西安交通大学医学部基础医学院生殖医学研究中心,陕西西安 710061;3. 石河子大学医学院,新疆石河子 832003)
多囊卵巢综合征(polycystic ovary syndrome, PCOS)是一种常见的内分泌紊乱性疾病,影响了5%~10%的育龄期妇女,主要表现为长期无排卵、胰岛素抵抗、月经周期不规律、黄体生成素脉冲式分泌增加、高雄激素血症、肥胖多毛等临床症状的异质性病变[1-4]。PCOS发病机制复杂,包括MAPK信号通路、细胞周期和凋亡通路相关分子的异常,均成为PCOS发病的关键因素[5]。PCOS患者卵巢中存在大量小卵泡,但卵泡继续发育障碍,成熟卵泡的周期性生成受阻[6]。在卵泡的发育、成熟及闭锁过程中,卵母细胞和卵泡颗粒细胞的凋亡扮演重要的角色,尤其是颗粒细胞的凋亡被认为是卵泡退化的根本原因[7]。体外研究表明,颗粒细胞异常凋亡与PCOS的发生关系密切,PCOS大鼠卵巢组织呈现的低凋亡率可能是维持卵巢多囊化的原因之一[8]。在PCOS卵巢颗粒细胞中,凋亡相关蛋白Fas、FasL的表达发生改变说明PCOS卵巢颗粒细胞的Fas/FasL通路异常会导致卵泡凋亡增多[9-10],但PCOS和凋亡蛋白的相互关系鲜有报道。
二甲双胍(dimethyl biguanide, DB)又称甲福明(metformin),作为一种胰岛素增敏剂,被广泛用于治疗2型糖尿病。近年来发现,DB通过影响胰岛素分子的功能而增加卵巢颗粒细胞对胰岛素的敏感性,不同的信号途径影响PCOS患者颗粒细胞的内分泌功能,从而改善多数PCOS患者月经紊乱、高雄激素血症症状,且DB可减轻PCOS时颗粒细胞的凋亡,有助于患者卵泡的发育及排卵[11]。虽然目前DB用于PCOS的治疗越来越常见,但其主要通过作用于哪些凋亡相关蛋白来改善PCOS的特征性临床症状,仍缺乏较为完善的分子机制解释。本研究拟通过皮下注射DHEA建立PCOS大鼠模型,给予模型鼠口服DB治疗,明确凋亡调节蛋白Fas和FasL在DB治疗前后的表达变化,为研究DB治疗PCOS分子机制及其与颗粒细胞凋亡的关系提供实验资料。
1 材料与方法
1.1材料
1.1.1 实验试剂 大鼠胰岛素(insulin, INS)、黄体生成素(luteinizing hormone, LH)和睾酮(testosterone, T)ELISA检测试剂盒(美国R&D公司);兔抗鼠Fas一抗、兔抗鼠FasL一抗(武汉三鹰生物技术有限公司);DHEA粉剂(西安高远生化有限公司);注射用大豆油(浙江田雨山药用油有限公司);盐酸二甲双胍片(上海施贵宝制药有限公司)。
1.1.2 动物分组及饲养 30只85天龄健康雌性Sprague-Dawley(SD)大鼠(购于西安交通大学医学部实验动物中心),饲养在温度19~28 ℃、相对湿度40%的洁净环境中,喂食双蒸水和购于动物中心的大鼠饲料,随机分为3组:①PCOS组,10只大鼠;②DB治疗组,10只大鼠;③对照组,10只大鼠。
1.1.3 PCOS大鼠模型的建立[12]及DB治疗PCOS鼠 PCOS组和DB治疗组大鼠每日晚(20∶00)每100 g体质量皮下注射脱氢表雄酮(DHEA)粉剂6 mg(用0.2 mL注射用大豆油剂和35 μL无水乙醇溶解),连续注射25 d;对照组注射0.2 mL大豆油剂。DHEA连续注射25 d后,DB治疗组按人用药剂量0.83 mg/kg×6.25折算大鼠用药剂量,给予该组大鼠DB灌胃治疗14 d,每天1次;同期对照组和PCOS组大鼠给予生理盐水灌胃。
1.1.4 各组大鼠的取材和处理 灌胃治疗14 d后,以200 g/L乌拉坦5 mL/kg腹腔麻醉各组大鼠,腹部正中切口,沿子宫寻找、分离双侧卵巢,观察卵巢表面,称量卵巢重量,测定卵巢长径(L)和短径(S),计算平均卵巢面积(MOP=L×S)、卵巢体积V=4.19×[(L+S)/2]3。将一侧卵巢投入新鲜配制的40 g/L多聚甲醛固定液中固定,常规石蜡包埋,5 μm切片待用;另一侧卵巢置于2 mL冻存管中-80 ℃保存;眼球取血置于抗凝管中-20 ℃保存。
1.2方法
1.2.1 大鼠卵巢组织HE染色 各组大鼠卵巢组织石蜡切片脱蜡至水,浸入Harris苏木素染液中染色15 min,盐酸乙醇分色,双蒸水冲洗切片后浸入3 g/L伊红染液中染色6 min,梯度乙醇脱水,二甲苯透明,中性树胶封片镜下观察,测量卵巢长径、短径、最大卵泡直径和卵泡膜厚度。
1.2.2 ELISA法测定大鼠血清INS、LH、T水平 抗凝管中的血液样本3 000 r/min离心30 min,吸取上清待用;设置标准品孔和样本孔,标准品孔分别加入各试剂盒中不同浓度的标准品50 μL,空白孔加浓度为0的S0号标准品;样本孔中加入离心所得的待测血清样本10 μL,继续加入样本稀释液40 μL;标准品孔和样本孔中每孔加入辣根过氧化物酶标记的检测抗体100 μL,37 ℃孵育60 min;弃去液体,洗板后每孔加入底物,37 ℃避光孵育15 min;加入终止液50 μL,15 min内在450 nm波长处测定各孔A值;以标准品浓度作横坐标,对应A值作纵坐标,绘制标准品线性回归曲线,按曲线方程计算各样本浓度值。
1.2.3 免疫组织化学法检测大鼠卵巢组织中Fas、FasL蛋白的表达 切片经二甲苯、梯度乙醇脱蜡至水,30 mL/L H2O2中作用15 min以封闭内源性过氧化物酶,10 mL/L TritonX-100中穿透15 min,50 mL/L正常山羊血清37 ℃湿盒中封闭25 min,滴加兔抗鼠Fas、FasL一抗(1∶100,抗体稀释液:10 g/L BSA、4 mL/L Triton X-100,溶于0.1 mol/L PBS(pH 7.4中)4 ℃孵育过夜。次日恢复室温,滴加生物素标记的山羊抗兔IgG,37 ℃孵育60 min,滴加辣根酶标记的链霉卵白素工作液37 ℃孵育25 min,滴加DAB显色3~4 min,镜下观察,终止反应。使用苏木素染液复染细胞核1~3 min,自来水中浸泡返蓝20 min,脱水、透明,中性树胶封片。以0.1 mol/L PBS(pH 7.4)代替一抗作阴性对照。Olympus BX-51型显微镜下观察,每组至少选取7张不同个体来源的切片,每张切片随机选择3个视野采集图像。
1.2.4 Western blot检测检测大鼠卵巢组织中Fas、FasL蛋白的表达 利用50∶1的RAPI-蛋白酶抑制剂液提取各样本卵巢组织的总蛋白,Nanodrop2000微型分光光度计测蛋白浓度及A值,选取A260/280在0.5左右样本,滴加5×上样缓冲液,沸水中煮8~10 min使蛋白充分变性。分别配制120 g/L的分离胶和50 g/L的浓缩胶,加入蛋白样品电泳。以恒流100 mA冰水浴中转印1 h,30 g/L牛血清蛋白封闭PVDF膜1 h,利用兔抗鼠Fas一抗、兔抗鼠FasL一抗进行免疫检测。膜上滴加ECL化学发光剂,压片曝光,显影、定影,胶片拍照。以兔抗鼠β-actin一抗检测的β-actin蛋白表达作内参照。Western blot结果使用图像分析软件(Image J 2×,美国)测量并计算条带的平均积分吸光度(integrated optical density, IOD),数值与蛋白表达强度成正比。
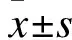
2 结 果
2.1大鼠卵巢大体形态学和HE染色观察
2.1.1 卵巢大体形态学观察 对照组卵巢色红润,表面可见黄体;PCOS模型鼠卵巢体积变大,卵巢表面可见多个扩张明显的半透明状卵泡;DB治疗组卵巢体积变小,表面发白且卵泡扩张不明显。PCOS组大鼠卵巢重量(F=23.145,P=0.001)、体积(F=26.889,P=0.008)、平均卵巢面积(F=39.207,P=0.000)比对照组增加(表1),而DB治疗组的3项指标均比PCOS组减小(F=23.145,P=0.000;F=26.889,P=0.000;F=39.207,P=0.000),差异具有统计学意义,但与对照组比较则无统计学意义(F=23.145,P=0.185;F=26.889,P=0.186;F=39.207,P=0.400)。
2.1.2 组织病理学观察 对照组卵巢皮质内可见各级卵泡和黄体,窦状卵泡中可见卵丘和卵母细胞(图1A);PCOS组大鼠卵泡囊性扩张较为明显,囊性扩张卵泡中未见卵母细胞,可见多个小窦状卵泡,颗粒细胞层数减小,排列较稀疏,卵泡膜厚度增加(图1B);DB治疗组大鼠卵泡囊性扩张减轻,但囊性扩张卵泡中未见卵母细胞(图1C)。PCOS组最大卵泡直径和卵泡膜厚度均比对照组增加(F=14.982,P=0.001;F=3.936,P=0.024,表1),差异具有统计学意义。
表13组大鼠卵巢形态学指标的比较
Tab.1 Histological analysis of the female rats’ ovaries in three groups


组别(n=10)卵巢重量(g)卵巢体积(m/mm3)平均卵巢面积(m/mm2)最大卵泡直径(μm)卵泡膜厚度(μm)对照组44.60±3.45422.78±84.1820.77±2.841363.38±181.0554.47±4.85PCOS组59.50±7.74∗688.37±107.77∗29.55±3.53∗1866.89±167.87∗72.26±11.90∗DB治疗组37.90±2.72#334.33±15.49#17.99±0.41#1419.05±123.81#56.77±13.83#
与对照组相比,*P<0.05;与PCOS组相比,#P<0.05。

图13组大鼠卵巢组织的HE染色
Fig.1 HE staining shows microstructures of the ovaries of SD rats in the three groups (×100)
A:对照组;B:PCOS组;C:DB治疗组。
2.23组大鼠血清INS、LH、T水平的比较PCOS组和DB治疗组大鼠血清INS、LH和T水平均比对照组升高(F=28.097,P均<0.001;F=38.856,P均<0.001;F=61.289,P均<0.001),但与PCOS组相比,DB治疗组血清T水平则呈明显下降(F=61.289,P=0.003,表2)。
表23组大鼠血清INS、LH、T水平的比较
Tab.2 Comparison of serum INS, LH and T levels in three groups’ female rats


组别(n=10)INS(mU/L)LH(mIU/mL)T(pg/mL)对照组6.01±1.9729.83±6.08123.76±39.23PCOS组22.40±1.27∗62.07±3.00∗463.35±39.97∗DB治疗组18.32±5.78∗69.13±11.11∗346.69±64.42∗#
与对照组相比,*P<0.05;与PCOS组相比,#P<0.05。
2.3Fas蛋白和FasL蛋白的免疫组织化学染色结果Fas蛋白和FasL蛋白免疫组织化学染色阳性结果呈棕褐色,两种蛋白都主要表达于囊状卵泡颗粒层细胞胞质内,尤其在PCOS模型鼠囊状扩张卵泡中近卵泡腔的1~2层颗粒细胞胞质内表达较强;在初级卵泡卵母细胞胞质和其外侧透明带也可见两种蛋白的表达(图2)。
2.4Fas和FasL蛋白的Westernblot检测结果各组别总蛋白样本中均检测到Fas蛋白38和FasL 31 ku条带。图像分析结果显示,PCOS组Fas蛋白的表达量比对照组增加(F=137.897,P<0.001),而DB治疗组该蛋白的表达比对照组和PCOS组均降低(F=137.897,P=0.002,P<0.001),差异具有统计学意义;PCOS组和DB治疗组FasL蛋白的表达均比对照组显著增加(F=16.138,P=0.006,P=0.001),但两组间该蛋白表达无统计学差异(图3)。
3 讨 论
自1935年STEIN和LEVENTHAL首次发布了PCOS的报道后,通过建立合适的动物模型来研究PCOS的发病机制、病理生理变化及临床诊治,使得该病症的研究日趋深入。多种动物如大鼠、小鼠、兔、狗及灵长类均被选做模式动物用于研究PCOS,且利用多种方法包括脱氢表雄酮造模法、丙酸睾丸造模法、雌激素造模法、孕激素联合HCG造模法等都成功建立了PCOS模型。在模型动物中呈现出该病症多样化的临床症状,具有高雄激素血症、高胰岛素血症、持续性不排卵、卵巢多囊性改变等PCOS的特征性改变,其中脱氢表雄酮造模法甚至出现了肾上腺功能亢进和性成熟提前的特点。

图2Fas和FasL蛋白在三组大鼠卵巢中的表达情况
Fig.2 The expressions of Fas and FasL proteins in the ovaries of three groups’ rats (×200)
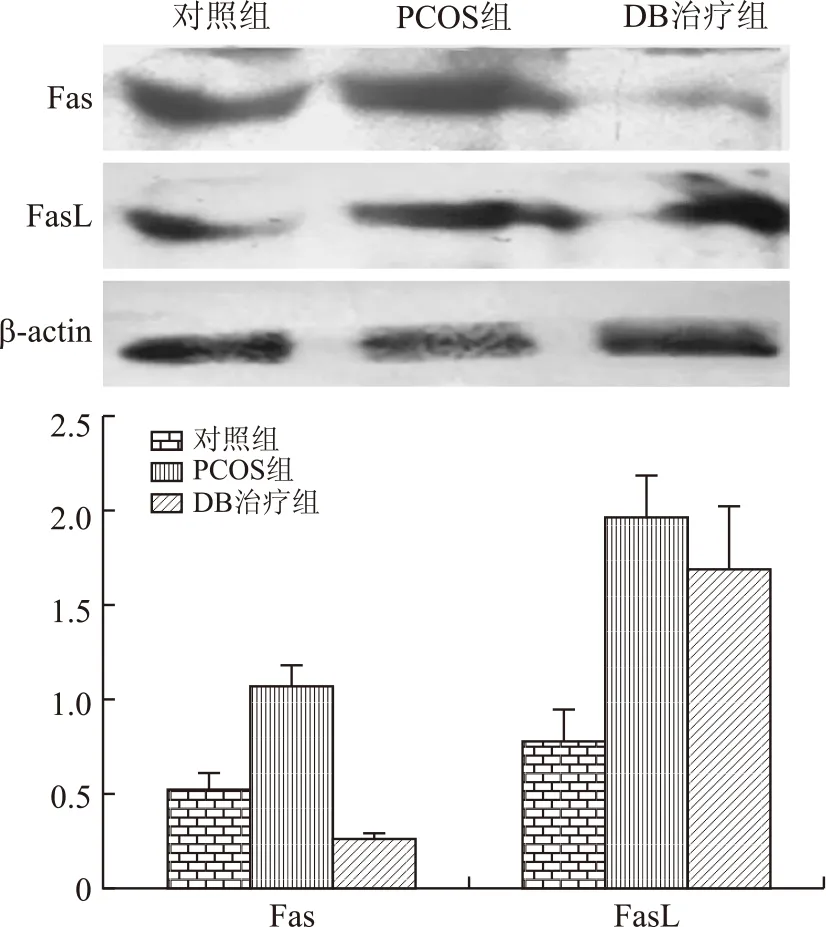
图3Fas和FasL蛋白在3组大鼠卵巢中的相对表达结果
Fig.3 The relative values of Fas and FasL proteins by Western blot in the ovaries of three groups’ rats
本研究采用腹腔皮下注射脱氢表雄酮建立PCOS大鼠模型,PCOS组大鼠卵巢大体解剖和微细结构均呈现较为明显的多囊性改变,卵巢重量、体积、平均表面积、最大卵泡直径和卵泡膜厚度均增加,且血清INS、LH和T水平均较对照组显著升高,模型鼠具有与PCOS患者卵巢病理学和血清激素改变相一致的表现,说明我们利用皮下注射脱氢表雄酮成功建立PCOS大鼠模型,可用于开展与PCOS相关的研究。
细胞凋亡是由许多基因调控的细胞自我消亡过程,它参与了卵巢卵泡的发育、成熟、闭锁及卵巢性激素的正常分泌[13],尤其是卵泡颗粒细胞的凋亡被认为是卵泡退化的根本原因,且在PCOS的发病机制中可能存在异常的凋亡调控。研究表明,许多凋亡调节蛋白诸如Bax、Bcl-2、Fas/FasL、Caspase 3、Caspase 8和Caspase 9和TRAIL等均在卵巢中有表达[6,914-15],且PCOS发生时卵巢颗粒细胞的这些凋亡相关蛋白均发生了改变。Fas/FasL系统是重要的凋亡路径,李梅等[16]免疫组化实验证明Fas在卵母细胞及某些颗粒细胞上有表达,而FasL则强表达于颗粒细胞,且颗粒细胞上FasL的强表达能够诱导表达Fas的卵泡凋亡;他们的研究结果还表明,在PCOS患者中Bax蛋白的表达增强,而Bcl-2蛋白、Fas蛋白和FasL蛋白的表达正常。而HONNMA等[15]研究表明,在脱氢表雄酮造模法建立的PCOS模型中FasL蛋白表达升高。INOUE等[10]发现Fas和FasL的mRNA和蛋白均表达于猪卵巢颗粒细胞胞质中,在卵泡闭锁时表达升高。研究结果均显示,在PCOS动物模型卵巢中Fas和FasL的表达是有变化的。本研究免疫组化结果显示,Fas和FasL两种蛋白都主要表达于囊状卵泡颗粒层细胞胞质内,尤其在PCOS模型鼠囊状扩张卵泡中近卵泡腔的1~2层颗粒细胞胞质内表达较强;在初级卵泡卵母细胞胞质和其外侧透明带也可见两种蛋白的表达,且在PCOS模型鼠卵巢中,两种蛋白的表达均呈显著性升高,这些实验结果与多数PCOS研究结果相似。Fas/FasL系统在正常卵巢组织中有表达,而且在PCOS模型大鼠卵巢中发现它们的表达量发生变化,说明Fas/FasL系统在颗粒细胞凋亡的调控中发挥作用,其表达量的异常变化可能参与DHEA诱导的PCOS大鼠卵巢多囊性改变,也提示这一凋亡调节蛋白通路可能借此参与PCOS患者卵巢的病理进程,但仍需进一步实验证明。Fas和FasL在卵巢中具体的表达定位尚存在差异,可能是动物种属不同、所用一抗及实验方法的不同造成的。
大多数PCOS患者伴有胰岛素抵抗症状,二甲双胍作为胰岛素增敏剂目前临床首选用于治疗PCOS。DB通过降低高胰岛素血症PCOS患者的空腹INS及提高INS对糖的反应,从而降低由高胰岛素血症引发的高雄激素血症,逆转PCOS的内分泌病变,可以有效地改善月经紊乱、闭经和高泌乳素血症的症状,通过降低血清T水平和雄激素受体的表达缓解高雄激素血症[17],我们的实验结果也验证了DB的治疗作用。近年来,针对DB治疗PCOS的分子机理的研究越来越受到重视。研究发现,二甲双胍治疗可以降低PCOS患者血清LH和T水平[18],减轻颗粒细胞的凋亡,有助于PCOS患者卵泡的发育及排卵,但其具体分子机制仍不明确。本研究给予PCOS模型鼠低剂量DB治疗14 d后,雄激素水平明显下降,卵巢微细结构的变化有所改善,且Fas和FasL蛋白的表达也发生了变化。DB治疗组Fas蛋白的表达较对照组和PCOS组均显著降低;而DB治疗组FasL蛋白的表达较对照组显著增加,但与PCOS组比较表达无差异。这表明DB治疗影响了PCOS雌鼠卵巢Fas、FasL蛋白的表达,可能通过逆转PCOS组Fas蛋白的升高而减轻颗粒细胞的凋亡,从而改善卵巢多囊状表现,这对理解DB治疗PCOS的分子机理提供实验资料,但我们仍需进一步的实验验证并明确DB治疗PCOS是否还会通过影响卵巢颗粒细胞其他凋亡路径来改善卵泡发育。从分子水平了解PCOS的治疗机理,这有助于新型抗PCOS药物作用靶点的探究,为新药的研发奠定基础。

