还原型谷胱甘肽抑制高同型半胱氨酸致兔动脉粥样硬化
袁吉祥 姚成立 李继东
(宁夏回族自治区人民医院 西北民族大学第一附属医院,宁夏 银川 750002)
流行病学研究已经确立高同型半胱氨酸血症(HH)是动脉粥样硬化性和血栓性心脑血管疾病独立的危险因素〔1〕。随机临床试验显示口服补充叶酸、维生素B6、B12可以虽然可以显著降低HH,但是似乎并没有改善心脑血管疾病的二级预防结局〔2〕。内源性抗氧化剂还原型谷胱甘肽(GSH)成为目前防治HH所致动脉粥样硬化研究的热点〔3〕。本研究利用3个危险因素造成动脉粥样硬化,分别是:动脉内膜机械损伤、高脂血症及HH。同时利用叶酸和GSH进行干预,观察药物对血脂、同型半胱氨酸(HCY)、氧化应激反应及动脉粥样硬化程度的影响。
1 材料与方法
1.1实验动物和材料 健康雄性新西兰大耳白兔40只,体重2.0~2.5 kg,由宁夏医科大学实验动物中心提供。L-蛋氨酸,胆固醇,GSH由Sigma公司提供。
1.2血管损伤模型的建立 分离右侧股动脉,直视下穿刺并置入5F鞘管,经导丝引入后扩张球囊(3.5 mm×15 mm),以12 atm的压力扩张并拉伤腹主动脉建立血管损伤模型〔4〕。
1.3动物分组与给药方法 健康雄性新西兰大耳白兔40只随机分为4组:对照组,模型组,叶酸组,GSH组。所有兔子先行腹主动脉球囊损伤术,术后对照组给予家兔颗粒饲料喂养12 w,模型组,叶酸组,GSH组术后给予5%脂肪+2%蛋氨酸颗粒饲料喂养12 w。叶酸组给予叶酸颗粒5 mg每日3次口服干预。GSH组给予GSH颗粒 0.2 g每日3次口服干预。
1.4血清检测 术后2 w、12 w自兔子心脏采血,利用全自动生化仪检测血清中总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)及HCY水平,采用Fenton比色法测定血清中活性氧(ROS)水平。黄嘌呤氧化酶法检测血清超氧化物歧化酶(SOD)水平。酶联免疫吸附试验(ELISA)检测氧化低密度脂蛋白(ox-LDL)水平(试剂盒购于南京建成生物工程研究所) 。
1.5病理学检查 术后12 w用注射空气法处死兔子,开腹暴露腹主动脉,剥离损伤的血管段,生理盐水冲洗后,截取2 cm损伤血管固定于10%甲醛溶液中行血管内膜油红O染色。截取2 cm损伤血管放入1.5 ml离心管里,-20℃冷藏,1 w内行冰冻切片油红O染色。截取2 cm固定于10%甲醛溶液,24 h后常规石蜡包埋,间隔相同距离于血管段25%、50%、75%分位切片3次(切片厚度4 μm),行HE染色、核因子(NF)-κB免疫组化染色后光镜下观察。
1.6统计学方法 采用SPSS17.0软件进行t检验。
2 结 果
2.1术后2 w和12 w时各组血清HCY水平 术后2 w后,模型组、叶酸组及GSH组HCY水平较对照组明显升高(P<0.05),术后12 w后,模型组、叶酸组及GSH组HCY显著升高(P<0.05),对照组无明显变化(P>0.05)。但是叶酸组、GSH组与模型组比较HCY水平均相对较低(P<0.05),叶酸组与GSH组比较HCY相对较低,但无显著差异(P>0.05),见表1。
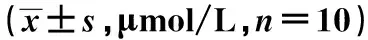
表1 2 w和12 w时血清HCY水平
与对照组比较:1)P<0.05;与本组2 w比较:2)P<0.05;与模型组比较:3)P<0.05,下表同
2.2术后12 w时各组血脂水平 喂养12 w后,模型组、叶酸组及GSH组血脂水平较对照组显著升高(P<0.05)。叶酸组与模型组比较血脂水平无明显差异(P>0.05),GSH组与模型组比较TG,TG,LDL-C明显降低,HDL-C明显升高(P<0.05),见表2。
2.3术后12 w兔子氧化应激水平 术后12 w模型组、叶酸组及GSH组氧化应激水平较对照组显著升高(P<0.05)。叶酸组与模型组比较ROS、SOD、ox-LDL水平无显著差异(P>0.05),GSH组与模型组比较ROS、ox-LDL水平明显降低(P<0.05),SOD水平明显升高(P<0.05),见表3。

表3 12 w时各组血清ROS,SOD,ox-LDL水平
2.4兔腹主动脉内膜粥样硬化斑块形成情况 对照组兔腹主动脉新生内膜轻度增生;模型组兔子主动脉新生内膜显著增厚,结构疏松,可见脂肪沉积形成的空泡;叶酸组兔腹主动脉新生内膜显著增厚,可见脂肪裂隙;GSH组兔腹主动脉内膜增厚。见图1。对照组兔腹主动脉内膜表面增生硬化,油红O不着色;模型组兔腹主动脉内膜可见弥漫性、融合成片的鲜红色脂质斑块隆起凸出于表面;叶酸组兔腹主动脉内膜亦可见成片的脂质斑块;GSH组兔子主动脉内膜表面硬化不平,可见隆起于表面的条纹状红色斑块。叶酸组兔腹主动脉新生内膜脂质斑块百分比与模型组比较未见明显减少(P>0.05),GSH组与模型组比较显著减少(P<0.05),见表4。叶酸组兔腹主动脉新生内膜厚度百分比与模型组比较未见明显减少(P>0.05),GSH组与模型组比较显著减少(P<0.05),见表4。对照组兔腹主动脉横切面细胞增生,全层无油红O着色;模型组兔腹主动脉管壁增厚,管壁结构疏松,各层都有鲜红色米粥样脂滴浸润;叶酸组兔腹主动脉管壁增厚,结构疏松,各层都有脂滴浸润。GSH组兔子腹主动脉管壁增厚,可见泡沫细胞,细胞内可见细小密集的红色脂肪颗粒。见图2。叶酸组兔腹主动脉横切面脂质斑块百分比与模型组比较未见明显减少(P>0.05),GSH组与模型组比较显著减少(P<0.05)。见表4。对照组新生内膜NF-κB少量表达;模型组新生内膜NF-κB大量表达;叶酸组新生内膜NF-κB中量表达;GSH组新生内膜NF-κB表达减少。见图3。NF-κB主要在新生内膜中表达。叶酸组兔腹主动脉新生内膜NF-κB阳性细胞百分比与模型组比较未见明显减少(P>0.05),GSH组与模型组比较显著减少(P<0.05)。见表4。
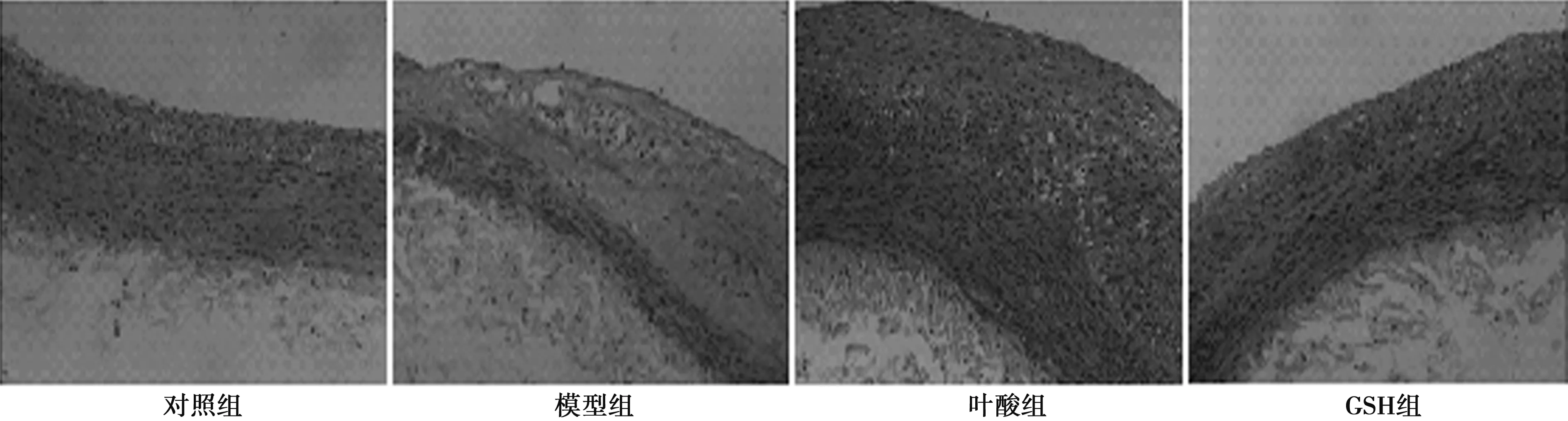
图1 各组兔腹主动脉新生内膜厚度(HE,×100)
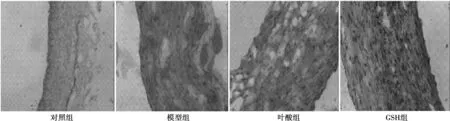
图2 各组兔腹主动脉横切面粥样硬化斑块形成情况(油红O染色,×200)
图3 各组兔腹主动脉NF-κB表达(DAB,×200)
表4 各组腹主动脉病理结果分析
3 讨 论
HCY为一种含硫氨基酸,为体内蛋氨酸代谢的一个重要中间代谢产物。人体内的HCY主要由饮食摄取的蛋氨酸在肝脏、肌肉及其他一些组织中脱甲基生成。蛋氨酸在ATP酶作用下转化为S-腺苷蛋氨酸,S-腺苷蛋氨酸在甲基转移酶的作用下转化为S-腺苷同型半胱氨酸,进一步去腺苷后生成HCY〔5〕。本研究发现2%蛋氨酸喂养模型组兔子2 w,HCY已经明显升高至对照组水平的5倍,喂养至12 w,模型组兔子HCY上升至对照组水平的8倍。HCY在体内的代谢通路包括〔6〕:①重甲基化途径:在二甲基四氢叶酸还原酶催化下,以维生素B12作为辅基,重新甲基化生成蛋氨酸(甲硫氨酸)。②甲基化的替代途径:由甜菜碱提供甲基,在甜菜碱同型半胱氨酸甲基转移酶(BHMT)催化下,生成蛋氨酸及二甲基甘氨酸,在肝脏完成。③ 转硫途径:HCY经转硫途径不可逆生成胱氨酸和α-酮丁酸、硫酸和水,此过程需维生素B6依赖的胱硫醚β合成酶参与。④HCY在重金属离子(Fe3+或Ca2+)存在下,自身氧化。⑤释放到细胞外液。本研究结果表明,口服叶酸可以促进HCY代谢,降低血液中HCY水平,但未明显影响血脂水平。GSH是人类细胞质中自然合成的一种肽,由谷氨酸、半胱氨酸和甘氨酸组成,含有巯基(-SH),广泛分布于机体各器官内。外源性补充GSH不但可以降低HH,还能降低TC、TG、LDL-C水平,升高HDL-C的水平。GSH降低HH的机制可能是通过GSH的转甲基作用促进蛋氨酸循环。GSH调脂作用机制可能是通过转甲基、转丙氨基反应,促进肝脏合成HDL,运载周围组织中的胆固醇,再转化为胆汁酸或直接通过胆汁从肠道排出。
氧化应激是指机体或者细胞内氧自由基的产生与清除失衡,或外源性氧化物质的过量摄入,导致ROS在机体或细胞内蓄积而引起的细胞毒性过程〔7〕。ROS在动脉粥样硬化的发生发展过程中扮演着十分重要的角色。在线粒体内进行的氧化磷酸化过程中,氧分子通过单电子接受反应,转变为超氧阴离子自由基(O2ˉ·)、过氧化氢(H2O2)及羟基自由基(·OH)等中间产物,并最终转化为水。这些中间产物由氧分子转化而来,具有比氧分子更活泼的化学反应性,统称为ROS〔8〕。ROS在SOD的催化作用下能够产生歧化反应,从而被清除,以保护机体细胞免受自由基的攻击和损害。SOD是机体内广泛存在的一种金属抗氧化酶类〔9〕,广泛存在于动物血液和植物种子中。本研究表明,5%脂肪+2%蛋氨酸饲料喂养12 w后,模型组兔子ROS显著升高,SOD也相应升高。叶酸未能明显影响ROS和SOD的水平。GSH显著降低了ROS水平,升高了SOD水平,使血液中ROS的产生与清除趋向平衡。
本研究表明,HH、高脂血症和动脉内膜的机械损伤共同作用可以导致明显的动脉粥样硬化。其可能的机制包括〔10〕:①HH通过自身氧化、HCY二硫化物的形成、Hcy硫内酯的形成及蛋白质的Hcy化生成H2O2和氧自由基,对内皮细胞有直接的细胞毒性作用。②HH、高脂血症和动脉内膜的机械损伤可促进血管平滑肌细胞增殖迁移。③HH和高脂血症促进LDL-C氧化为ox-LDL,后者被巨噬细胞吞噬后成为泡沫细胞,启动动脉粥样硬化过程。④氧自由基攻击生物膜中的多链不饱和脂肪酸引发脂质过氧化作用。本研究结果表明,术后12 w,模型组兔子ox-LDL水平显著升高,叶酸未能明显影响ox-LDL水平,而GSH明显降低了ox-LDL水平。GSH可能是通过巯基与体内的自由基结合,转化成容易代谢的酸类物质从而加速自由基的排泄,降低了LDL-C的氧化反应及膜脂质过氧化作用。
NF-κB是一类特殊的蛋白质,具有和基因启动子区的固定核苷酸序列结合而启动基因转录的功能,参与调控许多与动脉粥样硬化有关的靶基因的表达,在细胞增殖、分化中起重要作用〔11〕。NF-κB的异常激活是体内氧化应激反应放大和持续的分子生物学机制,是HH致动脉粥样硬化发生的始动机制之一〔12〕。HH诱导超氧阴离子的产生增加,对动脉粥样硬化早期NF-κB的激活起一定作用〔13〕。本研究中NF-κB主要在新生内膜中表达,提示动脉粥样硬化主要发生在新生内膜。免疫组织化学结果表明叶酸未能明显影响NF-κB的活性,GSH可以明显抑制NF-κB的活性,提示GSH可能通过调节NF-κB的活性来影响动脉粥样硬化。
总之,GSH可以通过降低血清HCY、调节血脂水平、抗氧化应激及调节NF-κB的活性等途径抑制动脉粥样硬化,可以推测联合叶酸、维生素B6、B12及还原型谷胱甘肽来防治HH所致动脉粥样硬化会有良好的应用前景。

