越鞠丸对小鼠海马组织中NO-cGMP信号通路的影响*
王 薇,贾 蓉,沈琴琴,薛文达**
(1.南京中医药大学基础医学院转化系统生物学和神经科学研究中心/中医脑病重点实验室 南京210023;2.南京中医药大学心理学院 南京 210023;3.南京中医药大学第一临床医学院 南京210023;4.南通大学神经再生协同创新中心 南通 226001)
抑郁症是一种复杂的情感障碍,常伴有自杀倾向而导致高死亡率和致残率[1],不利于个人的健康和社会的稳定。其发病机制复杂多元,具体的病因现在仍然不是十分清楚。临床和动物实验数据都证明谷氨酸参与了抑郁样行为,阻断NMDA受体能够产生抗抑郁作用[2]。此外,药物阻断NMDA受体如氯胺酮能够产生很好的抗抑郁作用[3]。与之相类似,高剂量的选择性5-羟色胺重摄取抑制剂(Selective Serotonin Reuptake Inhibitor,SSRI)抗抑郁类药物也能够对NMDA受体活性产生影响[4]。研究还发现抑郁症自杀者死后的脑组织中存在N-甲基-D-天冬氨酸(N-methyl-D-aspartate,NMDA)受体系统异常现象[5]。目前临床上用于治疗抑郁症的药物大多起效缓慢、作用有限并且长期服用有毒副作用。近年来,氯胺酮的快速持久抗抑郁作用及其相关机制研究已成为抗抑郁药物研究的热点[6,7]。但是氯胺酮的成瘾性、神经毒性等副作用限制了其临床应用。中医药治疗抑郁症经验丰富,方药众多,副作用小。其中,越鞠丸出自《丹溪心法》,是治疗郁证的经典方。由于抑郁症与郁证具有相似性,因而越鞠丸也被广泛应用于现代抑郁症的治疗[8]。前期研究发现,越鞠丸具有与氯胺酮相似的快速起效的抗抑郁作用[9,10]。我们在小鼠模型上的实验结果显示越鞠丸和氯胺酮的快速抗抑郁作用需要NMDA信号的参与[11],如NMDA受体NR1的表达下降[12]。然而越鞠丸的抗抑郁作用是如何通过NMDA信号通路的仍然不清楚。
研究表明NO-cGMP信号通路参与了抗抑郁药物的作用,NMDA受体的激活能够降低NO合成酶(nitric oxide synthase,NOS)的活性,从而降低从L-精氨酸转变为NO的合成[13,14],并引起细胞中cGMP含量升高[15]。给予氯胺酮可降低小鼠海马组织中cGMP含量,提示NO-cGMP信号通路参与了氯胺酮的抗抑郁机制[16]。NO作为神经系统中重要神经递质分子在抑郁症研究中越来越受到重视,有研究显示大鼠海马脑区NO水平的降低可产生抗抑郁效应[17]。NO能够靶定多个基因,如可溶性鸟苷酸环化酶(soluble guanylate cyclase,sGC),能够转化鸟苷-5′-三磷酸(guanosine 5-triphosphate,GTP)为环鸟苷酸(cyclic guanosine 3,5-monophosphate,cGMP)[18],从而调控下游信号通路,参与抗抑郁药物的作用。NO作为神经递质参与中枢神经系统的递质如血清素的释放[19],包括痛觉,突触可塑性等,参与了抑郁症的发生过程。抑制NOS的活性能够增强SSRI类药物的抗抑郁作用[20]。近年研究也发现,降低NO水平与抗抑郁作用密切有关,从而支持了NO是参与了抑郁症的重要分子[21]。NO是cGMP的有效调节者,而cGMP参与了抑郁症的发生[22]。因此,NO-cGMP信号通路是参与调控抑郁样表型的重要通路[23]。因此越鞠丸是如何通过影响NMDA受体,从而调控NO-cGMP信号通路是亟需要探索的问题。
本研究拟采用ELISA法检测单次给予越鞠丸后小鼠海马组织中NO和cGMP含量的动态变化,并通过行为学测试来分析NO合成底物L-精氨酸(L-arg)对越鞠丸抗抑郁作用的影响,以探讨越鞠丸对NO-cGMP信号通路的作用影响。
1 材料与方法
1.1 实验动物
SPF级昆明小鼠,雄性,7-8周龄,体重为20-25 g,购自南京市青龙山动物繁殖场(动物合格证号:SCXK(苏)2014-0002)。实验前小鼠适应饲养环境1周,屏障间环境温度22-24℃,湿度40%-60%,昼夜交替时间12 h,动物可自由摄食饮水。
1.2 实验药物
实验用所用中药材购自南京中医药大学国医堂门诊部药房。越鞠丸由苍术100 g、神曲100 g、香附100g、栀子100 g、川芎100 g组成,将药材打粉后过筛混匀。将药粉浸泡于95%乙醇(6倍体积)中,静置48 h后收集上清液,重复2次,收集3次获取的上清液,过滤,于55℃减压浓缩,获得醇提越鞠丸。药物制备好后于-20℃保存备用。临用前用生理盐水配制成所需浓度。
1.3 实验试剂
本 实验 所用 NO(JEB-12547)和 cGMP(JEB-12702)ELISA试剂盒购自南京金益柏生物科技公司。L-arg购自阿拉丁试剂公司(货号:N109208),临用前用生理盐水配制成浓度为750 mg·kg-1的药液[24]。
1.4 ELISA法测定NO和cGMP的含量
小鼠分为两组:空白对照组和越鞠丸给药组。给药组动物按越鞠丸浓度13.5 g·kg-1的剂量进行灌胃给药[8],分别于给药12 min,24 min,30 min,3 h,24 h后,取小鼠海马组织,液氮速冻后,于-80℃冰箱冻存备用。然后按试剂盒说明书进行操作,分别测定各组中NO和cGMP浓度。
1.5 行为学测试分析L-arg对越鞠丸抗抑郁作用的影响
实验小鼠分为4组:空白对照组、L-arg给药组、越鞠丸给药组、L-arg+越鞠丸给药组。其中,空白对照组:小鼠腹腔注射生理盐水;L-arg给药组:小鼠腹腔注射L-arg 30 min后注射生理盐水;越鞠丸给药组:小鼠腹腔注射生理盐水30 min后灌胃给予越鞠丸;L-arg+越鞠丸给药组:小鼠腹腔注射L-arg 30 min后灌胃给予越鞠丸。以上4组实验动物最后1次给药30 min后进行行为学测试。
由于本实验采用急性给药方式,因而采用悬尾测试方法来分析L-arg对越鞠丸抗抑郁样行为的影响。测试前将小鼠提前放入测试房间30 min以适应环境。悬尾测试如下:将小鼠尾部粘贴在钩子上,倒挂在测试箱中,测试时间为6 min,记录后4 min内小鼠的累计不动时间。采用ANY-maze软件进行小鼠的轨迹分析。
开场测试(Open Field Test,OFT):将小鼠放入方箱(40 cm*40 cm)内的底面中心,进行5 min的观察和摄像。记录在5 min内小鼠的总活动路程和在中央区域的活动时间。采用ANY-maze软件进行小鼠的行为分析。
1.6 统计分析
所有数据均采用SPSS 19.0统计软件进行处理,数据均采用s表示。各组间两两比较采用t检验,两种药物处理数据间比较采用两因素方差分析(Two-Way ANOVA),事后检验(post hoc)采用 Bonferroni,P<0.05具有统计学意义。
2 结果
2.1 越鞠丸对小鼠海马组织中NO含量的影响
单次给予越鞠丸灌胃后,检测12 min,24 min,30 min,3 h,24 h这几个不同时间点的小鼠海马组织中NO的含量变化。检测结果显示给予越鞠丸12 min后,小鼠海马组织中的NO含量显著下降(P<0.05),给药后24 min出现显著上升(P <0.05),之后的30 min、3 h、24 h后NO含量与对照组相比都没有明显差异(图1)。
2.2 越鞠丸对小鼠海马组织中cGMP含量的影响
由于NO可以调节胞内cGMP含量,因此我们在单次给予越鞠丸灌胃后,检测 12 min、24 min、30 min、3 h、24 h这几个不同时间点的小鼠海马组织中cGMP的含量变化。结果显示单次给予越鞠丸12 min后,小鼠海马组织中的cGMP含量与NO含量变化趋势一致,也出现了显著下降(P<0.05),给药后24 min出现显著上升(P<0.05),之后的3个时间点cGMP含量给药组与对照组相比没有显著差异(图2)。
2.3 L-arg对越鞠丸抗抑郁样行为的影响
上述结果显示越鞠丸能够快速调节胞内NO含量,为了进一步确认NO信号通路参与越鞠丸抗抑郁作用。我们采用NO合成的前提L-arg预先给药处理,检测是否能够阻断越鞠丸的抗抑郁作用。悬尾测试结果显示,与对照组相比,单次给予越鞠丸,能够显著减少小鼠的不动时间(P<0.01),与越鞠丸组相比,预先给予L-arg则能够显著增加小鼠的不动时间(P<0.01),另外,与对照组相比,单独给予L-arg后小鼠不动时间无明显变化(图3A),提示单独给予L-arg不能产生抗抑郁作用。

图1 单次给予越鞠丸后不同时间点的小鼠海马组织中NO的含量变化
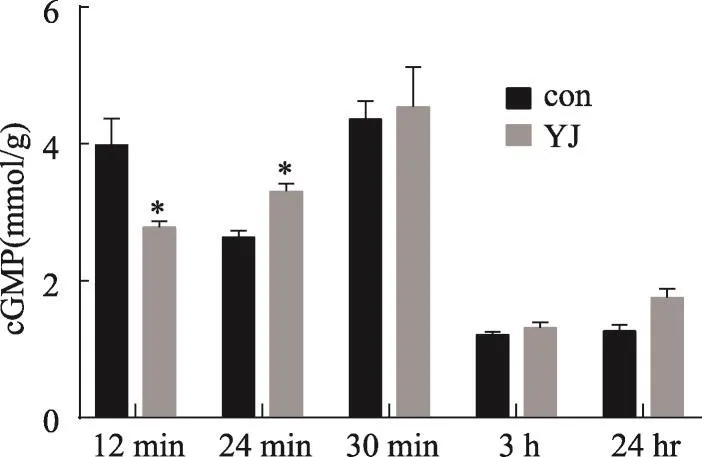
图2 单次给予越鞠丸后不同时间点的小鼠海马组织中cGMP的含量
为了检测越鞠丸或者L-arg对小鼠自发活动是否具有影响,我们检测了单独给药和联合用药后的开场行为。在开场测试中发现,无论是单独给予越鞠丸或L-arg,还是联合给药都不能够改变小鼠的自发活动性,显示药物具有真实的抗抑郁作用(图3B)。
3 讨论

图3 预处理L-arg对于越鞠丸抗抑郁作用的影响
本研究基于越鞠丸快速抗抑郁是与NMDA受体通路有关,探索越鞠丸调节胞内NMDA受体下游的NO和cGMP小分子变化,通过不同时间点的检测发现越鞠丸快速降低了小鼠海马组织的NO和cGMP含量,从而引起下游分子信号的变化,产生快速抗抑郁作用。进一步通过预先给予NO合成前体L-arg,结果发现能够阻断越鞠丸的抗抑郁作用,并且对于小鼠的自发活动没有影响,证实了越鞠丸的抗抑郁作用依赖于NO-cGMP信号通路。
近年来,快速抗抑郁的药物逐渐成为抑郁症治疗的研究热点,其中,氯胺酮是这类抗抑郁药物的典型代表。氯胺酮是一种NMDA受体拮抗剂,单次剂量的氯胺酮便能迅速改善抑郁症病人的抑郁症状[25]和抑郁小鼠的抑郁表型。唐娟娟等研究表明,与氯胺酮相比,越鞠丸可降低前额叶中NR1表达增强,且持续时间更长。夏宝妹等研究显示,越鞠丸可持久降低获得性无助模型动物的海马组织中NR1表达水平的升高。这些研究也提示NMDA受体(尤其是NR1)作为越鞠丸快速持久抗抑郁的靶向分子。NMDA受体可从上游调控NO-cGMP信号通路,即突触前膜释放的谷氨酸作用于NMDA受体,钙离子内流后结合钙调蛋白,激活NO合成酶,催化L-arg合成NO,进而NO激活鸟苷酸环化酶,增加cGMP的合成。NO作为一种重要的新型神经递质分子,参与多种生理生化过程,其与血管通透性、神经元兴奋性、神经突触可塑性有密切关系[26]。如果NMDA受体被过度激活,则会生成过量的NO,从而增加对神经元的毒性作用。张洪燕等研究发现血浆NO浓度与抑郁症状显著相关[27]。Joca等研究显示大鼠海马组织中NO浓度的降低可产生抗抑郁作用。而Yazir等研究也显示抑制NO合成酶和鸟苷酸环化酶可抑制慢性抑郁的形成[28]。本研究中首次揭示单次给予越鞠丸后12 min时,越鞠丸给药组与空白对照组相比,显著下调了NO浓度,随后在24 min时出现了恢复性的增加,之后趋于平稳,提示越鞠丸通过快速下调NO浓度产生抗抑郁作用,系统揭示了越鞠丸调控海马组织中NO浓度的动态变化过程。空白对照组在不同时间点也出现了NO含量的增加和恢复,这可能与受到了给药这一过程的刺激因素有关,朱东亚等研究显示应激能够引起胞内NO含量的增加[29],这与本研究的结果也是相一致的。
以往研究认为NO-cGMP信号通路参与了抑郁症的发病机制[30]。cGMP可被G蛋白偶联受体激活的蛋白激酶活化,继而将信息从胞外传递至细胞核。cGMP可改善血管重塑,并在神经信号传递、细胞凋亡等方面具有重要作用[31]。果木素(frutalin)的抗抑郁作用依赖于NO-cGMP信号通路[32]。抑郁症病人研究中也发现NO含量的增加,与之变化相一致的cGMP含量也显著增加了[33]。本研究发现,cGMP的浓度变化在越鞠丸处理后与NO的浓度变化是一致的,都在12 min时表达下降,在24 min时恢复性增加,随后恢复正常水平,提示两者的浓度变化可能都是越鞠丸的作用所引起的,而这一浓度水平的快速调整是越鞠丸引起快速抗抑郁作用的重要机制之一。
进一步,为了确证NO在越鞠丸抗抑郁中的关键作用,本研究通过在越鞠丸给药前预先给予NO合成的关键前体L-arg,L-arg由eNOS(血管内皮一氧化氮合酶)催化合成NO,NO从内皮细胞释放,用以响应刺激和旁分泌过程[34-35]。L-arg能够在小鼠强迫游泳测试中逆转锂盐和胍丁胺的抗抑郁作用,提示两者的作用依赖于NO信号通路[36]。此外,经典抗抑郁药物丙咪嗪[37]、文拉法辛[38]和锂盐[39]的抗抑郁作用都能够被L-arg所阻断。在本研究结果中也发现L-arg能够阻断越鞠丸的抗抑郁作用,说明越鞠丸的抗抑郁作用是依赖于NO-cGMP信号通路来发挥作用的。同时为了检测药物本身对小鼠自发活动的影响,在开场测试中也检测发现无论是L-arg还是越鞠丸或是二者联合用药都不能够对小鼠的自发活动产生作用,从另一个方面确立了越鞠丸抗抑郁作用及被L-arg阻断的真实性。
本研究通过系统检测越鞠丸处理后不同时间点小鼠海马组织中NO和cGMP浓度的变化,并利用NO合成前体L-arg预处理阻断越鞠丸的抗抑郁作用,探讨越鞠丸对小鼠海马脑区NO-cGMP信号通路的影响。下一步应继续研究cGMP调控的下游信号分子,如sGC、nNOS、eNOS等的变化,进一步深入分析越鞠丸发挥快速持久抗抑郁作用的分子机制,为其临床应用提供理论依据。