乳腺癌肿瘤出芽与肿瘤浸润淋巴细胞及患者预后的关系研究*
曲少华, 张 杰, 张 伟, 黄炎华, 张 清, 王宁霞, 吕荣钊△
(1暨南大学附属第一医院乳腺外科, 广东 广州 510630; 2广东省妇女儿童医院生殖中心, 广东 广州 511442)
乳腺癌是我国女性最常见的恶性肿瘤之一,其发病率逐年升高,已成为威胁我国女性生命的罪魁祸首。目前,临床上判断乳腺癌患者预后及制定治疗方案的指标主要有临床病理指标及分子指标等,但是,由于乳腺癌异质性的存在,这些指标均不能完全准确地反应患者预后。因此,研究并丰富新的生物学指标,成为实现个体化精准治疗和改善患者预后的关键[1]。
肿瘤出芽是指在肿瘤浸润最深处散在分布于间质内的单个孤立的癌细胞或少于5个癌细胞组成的癌巢[2],具有上皮-间充质转化(epithelial-mesenchymal transition, EMT)和肿瘤干细胞的特性,并且被认为是恶性肿瘤转移的早期阶段,对于肿瘤的进展、复发和转移至关重要。然而,肿瘤出芽在乳腺癌中的研究较少,其与乳腺癌临床病理指标、肿瘤免疫微环境和预后之间的关系鲜少报道。乳腺癌肿瘤浸润淋巴细胞(tumor-infiltrating lymphocytes, TILs)作为肿瘤免疫微环境中的重要成分,与乳腺癌患者预后相关,并能预测乳腺癌新辅助化疗疗效,近年来成为研究热点。然而,肿瘤出芽与肿瘤免疫微环境中TILs之间的关系未知。本研究通过收集乳腺癌组织标本178例,探讨肿瘤出芽与乳腺癌临床病理特征、肿瘤免疫微环境中TILs及预后的关系,为乳腺癌诊治提供新的思路。
材 料 和 方 法
1 一般资料
收集2012年1月~2016年12月于暨南大学附属第一医院乳腺外科确诊的浸润性乳腺癌患者资料及肿瘤组织石蜡切片,排除双侧乳腺癌和浸润性微乳头状癌等少见类型、非乳腺癌死亡、失访、新辅助化疗、病例资料不完整及初诊时已有远处转移的患者,共178例用于本研究。所有患者均为女性,一般情况良好,Karnofsy评分均为80分以上。所有入组病例的临床病理资料完整,包括患者年龄、肿瘤大小、组织学分级、辅助治疗、分子分型及淋巴结转移情况等。随访均从术后第1天开始,中位随访时间是48个月(13~65个月),术后3年内每3个月复查1次,术后3~5年每6个月复查1次,5年后每12个月复查1次。随访信息通过电话随访或门诊随访获得。无病生存期(disease-free survival, DFS)定义为从随访开始至疾病复发、转移、进展或由于疾病进展导致死亡的时间;总生存期(overall survival, OS)定义为从随访开始至患者死亡的时间。
2 肿瘤出芽的判读
肿瘤出芽的判断根据既往文献报道[2-3],即散在分布于肿瘤浸润最深的间质内单个孤立的癌细胞或少于5个癌细胞组成的癌巢为肿瘤出芽;而肿瘤浸润最深的间质内未见单个癌细胞或癌巢则为无出芽。在显微镜(×200)下,选取5个肿瘤出芽最密集的视野,观察肿瘤出芽情况,其中单个视野中出芽最多的个数即为肿瘤出芽数。
3 肿瘤浸润淋巴细胞的水平检测及判读标准
所有肿瘤组织均用福尔马林固定,常规石蜡包埋制成蜡块,4 μm连续切片后进行苏木素-伊红(haematoxylin and eosin, HE)染色,由2位病理科医师按照Salgado等[4]的方法进行HE切片评估:在显微镜低倍视野下选定有代表性的切片,在200倍视野下评估并记录TILs数目,包括单核的淋巴细胞和浆细胞。TILs的水平以其占浸润性乳腺癌边界处的周围间质细胞的百分比来表示,而远离肿瘤边界、原位癌和正常乳腺小叶周围的淋巴细胞和浆细胞不计数。
4 统计学处理
所有数据资料应用SPSS 20.0统计软件进行统计学分析,采用2检验分析肿瘤出芽情况与临床病理特征和TILs之间的关系,Kaplan-Meier法绘制生存曲线,组间差异采用log-rank检验分析,绘制受试者工作特征(receiver operating characteristic,ROC)曲线确定临界(cut-off)值。以P<0.05为差异有统计学意义。
结 果
1 乳腺癌组织中肿瘤出芽及TILs浸润情况
为了研究乳腺癌组织中肿瘤出芽情况,我们首先通过绘制ROC曲线来确定肿瘤出芽数量的临界值,结果发现肿瘤出芽数目为10时,敏感性和特异性最好(AUC=0.754,P<0.001)。因此,以10为临近值,将肿瘤出芽数≤10个分为低肿瘤出芽组,将肿瘤出芽数>10个分为高肿瘤出芽组。据此标准,178例患者分为低肿瘤出芽组患者99例和高肿瘤出芽组患者79例,见图1。
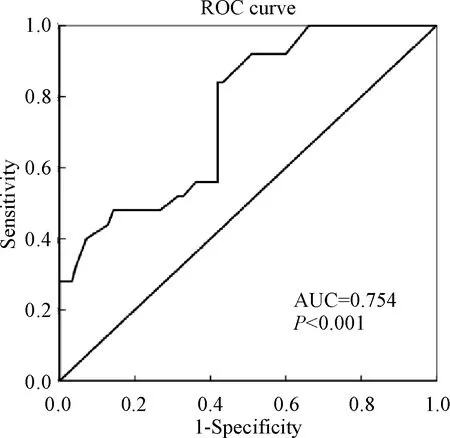
Figure 1.The cut-off of tumor budding defined by ROC curve (n=178).
图1ROC曲线判定肿瘤出芽临界值
根据Hida等[5]的方法将TILs的浸润程度分级,在显微镜低倍视野下选定有代表性的切片,评估TILs所占肿瘤细胞及周围间质细胞的比例:<50%为低TILs组,>50%为高TILs组。因此,178例患者中,87例为低TILs组,91例为高TILs组,见图2。
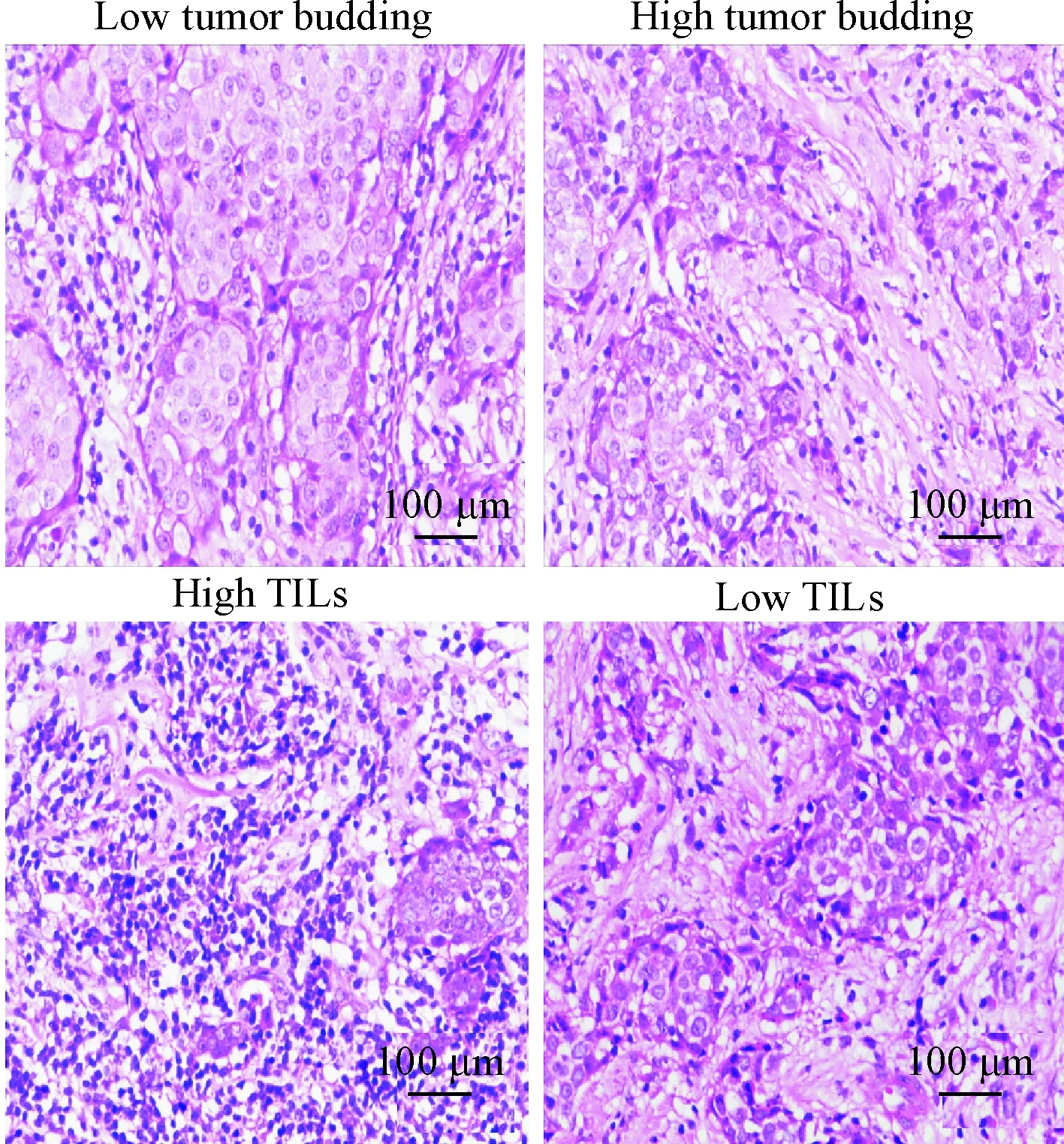
Figure 2.The expression of tumor budding and tumor-infiltrating lymphocytes in breast cancer patients.
图2肿瘤出芽和肿瘤浸润淋巴细胞在乳腺癌组织中的表达情况
2 乳腺癌肿瘤出芽情况与临床病理特征和TILs水平之间的关系
分析肿瘤出芽的水平与乳腺癌患者临床病理特征之间的关系,我们发现,高肿瘤出芽与淋巴结阳性、组织学分级高、脉管癌栓侵袭(lymphovascular invasion, LVI)及复发转移相关,而与年龄、肿瘤大小、Ki67和人类表皮生长因子受体2 (human epidermal growth factor receptor-2, HER-2)等无关,见表1。
进一步研究肿瘤出芽情况与TILs水平的关系,我们发现,肿瘤出芽的水平与TILs的水平呈反比,即肿瘤出芽数量多的患者其TILs的比例低,而肿瘤出芽数量少的患者其TILs的比例高,提示我们,肿瘤出芽与TILs负相关,见表2。
3 乳腺癌肿瘤出芽水平与患者预后的关系
经随访48个月之后,低肿瘤出芽组中有6人疾病进展(其中骨转移4人,肝转移2人),高肿瘤出芽组中有13人疾病进展(其中骨转移7人,肝转移3人,肺转移2人,脑转移1人)。应用Kaplan-Merier生存分析发现,低肿瘤出芽组无病生存率为91.7%,而高肿瘤出芽组无病生存率为86.3%,两组之间有显著的统计学差异(2=5.796,P=0.016),见图3A。此外,低肿瘤出芽组1人死亡,高肿瘤出芽组5人死亡,应用Kaplan-Merier生存分析发现,低肿瘤出芽组总生存率为97%,而高肿瘤出芽组总生存率为93.1%(2=4.362,P=0.037),见图3B。提示我们,低肿瘤出芽组的无病生存率和总生存率均高于高肿瘤出芽组。
表1肿瘤出芽与乳腺癌患者临床病理特征之间的关系
Table 1.Association between tumor budding and clinicopathologic features of breast cancer patients
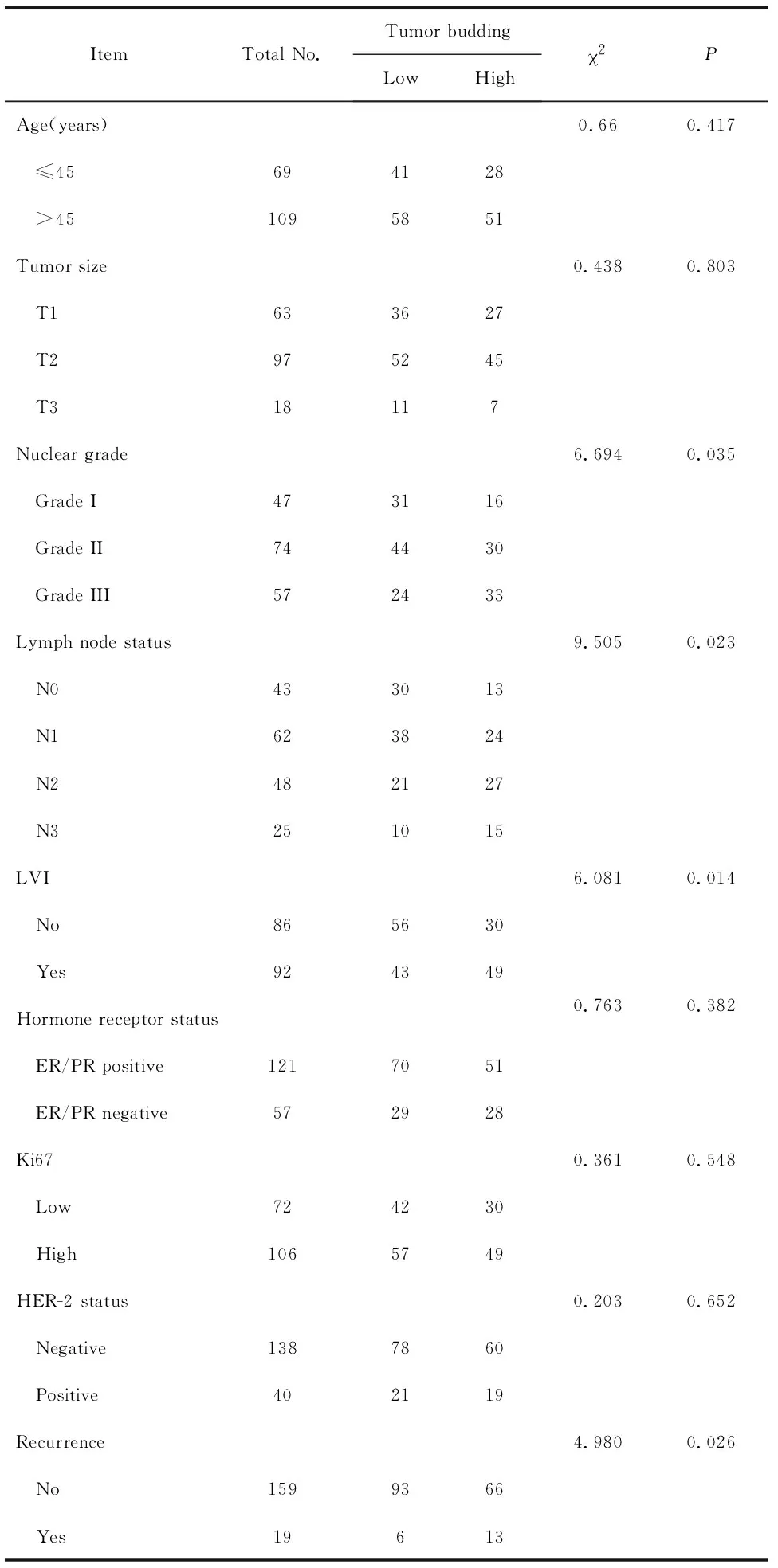
ItemTotal No.Tumor buddingLowHigh2PAge(years)0.660.417 ≤45694128 >451095851Tumor size0.4380.803 T1633627 T2975245 T318117Nuclear grade6.6940.035 Grade I473116 Grade II744430 Grade III572433Lymph node status9.5050.023 N0433013 N1623824 N2482127 N3251015LVI6.0810.014 No865630 Yes924349Hormone receptor status0.7630.382 ER/PR positive1217051 ER/PR negative572928Ki670.3610.548 Low724230 High1065749HER-2 status0.2030.652 Negative1387860 Positive402119Recurrence4.9800.026 No1599366 Yes19613
表2肿瘤出芽与肿瘤浸润淋巴细胞之间的关系
Table 2.Association between tumor budding and tumor-infiltrating lymphocytes
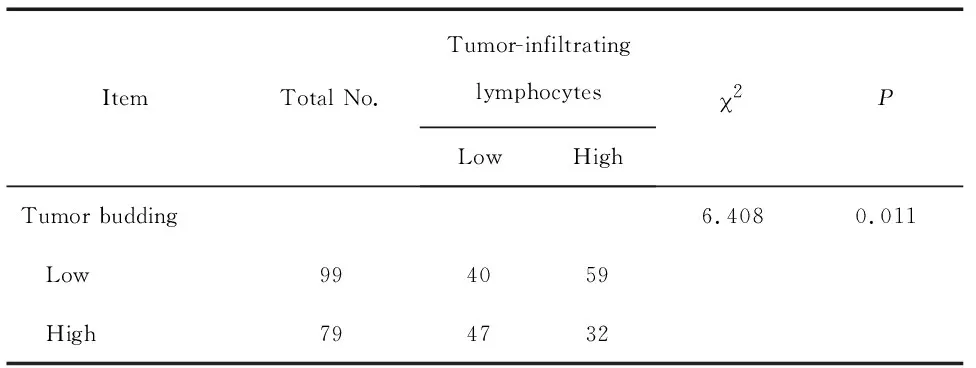
ItemTotal No.Tumor-infiltratinglymphocytesLowHigh2PTumor budding6.4080.011 Low994059 High794732
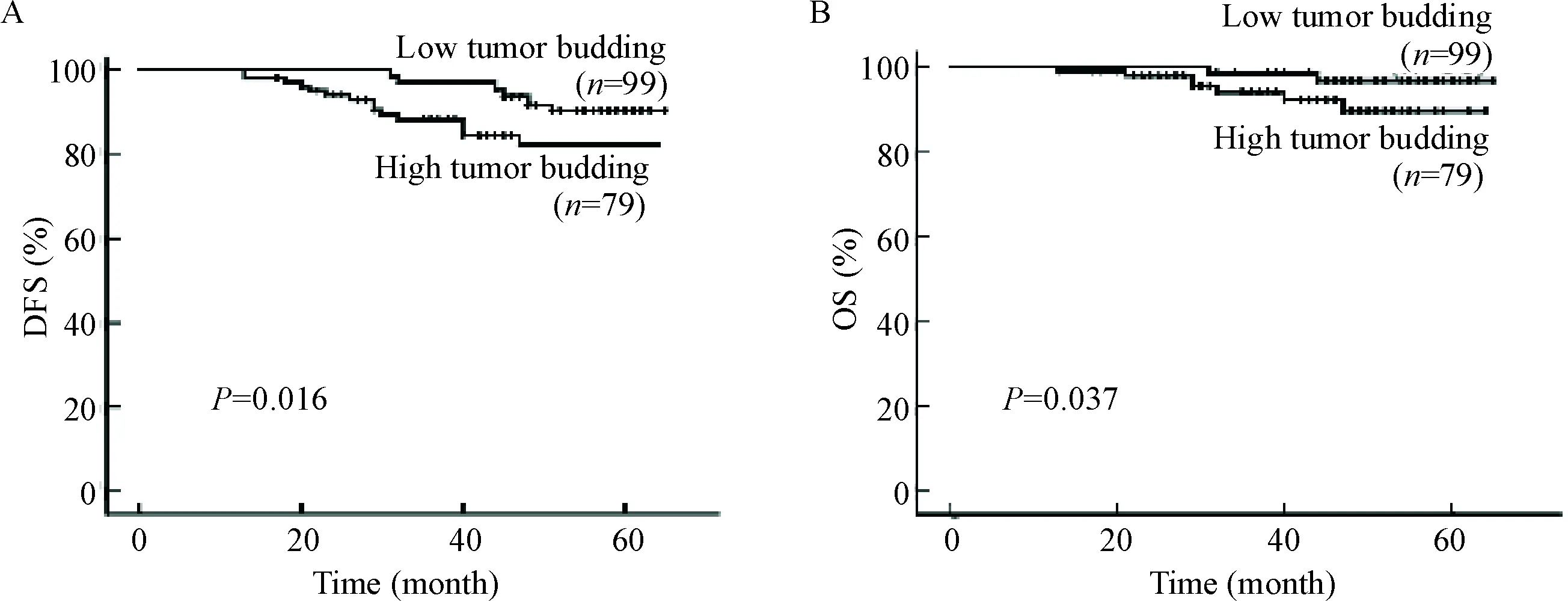
Figure 3.Kaplan-Meier survival curves (Log rank) of disease free survival (A) and overall survival (B) according to the tumor budding levels.
图3肿瘤出芽水平与乳腺癌患者无病生存率和总生存率的关系
讨 论
本研究分析肿瘤出芽水平与乳腺癌患者临床病理特征及患者预后之间的关系,结果发现乳腺癌肿瘤出芽较高的患者,淋巴结分级高,组织学分级高,脉管癌栓浸润较多,远处转移较多,预后较差。在此基础上,本课题进一步研究肿瘤出芽与免疫微环境中TILs的关系,结果发现,肿瘤出芽水平与肿瘤浸润淋巴细胞的水平呈负相关,提示我们肿瘤出芽与肿瘤免疫微环境之间可能存在复杂关系,肿瘤出芽与肿瘤浸润淋巴细胞可能相互作用,进而影响乳腺癌患者预后。
肿瘤出芽是分布在肿瘤间质内的单个肿瘤细胞或小于5个肿瘤细胞组成的癌巢。既往研究证实,肿瘤出芽与结直肠癌、鼻咽癌和膀胱癌等的预后相关[6]。肿瘤出芽是上皮-间充质转化的早期阶段,且具有迁移和侵袭的特性,在肿瘤转移过程中发挥重要作用。而转移是由多种细胞因子和信号通路协同,细胞内外微环境共同作用及多个环节参与的复杂过程。有研究者提出的“种子与土壤学说”,将出芽的肿瘤细胞看作是“种子”,“种子”进入血管,遇到适合的“土壤”时发生种植,形成远处转移灶。而肿瘤出芽在乳腺癌中的研究相对较少,仅有少数文章报道肿瘤出芽与乳腺癌临床病理特征及患者预后之间的关系,且研究结论却并不一致。Salhia等[7]研究发现,在ER阳性乳腺患者中,肿瘤出芽与淋巴结转移相关,而在三阴乳腺癌患者中,肿瘤出芽与淋巴结转移无相关。Li等[8]研究发现,乳腺癌肿瘤出芽与远处转移及淋巴结转移相关,与年龄和肿瘤大小等无关。Liang等[9]研究发现,乳腺癌肿瘤出芽与肿瘤大小较大、脉管浸润和总生存率有关,而与淋巴结转移、组织学分级、HR及HER2无关。Gujam等[10]发现,乳腺癌高肿瘤出芽与ER阳性状态、淋巴结转移及脉管癌栓有关,而与肿瘤大小、组织学分级和Ki67无关;在Luminal B型、三阴型和HER2阳性型乳腺癌患者中,高肿瘤出芽与患者预后较差相关,而在Luminal A型乳腺癌中,肿瘤出芽与预后无关。本研究通过收集178例乳腺癌患者病例资料及HE病理切片,发现肿瘤出芽与淋巴结分级高、组织学分级高、脉管癌栓多及远处转移有关,而与患者年龄、肿瘤大小、激素受体和HER2无关,提示我们,肿瘤出芽与乳腺癌恶性进展有关。
既往鲜有研究报道肿瘤出芽与乳腺癌患者预后的关系[7, 9],且乳腺癌肿瘤出芽的评估方法并不一致。Gujam等[10]采用半定量的方法来判读乳腺癌肿瘤出芽的高低,而Li等[8]则根据肿瘤出芽的平均值来判定肿瘤出芽的水平,分析肿瘤出芽的水平与患者预后的关系。在本研究中,我们观察常规HE染色切片中肿瘤出芽读数,以OS为研究终点,绘制ROC曲线,发现肿瘤出芽数为10时,敏感性和特异性最好,并以此为界判定肿瘤出芽水平的高低。应用Kaplan-Merier生存分析, log-rank检验绘制生存曲线,发现高肿瘤出芽与乳腺癌患者预后较差有关,由此推测肿瘤出芽可成为预测乳腺癌患者预后的新指标。
近年来,肿瘤免疫微环境及免疫治疗因其在抗肿瘤治疗中的潜在作用而受到越来越多的关注。其中,间质内的肿瘤浸润淋巴细胞是肿瘤免疫微环境中的重要成分,是机体应对肿瘤细胞和诱导肿瘤免疫应答的重要机制,TILs的数量能够在一定程度上反应机体对抗肿瘤的能力。IBCSG 22-00、BIG 2-98、FinHER、ECOG 2197,ECOG 1199及NEAT/BR9601等大型临床研究均证实,TILs可改善乳腺癌无复发生存率[11]。Denkert等[12]证实,TILs可预测接受蒽环类和紫杉类新辅助化疗的疗效和患者预后,并且是病理完全缓解率PCR的预测因子。
那么,乳腺癌肿瘤出芽与肿瘤免疫微环境中TILs两者之间的关系如何呢?Lugli等[3]发现,CD8+T淋巴细胞与肿瘤出芽的比值是结直肠癌患者预后的独立预测因素。Zlobec等[13]发现,在结直肠癌中,TILs的数量与肿瘤出芽的数量呈明显负相关,并认为TILs与肿瘤出芽相互作用,改善结直肠癌患者预后。在本研究中,我们发现,肿瘤出芽的水平与TILs的数量呈相反趋势,肿瘤出芽数量少的患者TILs较多,预后较好;而肿瘤出芽数量多的患者TILs较少,预后较差,提示我们乳腺癌肿瘤出芽与TILs相互作用,调控乳腺癌的发展,影响患者预后。然而,肿瘤出芽与TILs之间相互关系及相互作用机制的尚未阐明。既往研究发现,在肿瘤出芽和EMT的过程中伴随着肿瘤免疫微环境的变化,如产生抗肿瘤免疫应答的细胞因子,如转化生长因子β(transforming growth factor-β,TGF-β)和白细胞介素10(interleuk-in-10,IL-10)等;而肿瘤微环境中的缺氧因子、代谢产物和炎症因子等在诱导肿瘤出芽的形成、EMT及转移灶的种植过程中发挥重要作用[14]。Chen等[15]研究发现,microRNA-200能够在抑制EMT的同时促进TILs免疫应答,从而抑制非小细胞肺癌的进展。提示我们肿瘤出芽与TILs之间可能通过细胞因子、microRNA、炎性因子等联系起来,但具体的作用机制仍需深入研究。
综上所述,本研究发现乳腺癌肿瘤出芽水平与TILs呈负相关,证实了肿瘤出芽与乳腺癌临床病理指标及预后的关系,为乳腺癌诊治提供潜在的生物学指标,丰富了抗肿瘤免疫治疗的依据。但值得注意的是,肿瘤出芽和TILs的判读尚缺乏统一标准,因此,两者能否作为临床常规检测指标应用于临床工作仍需更多的研究。

