Taurine、EGCG和genistein联合对体外活化肝星状细胞自噬的影响*
宋鹏书, 潘火珍, 廖 明, 2△
(广西医科大学 1生命科学研究院, 2区域性高发肿瘤早期防治研究教育部重点实验室, 广西 南宁 530021)
肝纤维化是慢性肝损伤中组织修复过程的代偿性反应,其最终结果是肝硬化甚至肝癌,在全球有很高的发病率和死亡率[1]。肝纤维化的主要病理特征是以胶原为主的细胞外基质(extracellular matrix,ECM)在肝组织内的过度合成和异常沉积,活化的肝星状细胞(hepatic stellate cells, HSCs)分化为成纤维母细胞,产生大量的细胞外基质[2]。因此,抑制HSCs的增殖,促进HSCs死亡成为抗肝纤维化治疗的核心问题。
自噬是一种保守的细胞自我降解方式,是通过溶酶体吞噬自身胞质或细胞器达到细胞内营养和能量再利用的过程。自噬在治疗肝纤维化方面是一把双刃剑,研究发现自噬既具有抗肝纤维化的作用同时也会促进肝纤维化的形成[3]。如对于脂肪性肝纤维化早期,自噬能促进脂滴的代谢,有抑制肝纤维化的作用;对于HBV和HCV 引起的肝纤维化,HBV和HCV 能够利用自噬增强复制,促进肝纤维化的发生[4]。
有研究表明HSCs活化与自噬有关,抑制HSCs自噬可以减轻肝纤维化[5]。Nazim等[6]发现三羟基异黄酮(genistein)可通过抑制自噬通量增强TRAIL-诱导的A549腺癌细胞死亡;Zhang等[7]发现牛磺酸(taurine)通过抑制ARPE-19细胞自噬对其存活具有保护作用;Li等[8]发现表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)预处理可抑制伴刀豆球蛋白A诱导的肝炎中的肝细胞凋亡和自噬。我们研究发现taurine、EGCG和genistein联合用药能明显抑制HSCs的增殖并促进HSCs的凋亡[9-11],并且比单一用药具有更显著的抗肝纤维化的作用。但联合用药是否通过抑制细胞自噬达到抗肝纤维化的作用尚未明确。为此,本实验联合以上3种药物处理活化的HSCs,观察细胞内自噬体和相关生物学变化,探讨联合用药抗肝纤维化作用与自噬的关系,以期为联合用药应用于临床打下基础,并为肝纤维化的治疗提供新的思路。
材 料 和 方 法
1 材料
1.1细胞与试剂 HSC-T6细胞为活化的HSCs, 具有纤维化特性,由广西医科大学姜海行教授馈赠。牛磺酸(批号Q/C5411196-9)购自成都科龙化工试剂厂;EGCG(批号 TP1110001P)购自四川乐山禹伽茶业科技开发有限公司;三羟基异黄酮(批号 M11111601)、吖啶橙(acridine orange,AO)、巴弗洛霉素A1(bafilomycin A1, Baf-A1)和二甲基亚砜购自Sigma;胰蛋白酶购自北京索莱宝公司;兔抗鼠LC3和beclin-1单抗隆抗体购自CST;兔抗鼠GAPDH多克隆抗体和兔抗鼠β-actin多克隆抗体及BCA蛋白定量试剂盒购自武汉博士德生物工程有限公司;山羊抗兔荧光 II 抗购自LI-COR;CCK-8试剂盒购自MedChem Express。
1.2仪器 蛋白电泳仪和蛋白质转膜仪(Bio-Rad);Odyssey 红外荧光扫描成像系统(LICOR);全自动荧光倒置显微镜系统(EVOS FL auto);透射电子显微镜(Hitachi)。
2 方法
2.1HSC-T6细胞的培养和分组 HSC-T6细胞培养在高糖DMEM培养基中(含10%胎牛血清),于37 ℃、5% CO2培养箱中培养。每2 d更换 1 次培养基,待细胞长满培养瓶80%左右,使用含有EDTA的0.25%的胰酶消化传代继续培养。实验分为4组:即对照(control)组(完全培养基)、联合药物(taurine+EGCG+genistein,TEG)组(256 mg/L taurine、 45 mg/L EGCG和10 mg/L genistein)、Baf-A1组(0.5 μmol/L Baf-A1)和TEG+Baf-A1组(浓度同上)。
2.2CCK-8法检测细胞存活率 胰酶消化HSCs,制成密度为5×107/L的细胞悬液接种于96孔培养板中,每孔100 μL,各组4×6孔。四周一圈孔内加入100 μL PBS,37 ℃、5% CO2培养箱培养;接种24 h细胞贴壁后,取出96孔培养板,吸出培养基,各组分别加入100 μL相应浓度的TEG、Baf-A1和TEG+Baf-A1,细胞培养基。继续培养24 h后,把96孔培养板中各组液体全部吸出,将CCK-8试剂与完全培养基按体积比1∶9配置成反应液,混匀后加入孔内,另取6个未接种细胞的孔,也加入100 μL反应液,作为空白对照,37 ℃、5% CO2培养箱培养;孵育1~2 h后,取出96孔培养板,用酶标仪检测450 nm处的吸光度(A)值。每次实验均采用不同样本重复3 次。
2.3透射电子显微镜观察自噬体 胰酶消化细胞,低速离心收集细胞,经缓冲液冲洗后向细胞沉淀中加入3%戊二醛缓冲固定液固定2 h,缓冲液冲洗,向样品中加入2%四氧化锇缓冲固定液进行后固定;用梯度乙醇对样品进行梯度脱水;丙酮置换样品中乙醇,然后进行环氧树脂渗透,包埋,聚合,切片,染色,在透射电子显微镜下观察细胞中自噬体变化。
2.4吖啶橙染色观察自噬溶酶体 胰酶消化收集HSCs,调整细胞浓度约为1×108/L。取6孔板每孔分别加入盖玻片后,取4个孔分别加入2 mL细胞悬液。24 h后,吸出培养基,各组分别加入2 ml TEG、Baf-A1和TEG+Baf-A1,细胞培养基,继续培养24 h后,取出细胞爬片,用PBS洗涤3次。用95%乙醇固定15~30 min, 再用1%醋酸作用30 s; 马上加入0.2 g/L吖啶橙染色30~60 s;继续加入0.1 mol/L CaCl2处理2 min, 再用PBS漂洗3次;最后用甘油封片在倒置荧光显微镜下观察HSCs内部自噬溶酶体的变化,实验重复3次。
2.5Western blot检测LC3-II和beclin-1的表达 将HSCs分4组接种在60 mm培养皿中培养24 h至贴壁,更换培养基加入TEG、Baf-A1、TEG+Baf-A1和完全培养基继续培养24 h,进行细胞总蛋白提取和测定。弃掉培养基,用无菌PBS 洗涤HSCs后按照博士德蛋白抽提试剂盒说明书,每个培养皿加入20 μL RIPA 和0.02 μL PMSF,用细胞刮收集细胞,冰上放置30 min,4 ℃、12 000×g,离心20 min,提取细胞总蛋白,应用BCA 法测定蛋白含量。热变性后,取40 μg 总蛋白上样进行SDS-PAGE,恒流120 mA转膜1.5 h。室温下5%脱脂奶粉匀速摇晃封闭1 h后,加入I抗[兔抗LC3A/B(浓度稀释1∶500)、兔抗beclin-1(浓度稀释1∶500)、兔抗β-actin(浓度稀释1∶500)和兔抗GAPDH(浓度稀释1∶300)],4 ℃孵育过夜,TBST洗膜后用对应种属的荧光 II 抗室温下孵育2 h。以目的蛋白和内参照的比值反映目的蛋白相对表达量。每次实验均采用不同样本重复3 次。
3 统计学处理
数据采用SPSS 22.0统计软件处理。实验重复3次,测定结果用均数±标准差(mean±SD)表示。多组间比较采用单因素方差分析(one-way ANOVA),各组间两两比较采用SNK-q检验,以P<0.05为差异具有统计学意义。
结 果
1 CCK-8法检测HSCs存活率的变化
给药24 h之后,TEG和Baf-A1对肝星状细胞的增殖均有不同程度的抑制作用。与对照组相比,TEG组和Baf-A1组细胞的存活率显著降低(P<0.05);与TEG组相比,TEG+Baf-A1组细胞存活率进一步降低(P<0.01),结果表明联合药物和自噬抑制剂都会抑制HSCs的细胞活力,见图1。
2 透射电镜观察HSCs内的自噬情况
通过透射电镜的观察发现HSCs中有双层膜的自噬体和单层膜结构自噬溶酶体,其中包裹变性坏死的细胞器和部分蛋白质,TEG组HSCs中的自噬溶酶体已经坏死,细胞自噬无法正常运行,说明TEG对细胞自噬具有抑制作用,见图2。
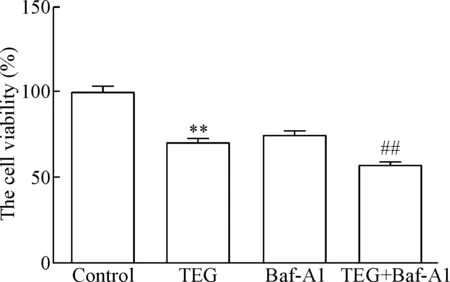
Figure 1.The viability of HSCs treated with TEG, Baf-A1, and TEG+Baf-A1. Mean±SD.n=3.**P<0.01vscontrol group;##P<0.01vsTEG group.
图1联合药物与自噬抑制剂对HSCs活力的影响
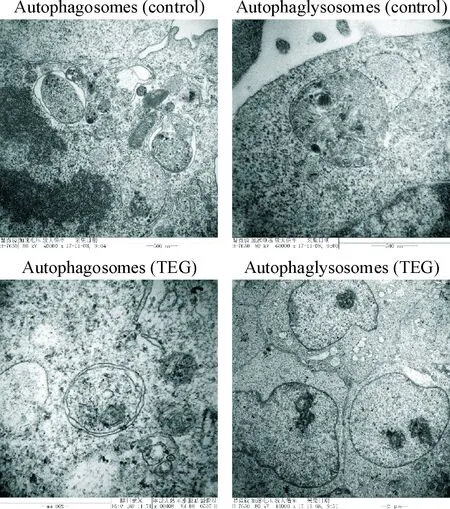
Figure 2.Transmission electron microscopy showed autophagosomes and autophagolysosomes in HSCs.
图2透射电镜观察各组HSCs内自噬体与自噬溶酶体的变化
3 吖啶橙染色观察TEG和Baf-A1分别作用HSCs后自噬溶酶体的变化
吖啶橙结合双链DNA时细胞核显示绿色荧光,而在低pH条件下与自噬溶酶体反应时发出红色荧光[12]。本实验发现,对照组中红色荧光区域格外明显,细胞形态完好,TEG组和Baf-A1组只有微弱的红色荧光,同时细胞暗淡,出现皱缩、变圆等不正常形态,见图3。
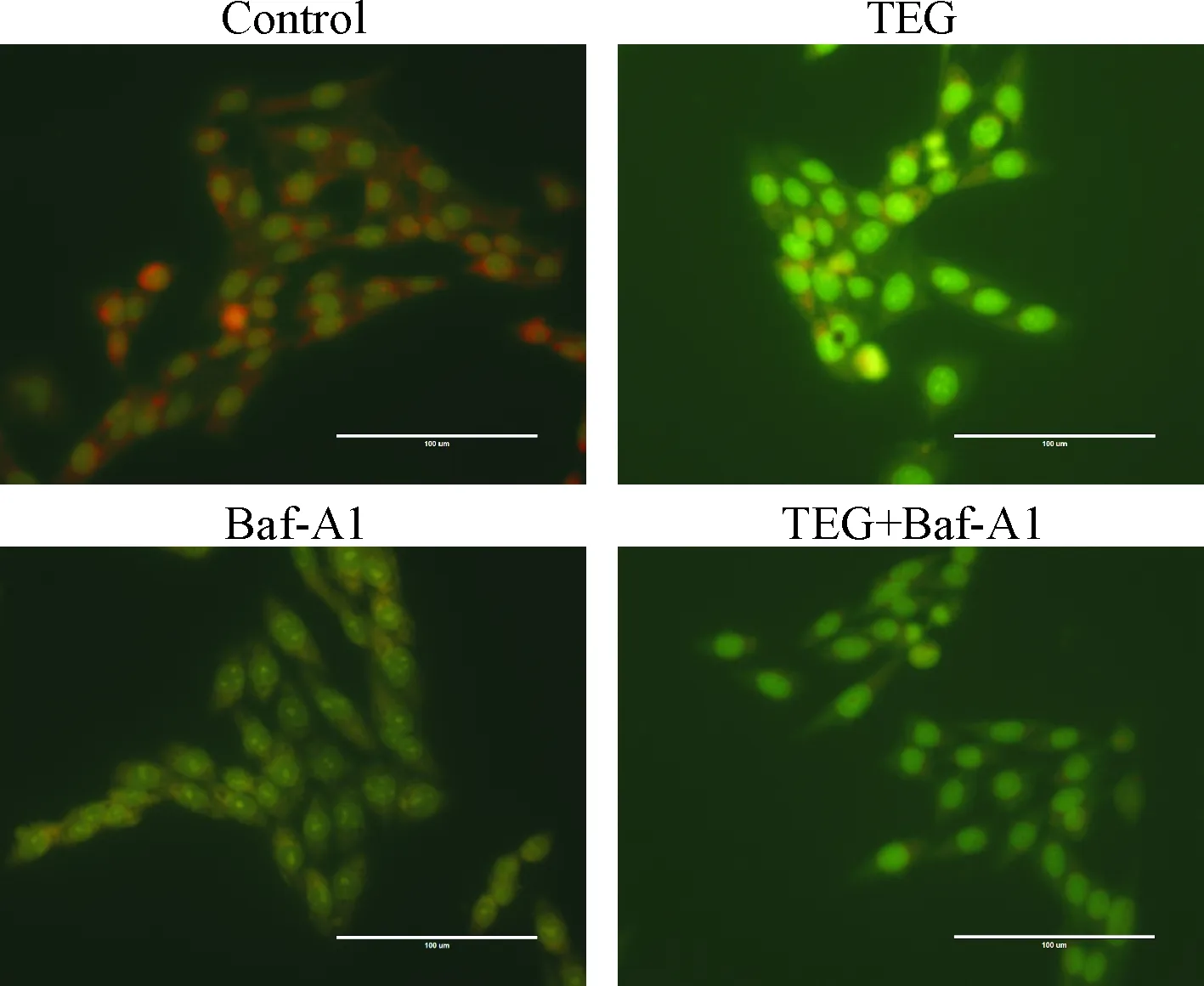
Figure 3.Effects of TEG and Baf-A1 on the autophagy of HSCs detected by fluorescence microscopy after acridine orange staining (scale bar=100 μm).
图3吖啶橙染色后荧光显微镜下观察HSCs自噬
4 Western blot检测TEG对HSCs中LC3-II和beclin-1表达的影响
TEG作用HSCs 24 h后,与对照组相比,TEG组中LC3-II的表达量显著降低;Baf-A1组中LC3-II的表达量却显著高于TEG+Baf-A1组; TEG+Baf-A1组LC3-II的表达量介于TEG组和Baf-A1组之间,推断TEG会抑制HSCs中自噬体合成。见图4。
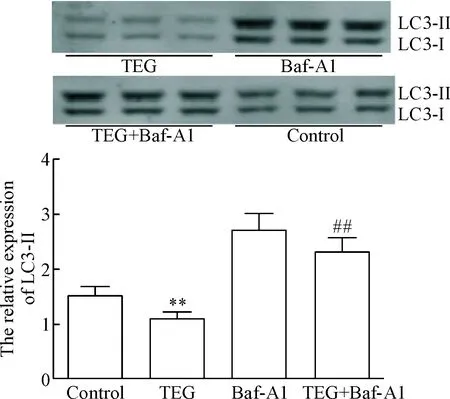
Figure 4.The protein levels of LC3-II in the HSCs treated with TEG, Baf-A1, and TEG+Baf-A1. Mean±SD.n=3.**P<0.01vscontrol group;##P<0.01vsTEG group.
图4TEG对肝星状细胞的LC3-II蛋白水平的影响
Western blot 法检测beclin-1结果显示, 与对照组相比,TEG组中beclin-1的表达量显著降低(P<0.05),说明TEG抑制HSCs中自噬体合成。见图5。
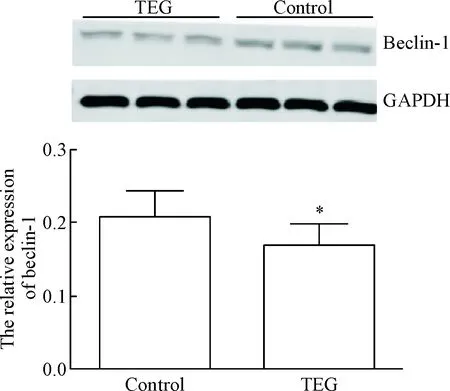
Figure 5.The protein levels of beclin-1 in the HSCs treated with TEG. Mean±SD.n=3.*P<0.05vscontrol group.
图5TEG对肝星状细胞的beclin-1蛋白水平的影响
讨 论
HSCs是肝纤维化的主要参与者,静止的HSCs被激活之后,导致以胶原为主要成分的细胞外基质大量沉积且降解相对不足, 在肝内过度沉积而引起肝纤维化[13]。HSCs活化与自噬有关,自噬有助于成纤维细胞内脂类的分解代谢来维持能量平衡同时更新某些细胞器[14],所以阻断自噬会抑制HSCs增殖,减轻肝纤维化。Denardin等[15]报道紫色扁樱桃提取物的抗肝纤维化作用可通过抑制的细胞自噬发生,从而引起活化的肝星状细胞死亡。
TEG中的3种药物均属于天然药物,经研究发现无论是单独还是联合使用的细胞毒性较低[16]。Taurine是人体内一种氨基酸,在细胞中发挥重要作用,如氧化应激、糖脂代谢、渗透压调节、抗炎和解毒等;EGCG是绿茶中的一种主要的多酚类物质,具有抗炎症和抗纤维化的作用;genistein是一种异黄酮类化合物,是酪氨酸蛋白激酶的抑制剂,酪氨酸蛋白激酶信号途径在肝星状细胞的增殖、激活过程中起重要作用;另有研究表明taurine、EGCG和genistein具有抑制细胞自噬作用[6-8]。
本课题组前期的研究表明,TEG能明显抑制HSCs的增殖并促进HSCs的凋亡[9-11],并且比单一用药更有显著的抗肝纤维化作用[17],但TEG抗肝纤维化作用的机理仍未明确。本实验用CCK-8法检测细胞活力的变化,结果显示TEG与自噬抑制剂Baf-A1均能抑制肝星状细胞的活力。为了研究TEG是如何通过阻碍细胞自噬间接抑制肝星状细胞活力,采用透射电镜和AO染色观察HSCs内部自噬变化,2种实验结果同时显示,对照组细胞出现明显自噬现象,经过TEG处理之后,发现细胞自噬溶酶体坏死且数量减少,说明细胞自噬进程受到阻碍,即从细胞的形态学可知TEG能阻断活化的HSCs自噬。
本实验进一步对TEG影响下HSCs自噬相关蛋白LC3-II和beclin-1进行分析,以探讨TEG抗肝纤维化与自噬的关系。LC3是广泛用于监测自噬的标志物,LC3存在2种转化形式分别为LC3-I和LC3-II,其中LC3-II附着在自噬体膜上,所以LC3-II的表达量与自噬体的数量成正相关。实验结果显示TEG处理细胞24 h之后,LC3-II的表达量显著降低,说明自噬体在TEG的影响下数量减少,即TEG会抑制自噬体的合成;同时LC3-II的量不能完全体现自噬体的数量,因为细胞自噬是一个连续的过程,自噬体生成之后需结合溶酶体生成自噬溶酶体,自噬体数量会相应减少。Baf-A1为自噬抑制剂,其机理为抑制自噬体与溶酶体融合,从而造成自噬体的堆积。因此,Baf-A1作用细胞后,LC3-II的量代表的是合成的自噬体和自噬溶酶体总量[18]。本实验结果显示,TEG+Baf-A1组LC3-II的表达量小于Baf-A1组,说明Baf-A1引起的自噬体堆积变小,其原因是TEG减少了自噬体的合成。Beclin-1也是细胞自噬的标志性蛋白,它参与自噬体的形成[19],本实验Western blot结果显示TEG处理细胞24 h之后,与对照组相比TEG组中beclin-1的表达量显著降低,说明TEG会降低自噬体的形成。

