慢性自发性荨麻疹患者外周血IL-35水平检测及其对血管内皮细胞VCAM-1的抑制作用
钱 青 高春岩 申宇鸿 宋世珅 于建秀 于月红
慢性自发性荨麻疹(chronic spontaneous urticaria,CSU)是一种常见的皮肤疾病,其特征是持续6周以上、反复出现皮肤风团伴瘙痒[1]。异常活化的肥大细胞(mast cells,MC)可释放组胺等炎症介质到组织和/或血管系统中,扩张血管及增加血管渗透性,导致血管内皮细胞高表达血管细胞黏附分子-1(vascular cell adhesion molecule,VCAM-1)等黏附分子,加重炎性反应[2]。近期研究表明,白细胞介素-35(Interleukin,IL-35)可发挥免疫抑制作用,但关于其对CSU患者血管内皮细胞VCAM-1的作用则缺乏研究。本次研究通过检测CSU患者外周血中IL-35与VCAM-1浓度;并经体外实验用CSU患者血清与肥大细胞共培养的上清液活化血管内皮细胞,分析IL-35对血管内皮细胞VCAM-1活化的抑制作用,探讨IL-35在慢性自发性荨麻疹疾病过程中的作用。
1 材料与方法
1.1 研究对象 选择2017年1月至2018年3月在北京市和平里医院新诊断的CSU患者30例,并收集30名体检中心体检人群作为健康对照组(HC)。纳入标准:根据2014年中国荨麻疹诊疗指南[3]收集CSU患者入组,并根据荨麻疹病情活动评分(Urticaria disease activity score,UAS)评估病情严重程度。排除标准:既往有其他皮肤过敏性疾病、高血压、糖尿病、肾脏疾病、慢性感染性疾病、肿瘤、自身免疫性疾病、服用抗组胺药物、凝血调节药物(如阿司匹林)等、近期服用免疫抑制剂或行抗感染治疗,合并其他病毒感染。两组患者年龄、性别均无统计学差异(P>0.05),具有可比性(见表1)。本研究经医院伦理委员会批准(批准号06/2017),征得参加者监护人知情同意。

表1 研究对象研究资料
1.2 仪器和试剂 异硫氰酸荧光素(FITC)-鼠抗人VCAM-1单克隆抗体(mAb)、红细胞裂解液及流式细胞分析仪均购自美国BD 公司。人肥大细胞(HMC-1)购自上海信裕生物科技公司。RPMI 1640培养液、M199培养液及胎牛血清(FBS)购自美国Gibco。细胞因子IL-35及sVCAM-1试剂购自美国Bio-rad公司。钙黄绿素购自美国Invitrogen公司。
1.3 方法
1.3.1 标本采集 患者治疗前采集静脉血3 mL,离心收集血清,储存在-80℃,用于检测IL-35、sVCAM-1浓度和体外实验。
1.3.2 根据UAS评估病情严重程度,皮肤风团直径<3 cm,数量<10个,0分;10~50个直径<3 cm的小风团或10个以下直径≥3 cm的大风团,1分;50个以上直径<3 cm小风团或者10~50个直径≥3 cm的大风团,2分;风团几乎累及全部躯体,3分。瘙痒程度:无瘙痒,0分;轻度瘙痒,1分;中度瘙痒,2分;重度瘙痒,3分。UAS评分总分为0~6分,0~2分为轻度,2~4分为中度,4~6分为重度。
1.3.3 外周血IL-35和sVCAM-1检测 对储存于-80℃的血清进行复溶,避免反复冻融,利用Luminex液相芯片检测IL-35和sVCAM-1浓度,每个标本检测3次,取均值。
1.3.4 肥大细胞培养上清液制备 用含10% FBS的RPMI 1640培养液重悬混匀HMC-1细胞,终浓度为2×105/mL,取500 μL接种于细胞培养板,每孔加入100 μL患者或健康对照者血清,在37℃、 5% CO2培养箱中培养24 h,收集上清液,用于体外实验。
1.3.5 人静脉血管内皮细胞培养 取健康孕妇分娩时的脐带,用0.25%胰蛋白酶分离人静脉血管内皮细胞(HUVECs),接种于含10%FBS的M199完全培养液中,置于37℃、5% CO2培养箱。待细胞长至80%融合状态后,选取第3代细胞用于实验。上述培养的HUVECs分5组:空白对照组(仅含RPMI 1640培养液)、健康人上清液组(HC)、CSU上清液组(CSU)、HC+IL-35组、CSU+IL-35组,HC及CSU上清液组加入20%(v/v) MC上清液,HC+IL-35、CSU+IL-35上清液组加入20 ng/mL IL-35和20%(v/v)MC上清液,培养24 h后,PBS洗涤二次,用于下一步实验。
1.3.6 预实验选择IL-35浓度 通过预实验选择IL-35实验浓度,IL-35终浓度分别为5 ng/mL、10 ng/mL、20 ng/mL、30 ng/mL、40 ng/mL与CSU培养上清液共培养(n=5),通过流式细胞术(FCM)检测各组内皮细胞VCAM-1表达。
1.3.7 流式细胞术检测HUVECs VCAM-1表达 上述细胞,用100 μL PBS缓冲液重悬,加入10 μL FITC-鼠抗人VCAM-1,室温环境下避光孵育30 min,PBS洗涤二次,并用400 μL PBS缓冲液重悬,流式细胞术检测HUVECs VCAM-1阳性百分率。
1.3.8 荧光检测单个核细胞黏附内皮细胞 抽取健康人外周血10 mL,采用Ficoll-Hypaque密度梯度离心法分离外周血单个核细胞(PBMCs),取白膜层,PBS洗涤二次,置37℃温育1 h,去除悬浮细胞,调整浓度至3×105/mL,加入5 μmol/L钙黄绿素,37℃温育30 min。上述经MC上清液和IL-35刺激培养的HUVECs,每孔加入钙黄绿素标记好的健康人PBMCs,37℃温育20 min。吸去上清及未黏附的细胞,PBS洗孔2次,荧光显微镜下拍照。最后,加入细胞裂解液裂解细胞,吸取裂解液,用荧光分光光度计测定荧光强度。
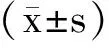
2 结果
2.1 CSU患者血清IL-35和sVCAM-1浓度检测 与HC组相比,CSU患者组血清IL-35浓度降低,差异有统计学意义(P<0.05)。与HC组相比,CSU患者组血清sVCAM-1浓度升高,差异有统计学意义(P<0.05)。见图1a、b。
2.2 CSU患者血清IL-35和sVCAM-1相关性分析 CSU患者血清IL-35和sVCAM-1浓度呈负相关(r=-0.5232,P=0.003)。见图2。
2.3 CSU患者血清IL-35和sVCAM-1与临床症状评分相关性分析 CSU患者血清IL-35浓度和CSU临床症状评分呈负相关(r=-0.5406,P=0.0020);血清sVCAM-1浓度与CSU临床症状评分呈正相关(r=0.4883,P=0.0062)。见图3a、b。
2.4 预实验选择IL-35浓度 通过FCM法检测内皮细胞VCAM-1表达,IL-35在浓度为20 ng/mL时,对VCAM-1的抑制作用明显,选择20 ng/mL进行后续的实验。见图4。

图1 1a:CSU患者血清sVCAM-1浓度;1b:CSU患者血清IL-35浓度图2 血清IL-35和sVCAM-1相关性分析

图3 3a:血清IL-35与USA评分相关性分析;3b:sVCAM-1浓度与USA评分相关性分析 图4 IL-35浓度梯度分析
2.5 IL-35对血管内皮细胞VCAM-1表达的抑制作用 与空白对照组相比,CSU上清液组内皮细胞VCAM-1表达阳性率增加,差异有统计学意义(P<0.05);与CSU上清液组相比,IL-35+CSU上清液组内皮细胞VCAM-1表达阳性率降低,差异有统计学意义(P<0.05);与空白对照组相比,HC上清液组内皮细胞VCAM-1表达差异无统计学意义(P>0.05);流式分析见图5a,检测结果见图5b。
2.6 IL-35对单个核细胞黏附血管内皮细胞的抑制作用 荧光显微镜观察发现,空白对照组少量单个核细胞黏附于HUVECs(图6a),CSU上清液组单个核细胞黏附显著增加(图6b),IL-35+CSU上清液组与CSU上清液组相比,单个核细胞黏附显著降低(图6c);通过荧光分光光度计检测,与空白对照组相比,CSU上清液组荧光强度显著增加,差异有统计学意义(P<0.05);与CSU上清液组相比,IL-35+CSU上清液组荧光强度显著降低,差异有统计学意义(P<0.05),结果见图6d。

图5 5a:FCM检测内皮细胞VCAM-1表达;5b:VCAM-1阳性率比较
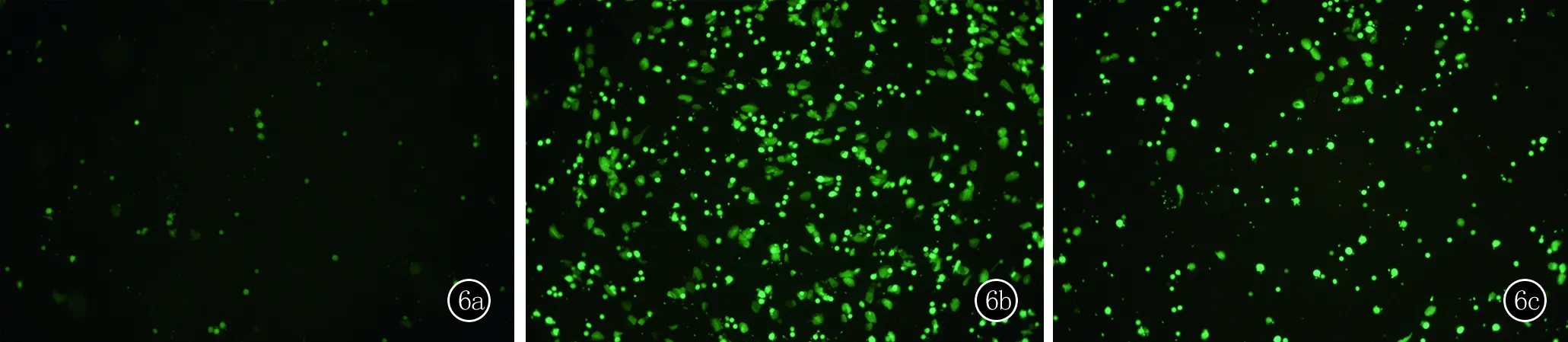
图6 6a:空白对照组;6b:CSU上清液组;6c:IL-35+CSU上清液组

*P<0.05,CSU上清液组vs空白组;**P<0.05,CSU上清液+IL-35组vs CSU上清液组
图6 6d HUVECs与单个核细胞黏附荧光强度比较
3 讨论
慢性自发性荨麻疹是一种常见的皮肤病,发病率为0.5%~1%[4],特点是瘙痒、血管性水肿或两者同时存在≥6周,严重影响患者的生活质量,加重患者经济负担[5,6]。CSU发病机制复杂,涉及自身免疫、自身过敏和凝血异常等因素。目前抗组胺药仍是CSU的基础用药,1代抗组胺药受体选择性差,长期用药对患者学习和认知能力有一定的影响,2代抗组胺药不良反应少,是目前国内外推荐的一线药物,但针对常规剂量控制不好的患者,需加大剂量最高至常规剂量的四倍,对患者生理心理造成一定的影响[7]。因此,迫切需要找到新的治疗方法。
血管内皮细胞异常活化是慢性自发性荨麻疹疾病的主要机制。肥大细胞活化内皮细胞,高表达血管细胞黏附分子-1(VCAM-1)等黏附分子,促进炎症细胞黏附,聚集的白细胞释放氧自由基、炎性介质、细胞因子等直接损伤内皮细胞,从而加重炎性反应。细胞表面VCAM-1和ICAM-1脱落形成可溶性粘附分子(如sVCAM-1和sICAM-1),可作为内皮功能障碍的生物标志物[8]。本次研究发现CSU患者血清sVCAM-1浓度升高,且与CSU临床症状评分呈正相关,表明CSU患者血管内皮细胞活化参与疾病过程。
IL-35 是由p35和EBI3两个亚单位组成的异源二聚体,属IL-12细胞因子家族成员,具有免疫调节作用[9],可促进诱导性调节性T细胞(Treg)增殖,抑制Th17细胞免疫反应,发挥免疫抑制效应[10]。本次研究发现,CSU患者外血清细胞因子IL-35浓度降低,且和CSU临床症状评分、血清sVCAM-1浓度呈负相关。与本次研究一致的是,郭敏等[11]用酶联免疫吸附试验检测CSU患者外周血,发现CSU患者组血清IL-35浓度明显低于健康对照组,而IL-17浓度明显高于健康对照者。
为了进一步阐明IL-35对内皮细胞VCAM-1的抑制作用,本次研究通过体外实验建立CSU患者活化的内皮细胞模型。首先将患者血清(20%,v/v)直接活化血管内皮细胞,通过流式细胞术检测VCAM-1表达,并与健康对照组相比,差异无统计学意义(数据未显示),CSU患者血清与肥大细胞共培养的上清液可显著诱导人HUVECs细胞高表达VCAM-1。与本次研究一致的是,Bossi等[12]证实,以CSU患者血清培育的MC细胞悬液可明显增加血管内皮细胞的通透性,此机制不依赖于IgE和IgG。上述结果均表明CSU患者血清可活化肥大细胞,分泌活性物质,进而活化血管内皮细胞。
CSU患者血清诱导肥大细胞释放介质活化血管内皮细胞可能有下列机制:首先,30%~40%CSU患者存在自体血清皮肤试验阳性[13];用含抗FcεR Iα自身抗体的血清孵育肥大细胞(MC),可使MC脱颗粒释放组胺、白三烯,合成和释放前列腺素(PG-)D2,血栓素,白三烯(LT)和血小板活化因子(PAF),这些介质舒张血管,增加血管通透性和刺激皮肤感觉神经末梢,从而导致皮肤肿胀、发红和发痒[14]。其次,CSU患者血清内存在非自身抗体类循环组胺释放因子。另外,凝血途径激活可促进一些血管活性物质释放和形成,尤其是组胺和凝血酶,它们可以通过刺激血管内皮细胞和肥大细胞脱颗粒而增加血管通透性[15]。
本次研究通过流式细胞术证实IL-35可抑制CSU患者血清与MC共培养的上清液对血管内皮细胞VCAM-1的活化作用。与此一致的是,通过荧光显微镜观察发现,IL-35可抑制MC上清液诱导的单个核细胞黏附。有研究表明,IL-35在败血症小鼠模型中,可抑制脂多糖(LPS)活化内皮细胞,其机制是通过活化细胞 MAPK-AP-1 信号通路,从而减少血管炎症反应[16]。
综上所述,本次研究表明, CSU患者血清IL-35浓度显著减低, sVCAM-1浓度升高。通过体外实验证实,CSU患者血清与MC共培养的上清液可活化血管内皮细胞VCAM-1的表达,而IL-35可抑制此活化过程。上述结果表明CSU患者IL-35浓度降低参与了血管内皮细胞VCAM-1活化。因此,通过调控CSU患者血清IL-35水平,对肥大细胞活化的血管内皮细胞具有保护作用,从而为荨麻疹的治疗提供帮助。但本次研究临床样本量稍偏少,后续研究将进一步探究IL-35对肥大细胞活化的血管内皮细胞的保护作用及机制。

