微创玻璃体切除术后早期高眼压发生的相关因素分析
李 杰,刘三梅,李 芳,董文韬,钟 捷
(四川医学科学院·四川省人民医院眼科,四川 成都 610072)
本世纪第一个10年里,无结膜缝线25 g、23 g及27 g玻璃体切除术(简称:玻切术)相继问世,将传统的玻切术带入微创玻切术时代[1~3]。微创玻切术大大简化了玻切手术步骤,减少了手术时间及降低了眼前节术后反应[4]。微创玻切术在临床上得到广泛应用,使得更多玻璃体视网膜疾病患者得到了有效的治疗[5~7]。但同传统玻切术一样,微创玻切术后常并发一过性或者持续性的高眼压,如不及时处理,可能对视力造成严重损害[8,9]。术后持续性高眼压能够导致视网膜中央动脉阻塞、视盘缺血和视神经萎缩,进而造成视力丧失,严重影响患者的预后。本研究回顾性分析我院眼底外科2016 年4 月至2017 年10 月收治的217例行微创玻切术患者的资料,探讨术后早期高眼压发生率及相关危险因素。希望研究结果能有助于临床实践中对微创玻切术术后高眼压的预防及治疗起到指导作用。
1 资料与方法
1.1一般资料2016 年4 月至2017 年10 月我院运用微创玻切术(25 g或27 g)治疗各类玻璃体视网膜疾病217例(217眼)。其中糖尿病视网膜病变51眼、黄斑前膜29眼、黄斑裂孔23眼、孔源性视网膜脱离80眼、玻璃体积血24眼、其他疾病10眼,见表1。纳入标准:研究时间区间内所有登记在册的行微创玻切术患者。排除标准:既往眼部手术病史,术中联合外路手术及本研究相关观察指标缺项的病例。根据术后早期高眼压的诊断标准(术后1周内任一时间点非接触性眼压计测眼压≥25 mmHg[10]),将患者分为术后高眼压组和无高眼压组。高眼压组26例,男13例,女13例,年龄(53.6 ± 13.9)岁;无高眼压组191例,男89例,女102例,年龄(55.0 ± 16.3)岁。两组年龄、性别、眼别比较,差异均无统计学意义(P> 0.05),见表1。所有患者手术前行最佳矫正视力(BCVA)、眼压、裂隙灯显微镜、三面镜、眼部B 超及眼底检查。

表1 患者基本信息及术前因素对术后高眼压发生率的影响
1.2方法采用爱尔康超高速双向气动玻切机(Constellation Vision System),蔡司公司显微镜(S88/OPMI Lumera T)及RESIGHT 非接触式广角镜,视网膜激光光凝器为爱尔康公司PUREPOINT 532 激光机。手术由同一主刀医师完成。罗哌卡因3~5 ml球周麻醉后,采用斜行穿刺方式在颞上、鼻上、颞下距角巩膜缘后3.5~4 mm处预置25/27 g套管建立三通道,颞下方套管连接灌注管。玻切机切速设置为7500 cpm,负压0~650 mmHg。先行中央部玻璃体切除,再切除周边部玻璃体;并根据疾病的不同,行视网膜前膜剥离、重水辅助固定视网膜、视网膜下液移除、视网膜切开或切除、眼内电凝止血及激光光凝等操作。完成眼内操作后,拔出鼻上和颞上的套管,同时拔出颞下方的套管和灌注管,用棉签按摩或镊子夹闭穿刺口,使之闭合。术毕指测眼压Tn,涂典必殊眼膏,包扎术眼。术后局部予非甾体类抗炎眼液、激素类眼液。
术后检查:术后第1、2、3及7天检查患者,并记录BCVA、眼压、眼前节炎症反应等情况。光感记录为LogMAR视力4,手动记录为LogMAR视力3,数指记录为LogMAR视力2[11,12]。术后眼前节炎症反应标准参考《眼科学》及《中华眼科学》[13,14]制定:前房闪辉分为无、轻、中、重,分别记为0~4级;房水细胞高倍镜下观察1 mm×1 mm裂隙光带,无细胞记为0;1~10个细胞记为1;11~20个细胞记为2;31~40个细胞记为3;40个细胞以上记为4级。
术后高眼压处理:对于术后眼压21~30 mmHg者,局部选用噻吗心安滴眼液、酒石酸溴莫尼定滴眼液、布林佐胺滴眼液或曲伏前列素滴眼液等。术后眼压30~40 mmHg者,局部使用降压眼液同时口服碳酸酐酶抑制剂。术后眼压>40 mmHg者,进一步联合使用高渗剂,药物治疗效果不好者行前房穿刺等对症治疗。
1.3统计学方法采用SPSS 19.0软件进行统计分析。正态分布计量资料以均数±标准差表示,组间比较采用t检验,非正态分布计量资料比较采用秩和检验;计数资料比较采用卡方检验;相关因素分析采用Logistic回归分析。P<0.05为差异有统计学意义。
2 结果
2.1术后早期高眼压发生及转归术后1周内共26眼发生高眼压,发生率为11.98%。21眼在局部抗炎及降眼压眼液治疗1周内恢复正常;3眼在1月内恢复正常;2眼局部药物控制眼压效果欠佳,行青光眼小梁切除+虹膜周切术。
2.2不同术前因素下术后高眼压发生率糖尿病视网膜病变患眼、黄斑前膜、黄斑裂孔、孔源性视网膜脱离、玻璃体积血、其他疾病高眼压发生率分别为11.76%、0%、4.35%、22.5%、0%及10%。高眼压组术前BCVA低于无高眼压组(P= 0.006)。两组术前眼压比较,差异无统计学意义(P= 0.248)。术前有晶体眼、人工晶体眼及无晶体眼的高眼压发生率分别为10.40%、13.89%及37.50%,差异无统计学意义(P= 0.138),见表1。
2.3术中因素对术后高眼压发生的影响高眼压组手术时间长于无高眼压组(P< 0.001)。27 g玻切术组高眼压发生率低于25 g组(P= 0.026)。术中有无激光光凝、是否联合Phaco+IOL植入术、切口关闭方式对高眼压发生率的影响均无统计学意义。术毕眼内填充物为硅油、平衡盐溶液及空气的高眼压发生率分别为22.34%、4.67%、0.0%,组间差异有统计学意义(P< 0.001),见表2。分别两两比较,硅油与平衡盐溶液相比,差异有统计学意义(χ2= 13.869,P< 0.001);硅油与空气相比,差异无统计学意义(χ2= 3.09,P= 0.079);平衡盐溶液与空气相比,差异无统计学意义(χ2= 0.042,P= 0.838)。

表2 微创玻璃体切除术手术各项指标对术后高眼压发生率的影响
2.4不同术后因素下术后高眼压发生率术后眼压波动,高眼压组高于无高眼压组(P< 0.001)。术后前房闪辉为0级、1级、2级及3级以上时,高眼压发生率分别为11.0%、8.00%、45.5%及9.1%,组间差异有统计学意义(χ2= 8.615,P= 0.034)。术后房水细胞为0级、1级、2级及3级以上时,高眼压发生率分别为9.2%、16.7%、50.0%及25.0%,组间差异有统计学意义(χ2= 8.082,P= 0.044),见表3。
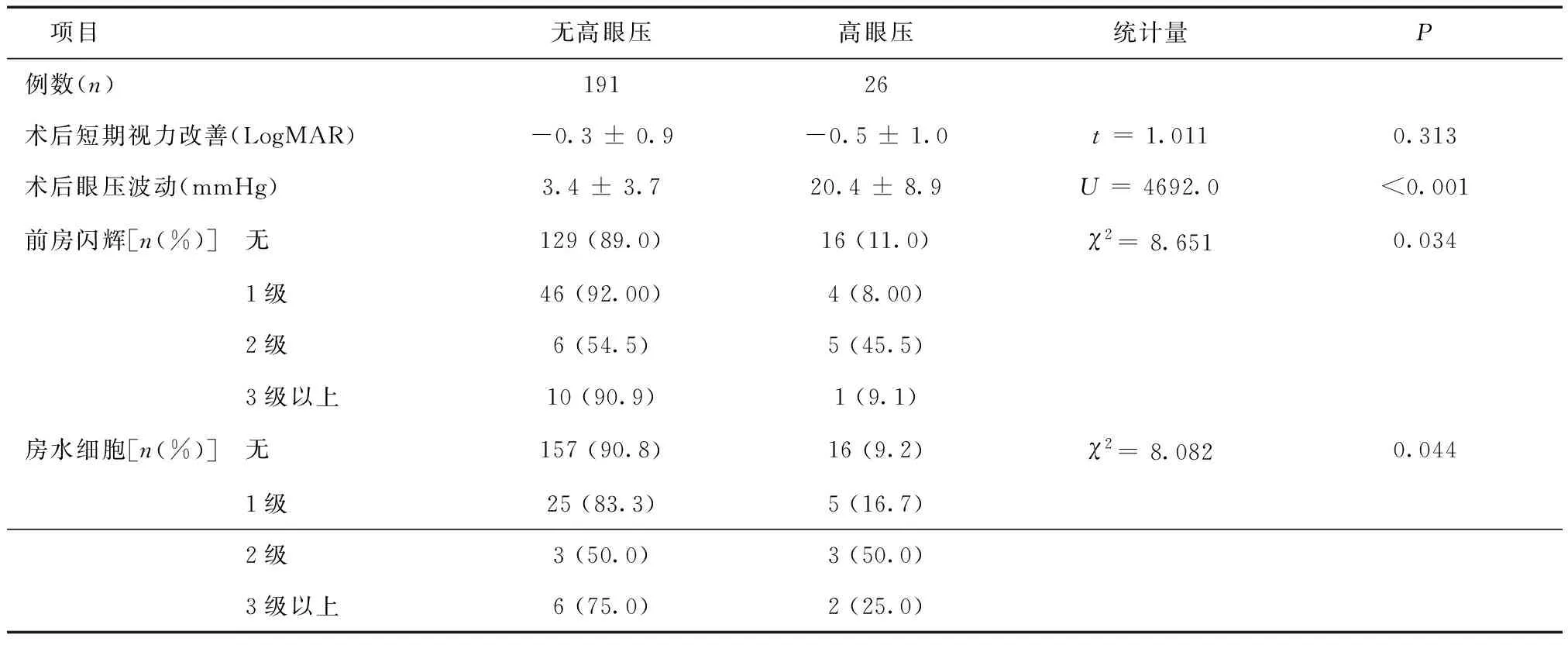
表3 微创玻璃体切除术术后短期随访指标对术后高眼压发生率的影响
2.5相关因素分析经Logistic回归分析发现,糖尿病视网膜病变、眼内填充物(硅油)、术后前房闪辉及术后眼压波动是引起微创玻切术后早期高眼压的独立危险因素,见表4。

表4 微创玻璃体切除术后高眼压影响因素回归分析
3 讨论
术后高眼压是玻切术常见并发症。总体而言,本研究中217例患眼1周内共26眼发生术后高眼压,发生率为11.98%,低于俞学群等报道的23 g玻切术后早期高眼压发生率(32.2%)[15]。可能原因为本研究观察时间相对较短,术后1周的高眼压患者未纳入研究。我们进一步分析发现以下因素在术后高眼压的发生中起重要作用:
3.1眼内充填(硅油)所致的眼压升高本研究中眼内硅油填充组的高眼压发病率显著高于无填充物组(术毕眼内为平衡盐溶液),与刘世波等报道一致[16]。硅油引起术后高眼压的可能机制有手术后眼内组织水肿、葡萄膜反应;硅油注射量过多,增加后房压力并向前推挤晶体虹膜膈,导致周边前房变浅、房角变窄,使得房水外流受阻从而引起眼压升高;无晶体患者可能发生瞳孔阻滞;硅油小粒阻塞房角等。本研究21例硅油填充眼发生高眼压,20例局部抗炎降眼压对症治疗后好转,考虑高眼压原因以眼内组织炎症水肿为主;另外1例持续高眼压患眼因晶体悬韧带松弛,硅油进入前房所致。
3.2糖尿病视网膜病变所致眼压升高本研究217例患者术前诊断不尽相同,共归为六大类。本研究发现糖尿病视网膜病变是术后高眼压独立危险因素。俞学群等发现糖尿病仅伴有单纯性玻璃体积血,术后高眼压发生率为21.1%,而伴有牵拉性视网膜脱离的患者,发生率高达57.6%[15]。吴娜等也发现糖尿病视网膜患者玻切术后高眼压发生率显著升高。糖尿病视网膜病变患者术后高眼压发生,可能的机制是因糖尿病患者的血管机能较正常人差,小梁网滤过功能下降,血管扩张并且通透性升高致使术后炎症反应重[17]。
3.3前房炎症反应与眼压升高前房闪辉及房水细胞是术后眼前节炎症反应指标。本研究发现房水闪辉及房水细胞分级,在高眼压组和无高眼压组之间具有显著差异,并且回归分析发现前房闪辉是术后高眼压的独立危险因素。其机制可能为手术机械刺激局部血流增加,白细胞释放炎性介质使血管扩张、通透性升高,破坏血房水屏障,使血浆性房水进入后房,导致眼压的暂时升高口;同时小粱网炎性水肿或被炎性碎屑堵塞,可使房水滤出率降低造成眼压升高[18]。由此可见,术后眼前节炎症反应的控制对预防术后高眼压发生具有重要意义
3.4眼压波动与高眼压本研究发现眼压波动是高眼压发生的危险因素之一。眼压波动大,其波动上限可能本身就超过25 mmHg。眼压波动的危害不仅仅是增加了高眼压的发生概率,而是波动的眼压可能对视神经造成不可逆的损害[19]。因此眼压波动也应纳入术后重点关注。
综上所述,微创玻切术术后早期常伴有高眼压发生。术后高眼压的发生受较多因素影响,要重点注意其中的独立危险因素,如糖尿病视网膜病变、眼内填充物(硅油)、术后前房闪辉及眼压波动。掌握了玻切术后早期眼压升高的发生规律和危险因素,可以对术后眼压升高的发生做到心中有数,并及时发现、尽早处理,以降低高眼压发生率,最大程度提高患者的视力。

