二陈汤对COPD模型大鼠肺组织AQP5基因表达的影响及意义※
张 淼 梁娟娟 王晨晨 臧丹阳 冯世雄 尚立芝王 祎
(河南中医药大学基础医学院,河南 郑州 450046)
慢性阻塞性肺疾病 (chronic obstructive pulmonary disease,COPD)的定义是一种常见的以持续性呼吸道症状气流受限为特征的常见疾病[1-2]。流行病学调查显示COPD患病风险与年龄呈正相关[3]。临床以咳嗽、咳痰、喘息、胸闷为主要症状,其中咳嗽、咳痰气道黏液的分泌有关,二者属中医“咳嗽”“痰饮”的范畴[4-5]。二陈汤载于《太平惠民和剂局方》 (宋代),有和中理气之功效。前期动物实验研究表明二陈汤加味可改善COPD大鼠肺功能和气道组织结构[6]。但二陈汤的作用机制仍不清楚。本课题针对二陈汤对COPD大鼠AQP5基因表达的影响及其意义,更进一步研究中医药治疗慢性阻塞性肺疾病的机制。
1 材料
1.1 动物 7~8周龄,SPF级,雄性Wistar大鼠50只 (山东鲁抗医药有限公司,合格证号SCXK鲁20130001)。
1.2 药物与试剂 二陈汤水煎剂组成:陈皮10 g(批号1502001H),茯苓15 g(批号1509001H),姜半夏10 g(批号1503001s),甘草6 g(批号1502001S)均选三九医药生产的中药配方颗粒。脂多糖 (LPS,北京索莱宝科技有限公司,批号701C036)。红旗渠香烟 (河南安阳厂,烤烟型,尼古丁含量1.1 mg/支,焦油含量14 mg/支)。羊抗大鼠AQP5一抗(批号287487),浓缩型兔IgG二抗(批号12I08A)、DAB试剂盒、BCA蛋白定量试剂盒 (批号分别为12I12B22、P0010)以上试剂均购自武汉博士德生物工程有限公司。内参GAPDH抗体(Abcam公司,批号ab50838),总RNA提取Kit(批号086001),逆转录试剂盒Kit(批号119041),染料法qPCR试剂 (批号112141),Oligo合成(批号D12540) 均为南京诺唯赞生物科技有限公司。
1.3 主要仪器 inspira型小动物用呼吸机 (日本光电公司),Top Scan型小动物肺功能测量系统 (吉安德尔科技有限公司),TP1020型全自动组织处理机,TP1020-1型自动组织脱水处理机,EG1150C型冷台;ABL80型血气分析仪 (丹麦Radiometer公司);EG1150型自动包埋机,2370/06-2011半自动轮转式切片机,DB-B1烤片机,H11210型摊片机,ST5020型全自动染色机 (德国徕卡公司),20486显微摄像仪,U-CMAD3型显微镜,BX51+CCD病理图像分析系统 (日本 Olympus公司);Motic数字切片扫描系统 (香港 MOTIC公司),DU60型紫外分光光度计 (美国BECKMAN),DHP-260型电热恒温培养箱 (金坛市白塔新宝仪器厂),G8OW23YSLP-E5实验室用可调温微波炉 (广东格兰仕集团有限公司),XH-C旋涡混合器 (常州市国旺仪器制造有限公司),DHP-260型电热恒温培养箱 (金坛市白塔新宝仪器厂),BSA124S-CW万分之一电子天平 (德国赛多利斯集团),ZWY-240恒温培养振荡器 (上海智城分析仪器制造有限公司),BCD-206YH海尔冰箱 (青岛海尔股份有限),18号静脉导管针 (马来西亚制造),课题组自制有机玻璃熏烟箱 (50 cm×50 cm×70 cm)。Multiskan MK3型酶标仪 (美国Thermo Scintific公司),Xcell Surelock型蛋白电泳槽 (美国Life technologies公司),Mini-P R OTEAN Tetra C型转移电泳槽 (美国Bio-R ad公司),272007028实时荧光定量PCR仪(美国爱普拜斯Applied Biosystem)及其检测软件StepOne Software v2.1等均由河南中医药大学科研实验中心及基础医学院科研实验室提供。
2 方法
2.1 分组 将50只大鼠随机分5组分别为:正常对照组、COPD模型组、二陈汤颗粒冲剂低、中、高剂量组,每组10只。
2.2 模型制备 采用香烟烟熏4周加气管内滴注脂多糖(LPS)2次的复合因素复制COPD大鼠模型[7-8]。正常对照组在不干预的条件下正常饲养,在实验第1、14日腹腔麻醉以1%的戊巴比妥钠(40 mg/kg),大鼠仰卧位在固定板上固定气管,以静脉导管针将200 μL LPS(每升生理盐水含LPS 1 g)缓慢注入气管,防止窒息。注射完毕后立即竖起固定板旋转10~20 s,使其在两肺均匀分布。在实验第2~13日,15~28日,使大鼠在熏箱中每天吸入红旗渠香烟烟雾(每次12支每天2次)。
2.3 给药 参考文献[9-10]二陈汤低、中、高剂量组分别给予二陈汤2.5、5、10 g·kg,用生理盐水稀释成6 mL灌胃。正常组及模型组给予同等剂量3 mL/d的生理盐水灌胃;2次/d,连续灌胃14 d。
2.4 肺功能的测定 肺功能检查在COPD的鉴别诊断中起到重要作用[11-12],分别检测潮气量(TV),呼吸峰流速(PEF) 和50%潮气量呼吸流量(EF50)。
2.5 取材、标本制备与指标观测 深度麻醉大鼠后腹主动脉取血处死,取左肺制备肺组织匀浆液,取右肺组织4%多聚甲醛固定24 h,石蜡包埋,切片,经苏木-伊红(HE)染色,光镜下观察肝组织病理改变。
2.6 RT-q PCR检测AQP5 m RNA表达 制备10%的肺匀浆液,3000 rpm,4 ℃,离心5 min后,弃上清于无菌EP管中,-80℃冰箱储存。提取总RNA,经逆转录、扩增后进行RT-q PCR反应,引物由上海生工生物工程有限公司合成。引物序列为AQP5:F:5'-CGTGTTCGCAGAGTTCCTG-3',R:5'-CACAAGCGTCTCAAGGAC-3';GAPDH:F:5'-GTG-GGCCGCCCCAGGCACCA-3',R:5'-CTCCTTAATGTCACGCACCATTTC-3'。反应条件为:94℃预变性30 s,94℃变性5 s,60℃延伸30 s,20~28个cycle。采用 2-△△CT法测量基因表达结果,计算目的基因相对于GAPDH基因的表达量。
2.7 蛋白免疫印迹法(Western blotting) 检测肺组织AQP5蛋白的表达 取肺组织50 mg,加组织裂解液,冰浴下研磨,离心后收集上清液,提取总蛋白,BAC试剂盒进行蛋白定量。配制10%分离胶、5%浓缩胶,加入样品,先以80 V恒压电泳,后转为110 V恒压电泳,待蛋白充分分离后,电泳结束;200 mA恒流条件下转膜1.5 h,将蛋白转于PVDF膜上,封闭3 h,用TBST洗膜3次,每次5 min,分别加入抗AQP5一抗(稀释1∶1 000) 和抗 GAPDH一抗 (稀释1∶5 000),4℃孵育过夜;TBST洗膜3次,用含有5%BSA的TBST液稀释二抗。加入二抗(1∶5000),室温孵育2 h,用化学发光法显色。采用全自动化学发光成像系统显影,用Quantity One软件对蛋白条带进行定量分析条带灰度值,计算目的蛋白与内参β-actin的相对表达量。
2.8 免疫组化检测 用SP法检测肺水通道蛋白5的表达。常规石蜡4 μm切片,二甲苯脱蜡,梯度酒精至水,3%H2O2封闭,微波热抗原修复,兔抗鼠AQP5(稀释1∶1000) 一抗,4°C过夜,滴加羊抗兔二抗,滴加SABC后再用DAB显色,苏木素复染,梯度酒精脱水,二甲苯透明,中性树脂封片。免疫组化结果采用BX51+CCD病理图像分析系统进行半定量分析。
2.9 统计学方法 数据处理采用SPSS 13.0统计软件统计分析,定量资料采用均数±标准差(x±s)描述,组间比较采用方差分析,以P<0.05为差异有统计学意义。
3 结果
3.1 大鼠的一般情况 正常组大鼠未发现异常状况。模型组大鼠毛黄无光,体重减轻,呼吸急促、咳嗽。治疗组上述症状均有不同程度的改善。除正常组死亡1只外,其他各组均死亡2只大鼠。
3.2 各组肺功能比较 与正常组比较,模型组大鼠FVC、FEV1,以及FEV1/FVC均显著变小(P<0.05);与模型组比较,二陈汤高、中剂量FVC、FEV1,FEV1/FVC均不同程度增大(P<0.05),见表1。

表1 二陈汤对各组大鼠肺功能的影响 (x±s)
3.3 各组肺组织结构改变 正常组肺组织结构完整,肺内细支气管及肺泡腔内无渗出物。模型组肺内细支气管腔内积脓,细支气管管壁上皮局部脱落。肺泡间质增厚,炎细胞浸润明显,局部肺气肿形成。二陈汤低、高剂量组略轻于模型组。二陈汤中剂量组炎症明显减轻。

图1 各组肺组织结构改变 (HE,×200)
3.4 各组肺组织水通道蛋白5 m RNA及蛋白表达 与对照组相比,模型组大鼠肺组织中AQP5的mRNA(P<0.01) 和蛋白(P<0.05) 表达均明显减少。与模型组比较,二陈汤高、中剂量组AQP5的mRNA和蛋白表达显著增高 (P<0.05)。
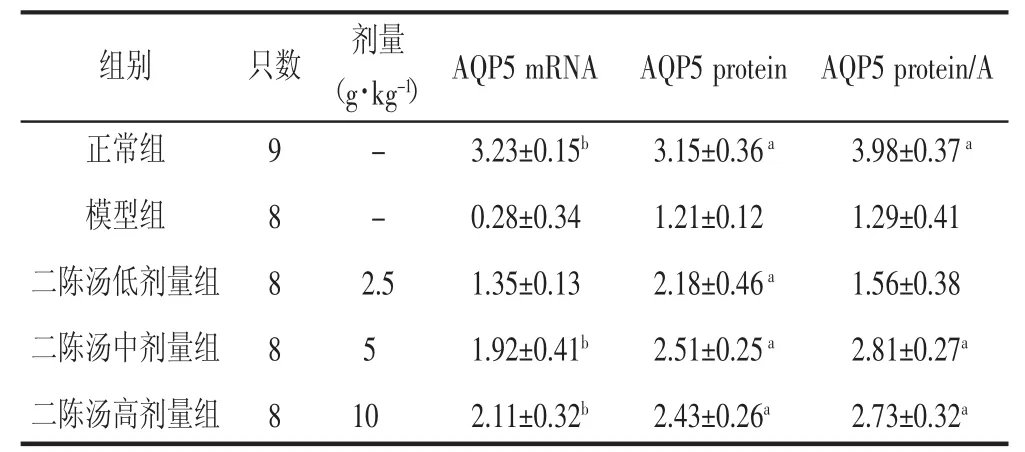
表2 二陈汤对COPD大鼠各组肺组织中AQP5 mRNA及蛋白表达的影响 (x±s)
3.5 各组AQP5免疫组化结果 AQP5阳性显色以肺泡Ⅰ型上皮细胞胞浆和膜呈棕黄色表达,肺泡Ⅱ型上皮细胞阴性(图2)。与正常组相比,模型组大鼠肺组织中AQP5蛋白的表达显著减弱(P<0.01)。与模型组相比,二陈汤高、中剂量组AQP5蛋白的表达明显增加(P<0.05)。见表2。

图2 各组AQP5免疫组化结果 (HE,×200)
4 讨论
COPD是不完全可逆气流受限的慢性肺部疾病,与机体对有害气体及有害颗粒的异常反应有关。主要危险因素包括:吸烟、燃烧生物燃料、空气污染、呼吸道感染及其他宿主因素。COPD的发病机制目前不清,外界因素激活炎症介质后,导致中性粒细胞、巨噬细胞等炎症细胞数增加,所以其持续性的炎症反应是出现咳嗽、咳痰等症状的关键[14-16]。
中医辨证认为肺脏感邪,迁延久治,痰瘀稽留,其病理变化为本虚标实[15]。肺为其标,脾肾为本,痰饮之证,重在化痰理气。二陈汤出自《太平惠民和剂局方》,由陈皮、茯苓、半夏、甘草四味中药组成。陈皮理气行滞、燥湿化痰为君药,半夏增强燥湿化痰之力为臣药,佐以茯苓健脾渗湿,甘草健脾调和诸药,四药一方达到燥湿化痰,理气和中之效。
水蛋白通道(AQP)是水分子跨膜转运的蛋白家族,广泛分布于上皮组织细胞膜。气道和肺内分布的AQP参与调节气道和肺内的湿度。AQP表达下降可使气道和肺内湿度减弱,黏液变得黏稠而不易清除,引发上皮细胞的干燥及损伤,利于细菌大量繁殖而引起感染,而继发炎症。致使炎症细胞渗出并释放炎性介质如白三烯、组胺、前列腺素等,使支气管收缩,增加气道阻力,减弱肺功能。AQP5作为肺组织中主要水通道蛋白,在气道及肺内液体的吸收及转运方面具有重要的作用,与气道黏液的分泌与调节有密切关系[17]。AQP5参与COPD患者气流受限的形成和发展过程:AQP5的减少降低了细胞对水的转运能力,黏液纤毛清除功能减弱,气道黏液黏稠不易咳出[18-19]。黏液在气道中聚积为病原微生物创造生长环境,从而加重炎症反应,使患者肺功能进一步恶化。本研究结果显示,与正常组相比,COPD模型组肺组织中AQP5mRNA和蛋白表达显著降低。与模型组相比,二陈汤中、高剂量组血浆中AQP5mRNA和蛋白的表达显著增强。提示二陈汤提高肺组织中AQP5基因的表达而改善水的转运,降低黏液的黏稠度,利于黏液的排出及吸收,减轻炎症反应。至于二陈汤上调AQP5基因表达的的机制仍需深入研究。

