siRNA下调THBS4对人骨肉瘤MG63增殖的影响
谢冰颖 李生强 谢丽华 陈娟 葛继荣
福建省中医药研究院基础医学研究所 骨质疏松证候基因组学研究室,福建 福州 350003
血小板反应蛋白(Thrombospondin)是内质网产生的一类机体在受损、重建或重修饰的组织细胞中产生的蛋白,它能调控其他蛋白的表达,帮助纠正或清除错误折叠、无功能意义的蛋白。课题组前期的人骨组织芯片检测中,我们发现骨质疏松症患者股骨血小板反应蛋白4(Thrombospondin 4,THBS4)表达出现降低[1],已有报道THBS4在心脏功能[2,3]、血管新生[4]、肿瘤[5]中起着重要作用,但其在成骨过程中的作用需要进一步研究。本研究采用siRNA敲低MG63细胞中THBS4的表达,观察其对MG63细胞株成骨功能的影响。
1 材料与方法
1.1 材料
人骨肉瘤细胞株MG63购自武汉大学细胞库。DMEM培养基购自美国Thermol,胎牛血清、胰蛋白酶购自美国Gibco公司。二甲基亚砜(DMSO)购自美国Sigma公司。鼠抗人Thbs4、兔抗β-actin以及兔抗TGF-beta1购自美国Thermol。Primer Script Rtreagent kit, Real time PCR kit 购自宝生物工程(大连)公司,THBS4-siRNA及阴性对照,转染试剂均购自广州市锐博生物科技有限公司。ECL试剂购自Thermol。多功能酶标仪(美国赛默飞Thermol),实时荧光定量PCR仪ABI 7500fast(美国ABI公司),多功能成像工作站FluorChem M(美国Proteinsimple公司)。
1.2 细胞培养
MG63培养于含有10%胎牛血清的DMEM培养基中,置于5% CO2、37 ℃中传代培养,并取对数生长期的细胞用于细胞转染实验。
1.3 siRNA瞬时转染
转染前24 h将细胞以每孔0.8×105的密度接种于24孔板中进行培养,待细胞处于对于生长期并且融合度达60%时进行转染。分为实验组,阴性对照组和空白组。前两组分别转染特异性Thbs4 siRNA和阴性对照siRNA,空白对照组细胞不做任何处理。转染方法参照厂家说明书进行。实验重复3次。转染后48 h收集细胞用于定量PCR实验,72 h收集细胞用于蛋白质印迹实验。
1.4 CCK-8增殖实验
在24孔培养板中进行细胞转染,在细胞转染后24、48、72、96 h,每孔分别加入2 μL CCK-8,放回CO2细胞培养箱中继续孵育1 h,于多功能酶标仪上检测450 nm吸光度。
1.5 实时荧光定量PCR检测mRNA表达水平
采用Trizol方法抽提总RNA后,逆转录过程按照SYBR Prime ScriptTMRT-PCR Kit II试剂盒说明操作。以GAPDH为内参,并设3个重复管,进行实时荧光定量PCR检测。PCR反应体系的反应步骤:95 ℃ 30 s,95 ℃ 5s,60 ℃ 30 s,40个循环,并增加熔解曲线程序,以观察PCR产物是否单一。各基因引物序列,产物大小见表1。各样品的目的基因和管家基因分别进行定量 PCR反应。mRNA相对表达量以2-△△Ct表示, △Ct=(Ct 目的基因 - Ct GAPDH); 以对照组作为基线,采用以下公式计算目的基因 mRNA表达差异倍数(folds change)=2-△△Ct, 其中△△Ct=(Ct 目的基因-Ct GAPDH)实验组 -(Ct目的基因- Ct GAPDH)对照组。
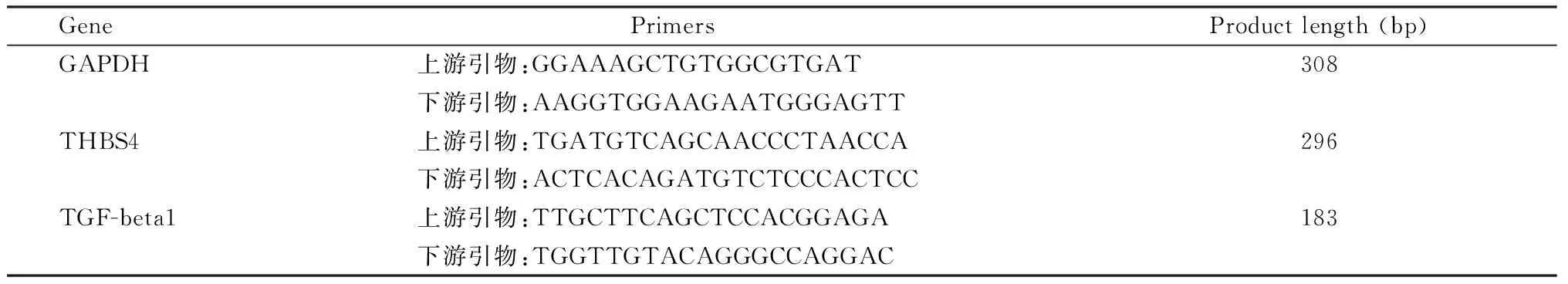
表1 定量PCR实验引物序列Table 1 Sequences of primers for Real-time PCR
1.6 蛋白表达水平检测
转染72 h后,胰蛋白酶消化MG63细胞,收集细胞,置冰上采用细胞裂解液进行细胞裂解、提取总蛋白,以BCA法进行蛋白定量。上样30μg/孔, SDS-聚丙烯酰胺凝胶电泳,100 V湿转60 min,含5%脱脂奶粉的TBST液封闭2h,鼠抗THBS4(1∶400)、兔抗TGF-beta(1∶500)、兔抗β-actin(1∶1000)4℃孵育过夜。第二天,TBST洗涤10 min×3次后,羊抗兔二抗(1∶1000)室温孵育2 h,洗涤后Thermol ECL显色,置入多功能成像工作站进行曝光记录。
1.7 统计学方法
2 结果
2.1 MG63的鉴定
在相差显微镜下,人骨肉瘤细胞贴壁生长,细胞呈梭形。细胞转染后,由于转染试剂的毒性,有少量细胞死亡,大部分MG63仍呈梭形,见图1。
2.2 THBS4 siRNA转染后对细胞增殖的影响
在转染后不同时间点,采用 CCK-8检测3组吸光度值 (optical density,OD),结果表明转染后48 h,72 h,实验组OD值高于阴性对照组(P<0.05),差异具有显著性。表明siRNA转染后能促进骨肉瘤 MG63 增殖,见图2。
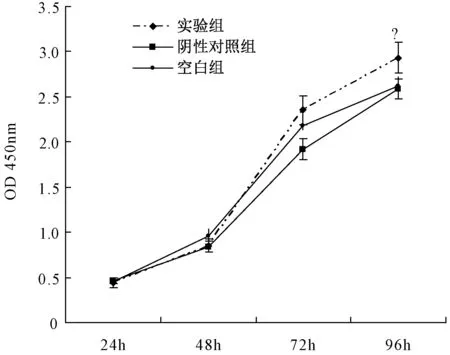
图2 CCK-8检测不同阶段对MG63细胞增殖的影响与阴性对照组相比,*P<0.05Fig.2 The proliferation of MG63 cells at different stages detected with CCK-8 Compared with negative control group,*P<0.05
2.3 THBS4 siRNA对 mRNA表达影响
Real-time PCR检测结果显示,siRNA转染后,与阴性对照组相比,实验组THBS4 mRNA表达水平显著降低(P<0.01)。阴性对照组与空白组比较差异无统计学意义。转染后,实验组TGF-beta1 mRNA表达水平显著提高(P<0.01),见图3。
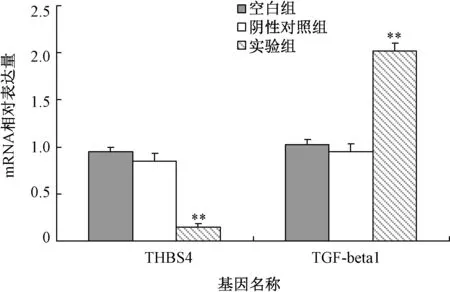
图3 THBS4 siRNA对 MG63细胞mRNA表达影响与阴性对照组相比,**P<0.01Fig.3 Effect of THBS4 siRNA on the expression of mRNA in MG63 cells Compared with negative control group,**P<0.01
2.4 蛋白质印迹法检测THBS4 siRNA转染后蛋白表达
结果显示, siRNA转染后,与阴性对照组相比,实验组THBS4 蛋白表达水平显著降低(P<0.01)。阴性对照组与空白对照组比较差异无统计学意义。转染后,实验组TGF-beta1 蛋白表达水平显著提高(P<0.01),比阴性对照组提高1.7倍。
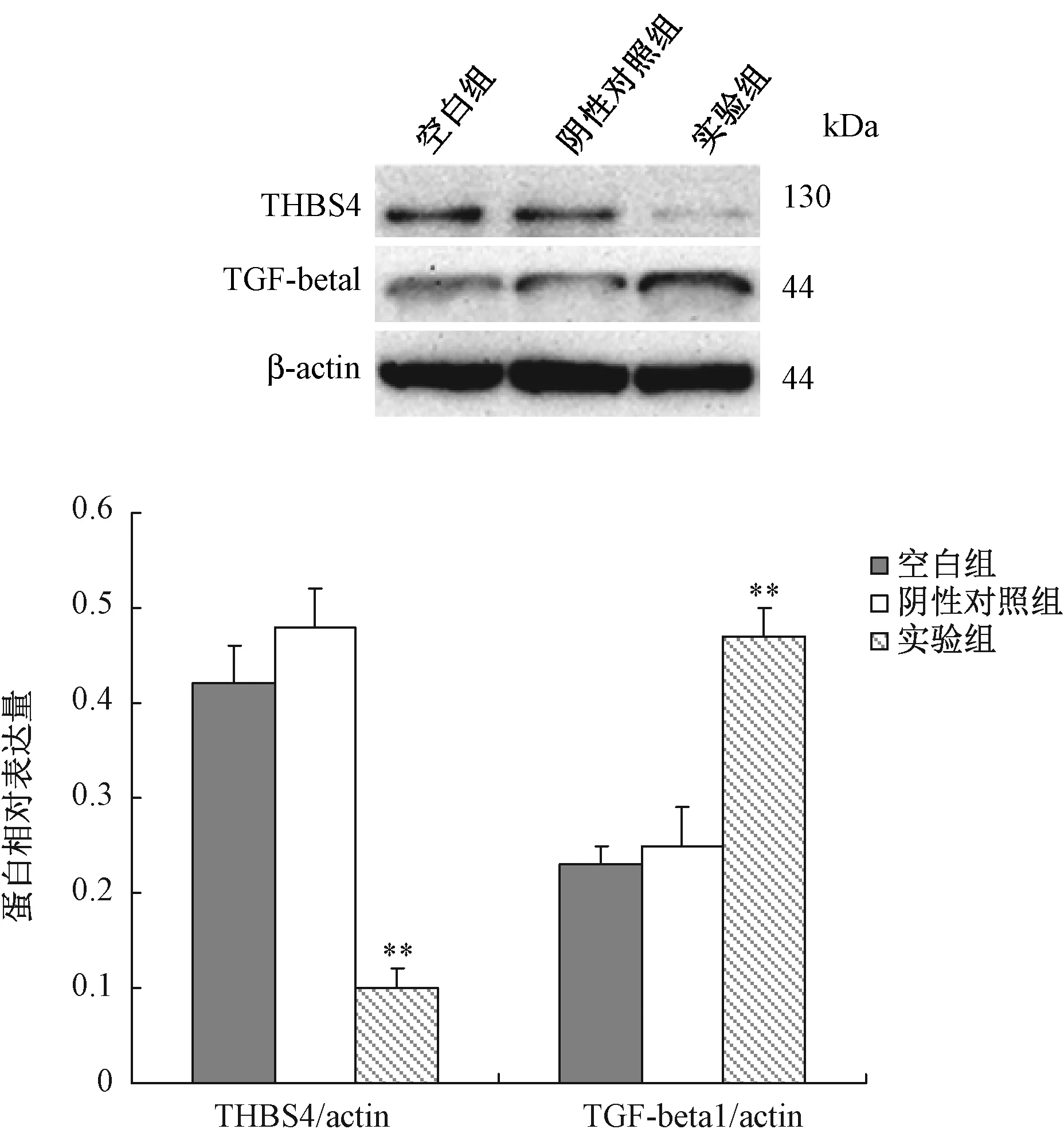
图4 THBS4 siRNA对 MG63细胞蛋白表达影响与阴性对照组相比,**P<0.01Fig.4 Effect of THBS4 siRNA on the expression of proteins in MG63 cell Compared with negative control group,**P<0.01
3 讨论
血小板反应蛋白家族(Thrombospondins family, THBS)是一组进化保守的,可以短暂的或长期的与细胞外其他间质发生作用,需要钙结合的细胞外间质蛋白,参与众多生物过程,发挥包括细胞间桥接,细胞与基质的相互作用[2]。目前发现的—共有5个成员,分别是THBS1、THBS2、THBS3、THBS4和THBS5[6]。
THBS4是一种分泌型蛋白,最早由Lawler J[7]于1993年发现。THBS4有明显的组织表达差异性,在心脏、骨骼肌及肌腱[8]中大量表达。它能与胶原和非胶原结合,可以调控细胞迁移、细胞增殖、连接、粘附、血管生成、神经发育、组织架构、器官发育,在疼痛信号传导和肿瘤[9-11]的发生发展中起到重要作用。近年来,THBS4在肿瘤中的研究越来越多,它在胃癌[12,13]、前列腺癌中[14]高表达,具有识别肿瘤生物学特性的潜能并可能用于临床肿瘤早期诊断和预后判断。课题组前期的人骨组织芯片检测中,骨质疏松症患者股骨THBS4表达下调[1]。在本研究中,THBS4特异性siRNA可以显著降低THBS4的mRNA及蛋白表达,CCK-8实验表明对细胞增殖具有促进作用。
转化生长因子β(TGF-β)是骨组织中重要的细胞因子[15],广泛存在于正常组织及转化细胞中,以骨组织和血小板中的含量最为丰富,TGF-β有5 种异构体,即TGF-β1-5,其中最早发现和研究最充分的是TGF-β1。研究证实[16],TGF-β1 能促进成骨细胞增殖、分化,刺激细胞外基质合成,同时还能降低骨转换,促进骨与软骨的形成,加快破骨细胞的凋亡。TGF-β对骨的生长发育及重建都有重要的调节功能,是参与调节骨重建最重要、最基本的细胞因子之一[17]。Muppala S 等发现THBS4参与了TGF-β1诱导的血管新生,说明THBS4能够参与TGF-β1信号通路[18]。本实验中,实验组采用siRNA敲低THBS4后,TGF-β1能显著提高,表明敲低THBS4后可以激活TGF-β1信号通路。考虑到TGF-β对骨的生长发育的重要性,敲低THBS4可能提高MG63成骨能力。后期实验可检测成骨过程中的关键基因、蛋白的变化,证实对成骨的影响。
THBS4作用机制比较复杂,也存在着对立的报道。在肿瘤的研究中,多种肿瘤研究数据显示THBS4过表达,至少在转录水平上存在差异。多数数据支持可能起到刺激肿瘤细胞增殖,有利于肿瘤细胞浸润和转移的作用,但也有数据显示可能发挥着抑癌基因的作用[11]。在最近的报道中,Anke J[19]等发现基因敲除小鼠THBS4并没有影响骨骼的生长,但会引起短暂的软骨厚度减少。这与本文的结果有些不一致。分析原因,可能是基因发挥生物学功能不但取决于细胞类型、细胞内环境,还受到激素的控制[20]。THBS4在骨组织中的功能,尤其在软骨发育中的作用还需要进一步研究。

