骨质疏松性椎体压缩骨折椎体强化术后不同椎体高度对相邻椎体应力影响的有限元分析
赵文韬 秦大平 张晓刚* 王志鹏 仝尊
1. 甘肃中医药大学,甘肃 兰州 730000 2. 甘肃中医药大学附属医院,甘肃 兰州 730020 3. 云南中医学院,云南 昆明 650500
骨质疏松性椎体压缩骨折(osteoporotic vertebral compression fracture, OVCF)是老年人常见的伴随骨密度降低而导致的疾病[1],可以引起急性或慢性腰背疼痛、脊柱功能受限、胸腰椎椎体畸形、椎体高度丢失和生活质量下降[2-3],其发生率高于其他骨质疏松性骨折(比如髋部骨折和桡骨远端骨折)[4],已经成为越来越严重的疾病和全球重大的健康问题之一,将来会显著增加社会和家庭的经济负担[5]。

图1 四例T12骨质疏松性椎体压缩性骨折椎体强化术后CT图像Fig.1 Computed tomography images of four patients with T12 osteoporotic vertebral compression fracture after vertebral augmentation
针对OVCF的治疗,经皮椎体成形术(percutaneous vertebroplasty, PVP)和经皮椎体后凸成形术(percutaneous kyphoplasty, PKP)两种椎体强化技术通过将骨水泥经皮注射到骨折椎体中可以达到快速稳定骨折、缓解疼痛的治疗目的[6-7]。在临床运用中发现,尽管临床治疗效果明确,但是PVP和PKP并不能将OVCF中丢失的椎体高度全部恢复。而这种现象对骨折椎体相邻椎体应力的影响也尚未明确,为了分析OVCF椎体强化手术后不同椎体高度对相邻椎体应力的影响,我们运用有限元分析 (finite element analysis, FEA)的方法进行了研究。
1 方法
1.1 纳入患者
本研究纳入四名女性T12OVCF志愿者。OVCF的纳入标准为:①急性、轻度或中度暴力造成的骨折;②腰背部疼痛视觉模量(VAS)评分≥5分;③受伤椎体MRI检查T1加权像呈高信号,T2加权像呈低信号;④通过双能X射线(dual-energy X-ray, DXA)测定骨密度T≤-1.5。排除标准:其他病理性骨折。四名患者的年龄分别为63、71、77和84岁,均进行单侧PKP手术。四例患者手术后第2天VAS评分降至2、2、2和1分。
患者椎体强化后进行CT扫描,扫描节段从T11水平到L1水平,扫描层厚为0.625 mm。患者椎体强化后CT影像通过Genant半定量方法进行分级,分别被分为0~3级:椎体高度正常(0级);轻度畸形(1级,前/后对比减少约20%~25%);中度畸形(2级,任意高度减少约25%~40%,面积减少20%~40%;严重畸形(3级,任何高度或面积减少约40%)(图1)[8]。所有CT影像都通过医学数字成像与通讯(digital imaging and communications in medicine, DICOM)格式保存,用于三维FEA模型的生成。
1.2 T11~L1和T12骨折三维模型的构建
利用CT影像生成包含T11~L1节段的三维模型。首先将四名患者DICOM格式的CT影像导入Mimics软件(版本:10.01, Materialize, Inc., Leuven, Belgium)。使用阈值分割命令分离骨骼和软组织;使用编辑蒙版工具编辑图像形状,选择所需区域,填充出现在间隙中的图像区域,并逐层分割出所需的轮廓;最后,通过编辑蒙板重建T11、T12、L1三个椎体,生成T11、T12、L1椎体(包括1 mm皮质骨和松质骨)的三维模型。重建的三维模型以STL格式保存。
将STL格式的模型导入到自动逆向工程软件Geomagic (版本:2012,Geomagic,Raindrop Geomagic,Research Triangle Park, NC, USA),通过软件对骨骼模型进行优化,分别使用平滑降噪、特征去除、编辑轮廓线、构造曲面片和拟合曲面等命令达到目的,生成的模型以STP格式分别保存。将STP格式的模型导入到Solidworks软件(版本2012,Dassault Systems,SolidWorks Corp.,Santa Monica,CA),利用装配体命令将T11、T12、L1椎体三维模型装配后转为零件,使用曲面和特征命令等距曲面、分割、组合等来生成终板、关节突关节软骨和椎间盘(包括髓核和纤维环)。再通过装配命令将这些结构装配获得所需的三维模型。最后参考先前文献报道[9]的模拟方法,使用曲面命令切割椎体产生0.5 mm骨折线(图2a),生成T12椎体OVCF骨折的模型。

图2 三维有限元模型的构建:a. T11~L1三维模型和T12椎体OVCF模型;b. T11~L1三维模型和T12椎体增强术后模型;c. T11~L1有限元分析模型.Fig.2 Three-dimensional finite element model: a.T11~L1 three-dimensional model and T12 fracture model; b.T11~L1 three-dimensional model and T12 vertebral body after augmentation; c.T11~L1 finite element analysis model.
1.3 T12椎体强化术后模型的构建
通过Solidworks软件生成一个体积为4 mL的圆柱体,用于模拟注入后的骨水泥。将之前生成的T12模型导入Solidworks软件,将骨水泥模型组装在椎体中央位置,然后通过布尔运算去除多余的骨骼后再将骨水泥模型组装至椎体空腔处,由此获得单侧骨水泥注射椎体强化术后的T12椎体三维模型。之后将T12~L1椎体、骨水泥、椎间盘、终板和软骨等各种模型进行装配,生成整体的三维模型(图2b),最终得到四个强化术后不同T12椎体高度的三维模型。
1.4 有限元分析前处理
使用ANSYS软件(版本17.0,ANSYS,Canonsburg,PA,USA)进行FEA分析,首先对三维模型进行FEA前处理。将包括T12~L1椎体、骨水泥、椎间盘、终板和关节突关节软骨等部分的三维模型导入ANSYS软件,补充相关结构,包括前纵韧带、后纵韧带、棘间韧带、棘上韧带、黄韧带和关节囊。参考近期关于OVCF研究中所使用的材料属性对之前构建的三维模型各个部分进行材料属性赋值(表1)[10-13]。所有模型均定义为线弹性、各向同性材料,其中皮质骨、松质骨、终板、关节软骨和髓核定义为线性各向同性弹性材料的固体单元,前纵韧带、后纵韧带、棘间韧带、棘上韧带、黄韧带和关节囊的单元类型定义为张力变形无压缩。网格、节点和单元由软件生成,终板、关节软骨、骨折线和椎间盘划分为2 mm的网格,皮质骨、松质骨和骨水泥划分为5 mm的网格。终板与椎体、终板与椎间盘、关节软骨与骨骼之间的连接定义为绑定,关节软骨与关节软骨之间的连接定义为无摩擦(图2c)。
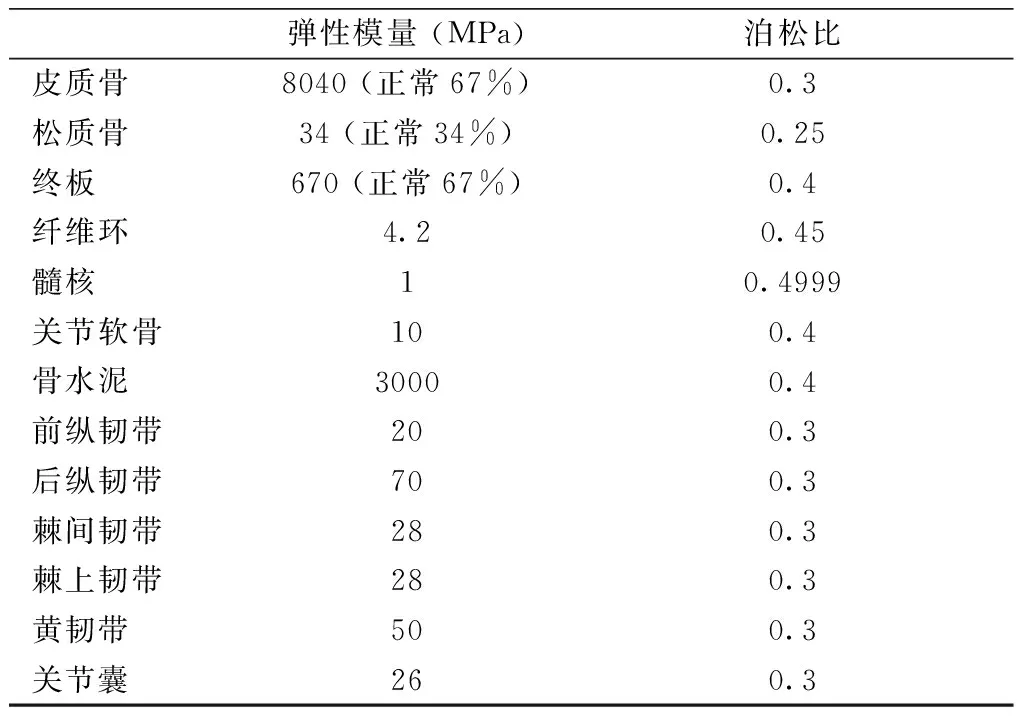
表1 有限元分析模型材料属性Table 1 Material properties of finite element analysis models
1.5 有限元分析
通过固定L1椎体下终板,自T11椎体上缘分别施加垂直压缩、屈曲、右侧曲、左侧曲四种不同的载荷,使用四个不同椎体高度T12椎体强化术后模型进行静态有限元分析。所有模型施加500 N的垂直压缩载荷,7.5 N.m的屈曲、左侧曲、右侧曲扭矩。在T11椎体上终板根据脊柱三柱理论分配载荷,其中前中柱分配85%,后柱分配15%载荷[9,14-16]。模型的有效性根据之前发表的FEA模型验证,本研究的模型在不同载荷下与文献[13,17-19]中发表结论的相一致。分析结束时T11和L1椎体应力和应力云图结果通过计算机导出。
1.6 统计分析
提取T12椎体强化术后位于T11和L1椎体内部在不同状态下椎体的von Mises应力,采用配对t检验进行统计学处理,统计分析使用 SPSS软件(版本14.0,BM Corp.,Armonk,NY,USA),以P< 0. 05 为差异具有统计学意义。

图3 T12椎体强化术后T11椎体的von Mises应力(MPa)Fig.3 The von Mises stresses on T11 after fresh T12 osteoporotic vertebral compression fracture augmentation (MPa)
2 结果
2.1 不同T12椎体高度下的T11应力
椎体强化术后T11椎体压力呈现T12椎体高度丢失越严重,椎体承受载荷越大的趋势(图3),各种状态最大载荷均出现在T12椎体高度为3级时。其中0级的载荷分别是:垂直1.330 6 MPa、屈曲4.921 2 MPa、左侧屈7.719 3 MPa、右侧屈7.942 2 MPa;1级的载荷分别是:垂直1.601 1 MPa、屈曲5.286 3 MPa、左侧屈7.597 8 MPa、右侧屈7.823 9 MPa;2级的载荷分别是:垂直1.813 8 MPa、屈曲5.181 2 MPa、左侧屈8.132 9 MPa、右侧屈8.322 9 MPa;3级的载荷分别是:垂直1.961 9 MPa、屈曲5.393 1 MPa、左侧屈9.181 8 MPa、右侧屈9.242 1 MPa(图4)。T12不同椎体高度之间T11椎体应力差异P>0.05,没有统计学意义。
2.2 不同T12椎体高度下的L1应力
椎体强化术后L1椎体垂直和右侧屈状态压力呈现T12椎体高度丢失越严重,椎体承受载荷越大的趋势(图5),T12椎体高度为3级时,垂直和右侧屈均承受最大载荷。其中0级的载荷分别是:垂直1.032 3 MPa、屈曲3.145 7 MPa、左侧屈3.167 7 MPa、右侧屈2.557 8 MPa;1级的载荷分别是:垂直1.154 5 MPa、屈曲3.366 2 MPa、左侧屈2.446 6 MPa、右侧屈2.500 7 MPa;2级的载荷分别是:垂直1.131 2 MPa、屈曲3.051 7 MPa、左侧屈2.113 1 MPa、右侧屈2.644 7 MPa;3级的载荷分别是:垂直2.076 2 MPa、屈曲2.517 8 MPa、左侧屈2.660 7 MPa、右侧屈2.817 1 MPa(图6)。T12不同椎体高度之间L1椎体应力差异P>0.05,没有统计学意义。
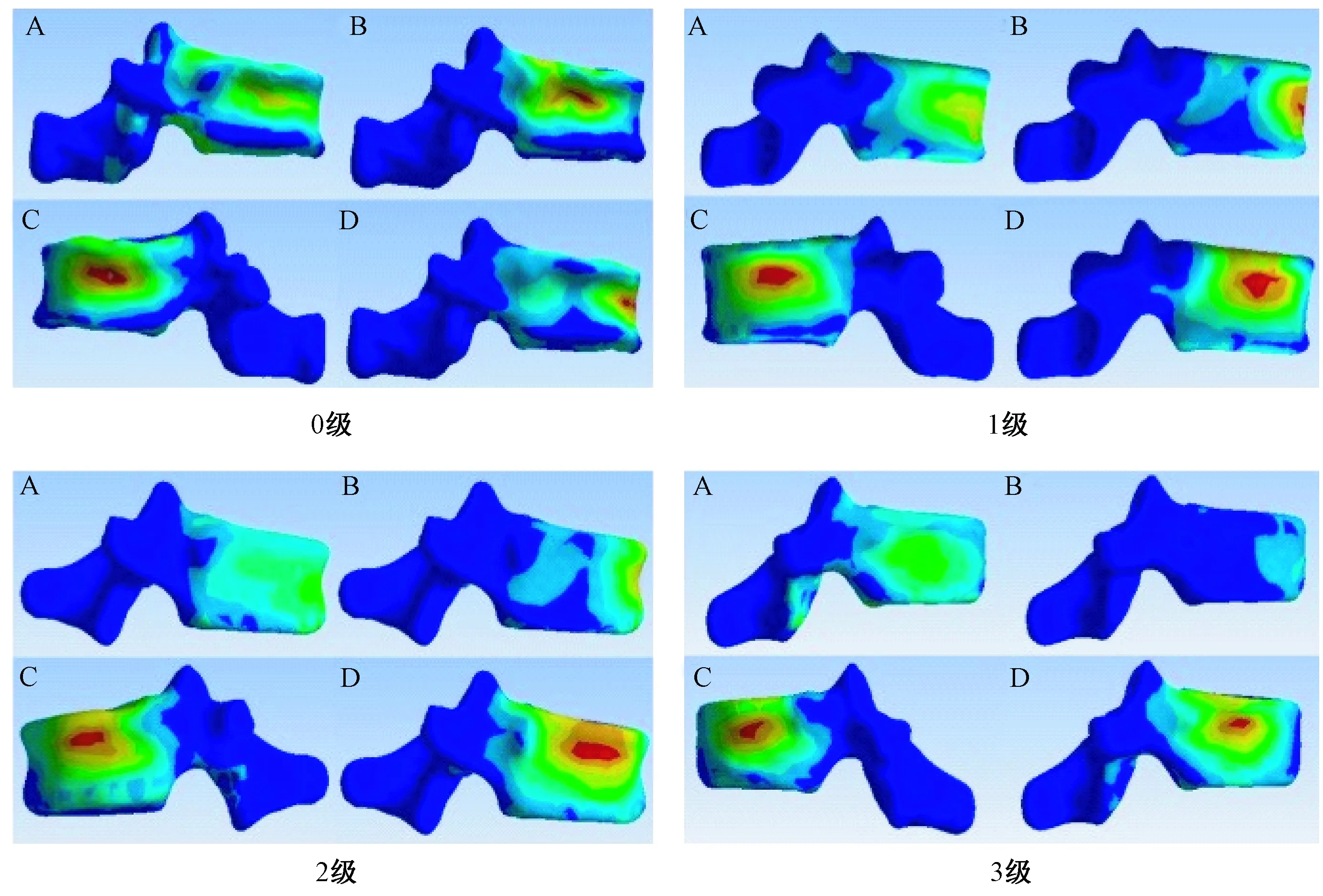
图4 T12椎体强化术后T11椎体的von Mises应力云图Fig.4 Images of von Mises stresses on T11 after T12 osteoporotic vertebral compression fracture augmentation
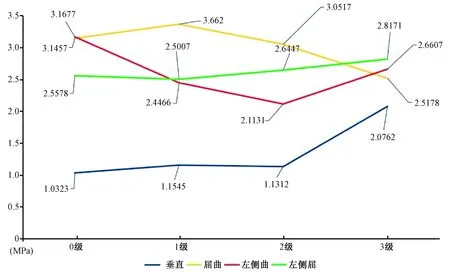
图5 T12椎体强化术后L1椎体的von Mises应力(MPa)Fig.5 The von Mises stresses on L1 after T12 osteoporotic vertebral compression fracture augmentation (MPa)

图6 T12椎体强化术后L1椎体的von Mises应力云图Fig.6 Images of von Mises stresses on L1 after T12 osteoporotic vertebral compression fractures augmentation
3 讨论
OVCF是伴随着人口老龄化出现的一个重要健康问题[20],由于骨质疏松症患病率和人类预期寿命的增加,OVCF的发生率也在上升[21]。虽然OVCF可以常规进行保守治疗,但患者难以耐受长期卧床休息,还可能会导致肺炎,尿路感染,褥疮和深静脉血栓形成等各种并发症,而传统的手术治疗也有类似的并发症发生[22]。OVCF的治疗需要恢复椎体高度,然而由于骨质疏松症的影响,一些患者在临床治疗后无法完全恢复椎体高度。对于OVCF的治疗,尽管椎体高度在术后恢复的程度不确定,椎体强化技术仍然是一种微创和有效的手术方法,PKP和PVP可以通过椎体强化缓解OVCF患者的临床症状,但这些患者的椎体高度并不能完全恢复[6-7]。
由于患者骨密度的下降,通过手术方法治疗OVCF可能会导致内固定松动、骨折复发等。而PVP和PKP进行椎体强化后则可以有效的避免这些问题[23]。PKP和PVP可以选择使用两种骨水泥注射方法:单侧或双侧注射,都可以取得良好的临床效果[4]。PVP和PKP的区别在于PVP主要通过皮肤小切口穿刺注射骨水泥来稳定骨折,而PKP则使用相同的切口后用球囊扩张来更好地恢复椎体高度[8]。PVP和PKP可以显著的缓解疼痛,增加预期寿命,改善脊柱功能[24]。椎体强化术后,骨水泥可以通过稳定骨折裂隙,减少由体重和活动产生的机械应力,并且可能通过细胞毒性和骨水泥聚合放热作用破坏骨骼神经末梢而达到镇痛作用[9]。在我们的研究中,椎体高度的Genant半定量分级在术前和术后没有显著差异,尽管手术无法完全恢复椎体高度,但是临床症状明显缓解。
PKP的生物力学试验已经证实,骨水泥可以增加椎体骨折的稳定性[10-11],PVP或PKP增加了骨折椎体刚度和强度[25-26]。但是,椎体强度增加会导致相邻椎体的负荷增加,骨水泥量及分布是相邻椎体发生骨折的一个重要因素[27],虽然恢复了椎体高度,但是也会增加再次骨折的风险[28]。用于手术的生物材料(如骨水泥)的体积和分布也会对模型的机械负荷产生重要的影响[29-30]。FEA能检测人体标本每个部分内在相互作用机制[31],可以有效分析骨质疏松椎体骨折的生物力学变化[32]。目前已经通过FEA证实椎体强化术可以恢复骨折椎体的机械稳定性,并预测到骨水泥增强后骨骼具有长期的稳定性[8]。FEA的结果也证实骨水泥量的增加可以增加相邻椎体骨折的风险[25],使用大体积的骨水泥对增加继发椎体骨折具有显著影响[33]。然而,这些研究并没有具体研究椎体强化后骨折椎体不同高度对相邻椎体生物力学变化的影响。Von Mises应力作为一种等效应力,常用于生物力学研究中描述骨骼和肌肉的应力变化,在我们的研究中,尽管结果没有统计学意义,但是仍然可以观察到,T12椎体高度在椎体强化术后处于0~3级不同水平,除了L1椎体在屈曲和左侧屈状态时,其余均呈现为椎体高度丢失越多,相邻椎体应力越大。该趋势说明,尽管术后临床症状缓解效果接近,但是椎体高度恢复的差异仍然可能会导致相邻椎体应力发生变化。
4 结论
通过本研究发现,尽管术后临床症状缓解效果接近,但是椎体高度恢复的差异仍然可能会产生相邻椎体应力的变化。其主要的趋势表现为椎体高度丢失越多,相邻椎体应力越大。因此,在进行椎体强化手术过程中,为了减少相邻椎体的应力增加,应当尽可能的恢复骨折椎体的椎体高度。

