电针对腰椎间盘突出症模型大鼠脊髓JAK2-STAT3信号通路的影响
林元杰,张峻峰,康学智,郑明岳,王春晓,吴耀持
电针对腰椎间盘突出症模型大鼠脊髓JAK2-STAT3信号通路的影响
林元杰,张峻峰,康学智,郑明岳,王春晓,吴耀持
(上海交通大学附属第六人民医院,上海 200233)
观察电针对腰椎间盘突出症大鼠的干预效应及对脊髓JAK激酶2(JAK2)-信号传导及转录激活因子3(STAT3)信号通路的影响。将48只雄性SD大鼠随机分为正常组、假手术组、模型组和电针组,每组12只。采用自体髓核移植建立大鼠腰椎间盘突出模型。电针组取右侧肾俞、大肠俞、环跳、阳陵泉进行电针治疗。观察各组造模前及造模后1 d、3 d、5 d、7 d、9 d、11 d、13 d、16 d大鼠右侧足底机械缩足痛阈值(PWT)的变化情况,并采用Western Blot法检测各组大鼠脊髓JAK2、磷酸化JAK激酶2(p-JAK2)、STAT3、磷酸化信号传导与转录因子3(p-STAT3)的表达。模型组和电针组大鼠造模后各时间点(1 d、3 d、5 d、7 d、9 d、11 d、13 d、16 d)右侧PWT呈下降趋势,此后维持在相对稳定的范围,其造模后各时间点(1 d、3 d、5 d、7 d、9 d、11 d、13 d、16 d)右侧PWT与正常组和假手术组比较,差异均具有统计学意义(<0.05)。电针组大鼠造模后7 d至造模后16 d右侧PWT与模型组比较,差异均具有统计学意义(<0.05)。模型组造模后9 d和16 d p-JAK2、p-STAT3蛋白表达显著上调,与正常组和假手术组比较,差异均具有统计学意义(<0.01)。电针组造模后9 d和16 d p-JAK2、p-STAT3蛋白表达降低,与模型组比较,差异均具有统计学意义(<0.05,<0.01)。电针可缓解腰椎间盘突出症大鼠神经痛,其机制可能与抑制脊髓JAK2-STAT3信号通路有关。
电针;腰椎间盘突出症;椎间盘移位,腰;JAK激酶2;信号传导及转录激活因子3;大鼠
腰椎间盘突出症(lumbar intervertebral disc herniation, LIDH)是一种临床常见病,具体表现为髓核突出损害腰神经根,诱导痛觉过敏、无力,分布皮节感觉异常。本病全球年发病率为7.62%,好发于25~55岁人群[1]。LIDH给社会经济和医疗经费带来巨大负担,其发病机制主要是由炎症反应和髓核机械性压迫神经根导致[2]。针灸以中医学基础理论为指导,是我国最古老的治疗方法之一。在2017年美国内科年鉴发表的腰痛治疗指南中,美国医师学会将针灸推荐为治疗急性和慢性腰痛的一线疗法[3]。JAK激酶(Janus kinase, JAK)-信号传导及转录激活因子(singal transducer and activator of transcription, STAT)细胞因子刺激信号通路可调节机体炎症反应,参与神经病理性疼痛的形成过程。在慢性缩窄性压迫性坐骨神经损伤的神经病理性疼痛模型大鼠中,其脊髓JAK2-STAT3信号通路的相关蛋白可被激活[4-5]。本实验拟建立自体髓核移植构建LIDH模型大鼠,探索LIDH模型大鼠的脊髓JAK2-STAT3信号通路是否激活,通过观察电针对LIDH大鼠脊髓JAK2-STAT3信号通路相关蛋白表达的影响,以进一步探索电针治疗LIDH的可能机制。
1 材料与方法
1.1 实验动物
清洁级雄性Sprague Dawley(SD)大鼠48只,体重为(200±20)g,由上海交通大学附属第六人民医院动物实验中心提供。动物实验观察室明暗各12 h,温度控制在20~22℃,相对湿度为50%~70%,自由饮水、摄食。适应性饲养1周,待大鼠适应新环境且饮食、活动正常后开始实验。所有实验程序均经上海市第六人民医院动物使用和管理委员会批准。
1.2 主要试剂与仪器
JAK2、磷酸化JAK激酶2(p-JAK2)、STAT3、磷酸化信号传导与转录因子3(p-STAT3)(美国Cell Signaling Technology公司);Labsystems wellscan mk3酶标仪(Labsystems, Finland);Image quant lAS超灵敏化学发光成像仪(GEHC, Switzerland);Von frey丝(美国Stoelting公司);动物实验手术显微镜;显微手术器械(上海手术器械厂);0.30 mm×25 mm无菌针灸针(固始公元医疗器械有限公司)。
1.3 造模方法
采用自体髓核移植构建LIDH模型[6-7]。具体操作为,用40 mg/kg戊巴比妥行腹腔注射麻醉,取大鼠尾椎髓核共2 mg,并沿腰背部切开皮肤,钝性分离右侧L4-S2的椎旁肌肉,将右侧L5下关节突、L6上关节突和L5椎板切除,暴露右侧L5背根神经节及部分硬膜外腔,将尾椎髓核放置右侧L5背根神经节及硬膜外腔附近,避免造成机械性压迫,逐层缝合伤口,手术后腹腔注射10万单位的青霉素消炎。术后3 d内,每日采用碘伏对伤口进行抗菌处理。
1.4 动物分组及处理
采用查随机数字表法将48只大鼠随机分为正常组、假手术组、模型组和电针组,每组12只。
正常组采用正常饲养,不给予任何手术处理;模型组和电针组采用自体髓核移植构建LIDH模型;假手术组除未放置髓核外,其余步骤均同模型组和电针组。
电针组术后3 d开始电针治疗。取右侧肾俞、大肠俞、环跳、阳陵泉穴。在安静环境下,将大鼠放置在大鼠固定器架上固定,露出右侧腰部及四肢,待大鼠安静后,采用75%乙醇棉球进行消毒,用0.30 mm×25 mm毫针直刺10~15 mm,然后连接电针仪(肾俞、大肠俞为1组,环跳、阳陵泉为1组),采用连续波,频率为2 Hz,强度1 mA,留针20 min。每日1次,共治疗14 d。在电针组治疗期间,正常组、假手术组、模型组每日均做相同的固定处理,每次20 min。
1.5 标本采集
采用40 mg/kg戊巴比妥行腹腔注射麻醉后,开胸,输液针刺入心尖部,灌注生理盐水,剪开右心耳,观察灌注液血色是否变淡,待大鼠肺脏及肝脏颜色变白后,将大鼠放置于冰上,取俯卧位,迅速暴露脊髓,取出脊髓腰膨大节段,并分离右侧脊髓节段后放入液氮罐速冻,最后放入-80℃冰箱保存。为观察电针治疗过程中指标蛋白的变化情况,故选取造模后9 d、16 d进行取材。其中造模后9 d为电针治疗周期的一半。每个时间点各组取6只大鼠。
1.6 观察指标
1.6.1 机械缩足痛阈值测定
将大鼠放在金属网格板上,待大鼠安静适应环境10~30 min后开始测定。采用up-down法测定大鼠造模前及造模后1 d、3 d、5 d、7 d、9 d、11 d、13 d、16 d右后肢机械缩足痛阈值(paw withdrawal threshold, PWT)。用von Frey hair纤维丝垂直刺激大鼠右侧掌跖部无毛处,von Frey hair呈“S”型,持续作用6~8 s,相邻刺激间隔至少7 s,大鼠出现抬足或舔足行为视为阳性反应。刺激过程中,大鼠走动或受到刺激就抬足视为可疑阳性,需等大鼠安静下来后再行测量。阳性结果为X,阴性结果为O。
1.6.2 Western blot检测
按照20 mg组织加入150~200 mL RIPA蛋白裂解液(含PMSF蛋白酶抑制剂),采用超声破碎仪进行研磨匀浆(以上操作均在冰上进行)。4℃下12000 rpm离心15 min,取上清液。运用BCA法测定蛋白浓度,并通过调节使各组样品总蛋白浓度相等。选择配制10%分离胶,取100mg样品上样,用彩染marker指示标准SDS- PAGE胶。积层胶90 V电泳20~30 min,至溴酚蓝进入分离胶顶部;电压调整至120 V电泳50~70 min,最后200 mA恒流转膜90~120 min。将PVDF膜放置封闭液(5%脱脂奶粉的TBST)室温封闭1 h后,用封闭液稀释相应的一抗(p-STAT3采用1:1000稀释,STAT3采用1:1000稀释,p-JAK2采用1:1000稀释,JAK2采用1:1000稀释),使PVDF膜浸泡在一抗孵育液,4℃孵育过夜。PVDF膜用TBST清洗3遍,每次清洗5 min。然后孵育二抗,用封闭液稀释辣根过氧化物酶标记山羊抗兔IgG(1:1000)和辣根过氧化物酶标记山羊抗小鼠IgG(1:1000),将PVDF膜浸泡在二抗孵育液,室温孵育1 h。TBST清洗3遍,每次清洗5 min。在PVDF膜上加上特超敏ECL化学发光试剂,Image Quant LAS超灵敏化学发光成像仪显示结果。
1.7 统计学方法
所有数据采用SPSS22.0软件进行统计分析。符合正态分布的计量资料以均数±标准差表示,采用单因素方差分析。以<0.05表示差异具有统计学意义。
2 结果
2.1 各组大鼠不同时间点右侧PWT比较
由图1、表1可见,各组大鼠造模前右侧PWT比较,差异无统计学意义 (>0.05)。假手术组大鼠造模后1 d右侧PWT有所下降,与正常组比较,差异有统计学意义(<0.05);而假手术组大鼠造模后3 d右侧PWT有所提高,与正常组比较,差异无统计学意义(>0.05)。模型组大鼠造模后1 d至造模后7 d右侧PWT呈下降趋势,此后维持在相对稳定的范围,其造模后各时间点(1 d、3 d、5 d、7 d、9 d、11 d、13 d、16 d)右侧PWT均显著低于正常组和假手术组,差异均具有统计学意义(<0.05)。电针组大鼠造模后1 d至造模后5 d右侧PWT呈下降趋势,但与模型组比较,差异无统计学意义(>0.05);而电针组大鼠造模后7 d至造模后16 d右侧PWT则呈上升趋势,与模型组比较,差异均具有统计学意义(<0.05);电针组大鼠造模后各时间点(1 d、3 d、5 d、7 d、9 d、11 d、13 d、16 d)右侧PWT与正常组和假手术组比较,差异均具有统计学意义(<0.05)。
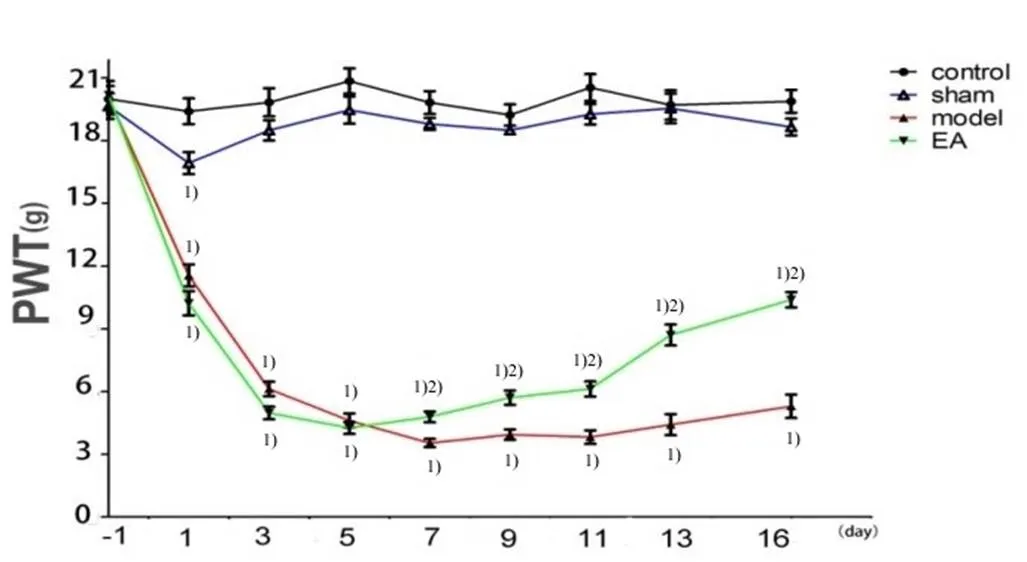
注:与正常组比较1)P<0.05;与模型组比较2)P<0.05

表1 各组大鼠不同时间点右侧PWT比较 (±s,g)
注:与正常组比较1)<0.05;与假手术组比较2)<0.05;与模型组比较3)<0.05
2.2 各组大鼠造模后9 d和16 d脊髓JAK2、p-JAK2、STAT3、p-STAT3蛋白表达比较

注:与正常组比较1)P<0.01;与假手术组比较2)P<0.01;与模型组比较3)P<0.01,4)P<0.05
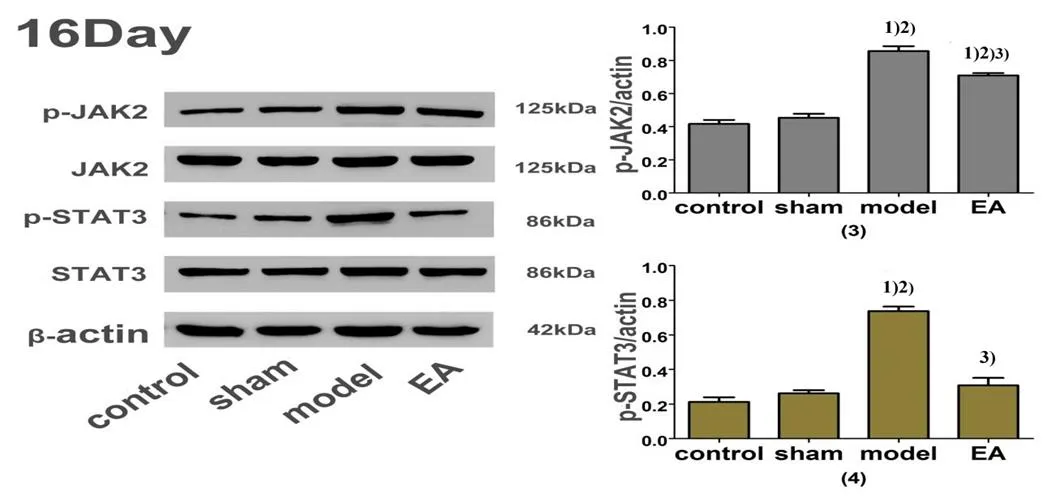
注:与正常组比较1)P<0.01;与假手术组比较2)P<0.01;与模型组比较3)P<0.01
由图2、图3可见,各组造模后9 d和16 d JAK2、STAT3蛋白含量比较,差异无统计学意义(>0.05)。正常组造模后9 d和16 d p-JAK2、p-STAT3蛋白含量与假手术组比较,差异均无统计学意义(>0.05)。模型组造模后9 d和16 d p-JAK2、p-STAT3蛋白表达显著上调,与正常组和假手术组比较,差异均具有统计学意义(<0.01)。电针组造模后9 d和16 d p-JAK2、p-STAT3蛋白表达降低,与模型组比较,差异均具有统计学意义(<0.05,<0.01)。
3 讨论
目前,髓核的生化因素在LIDH发病机制中的作用已日益受到重视。椎间盘髓核含有较多非特异性致炎物,如白介素6、前列腺素E2、白介素1a,可产生炎症性疼痛[8-9]。自体髓核移植构建LIDH模型,其髓核内的炎性物质可引起炎症反应,将外周伤害性信息传入脊髓中枢,促进脊髓释放炎性细胞因子[10]。该模型具有创伤小,不易感染,可重复性强等优点。
LIDH属于中医学“腰腿痛”范畴。贾红玲等[11]应用数据挖掘技术对近10年来针灸治疗LIDH的腧穴使用情况进行分析,结果发现所选腧穴主要以膀胱经和胆经为主。本实验选取膀胱经的肾俞、大肠俞和胆经的环跳、阳陵泉进行治疗。环跳为疏通下肢少阳、太阳经气之要穴;阳陵泉为八会穴之筋会,主治下肢经筋病症要穴,环跳、阳陵泉配用可疏通经络;肾俞、大肠俞均为局部取穴,可刺激穴位促进神经及血管功能,改善局部血液循环,减轻神经疼痛症状[12]。研究表明,多次重复针刺具有累积效应,其疗效随着治疗次数的增加而明显提升[13]。本实验结果表明,从造模后7 d(电针治疗5次)治疗结束后开始,电针组大鼠右侧PWT明显高于模型组,且随着治疗次数的增加,电针组大鼠右侧PWT也随之明显提高。
JAK-STAT信号通路可参与细胞分化、增殖、凋亡及免疫调节。激活JAK-STAT信号通路,主要通过调控相关靶点的磷酸化水平[14-15]。JAK-STAT信号通路激活后,可引起目的基因表达,释放一氧化氮、花生四烯酸、前列腺素、兴奋性氨基酸等物质[16]。本实验Western Blot分析结果显示,模型组造模后9 d和16 d脊髓p-JAK2、p-STAT3的蛋白含量明显升高,表明自体髓核可激活脊髓JAK2-STAT3信号通路。
李军军[5]对2型糖尿病周围神经痛大鼠的环跳、阳陵泉给予2 Hz/1 mA的电针治疗后,可改善大鼠痛敏,其脊髓p-JAK2、p-STAT3的蛋白水平表达明显降低,表明电针可能是通过抑制脊髓JAK2-STAT3信号通路来减轻2型糖尿病周围神经痛大鼠的症状。本实验对LIDH模型大鼠右侧肾俞、大肠俞、环跳、阳陵泉给予2 Hz/1 mA的电针治疗,Western blot分析结果显示电针组造模后9 d和16 d p-JAK2、p-STAT3蛋白含量明显降低,与模型组比较,差异均具有统计学意义(<0.05,<0.01),说明电针治疗LIDH的作用机制可能与抑制脊髓JAK2-STAT3信号通路有关。
综上所述,本研究表明电针可提高LIDH模型大鼠的痛阈,减轻神经痛;同时,电针可降低脊髓p-JAK2、p-STAT3蛋白含量,故笔者推测电针治疗LIDH的机制可能与抑制JAK2-STAT3信号通路有关,针对JAK2-STAT3信号通路的调控今后可能成为治疗LIDH的新靶点。然而,本实验的观察样本量较小,观察的时间点相对较短,今后研究可增大样本量,延长治疗周期,还可采用JAK2-STAT3信号通路的抑制剂进行干预,从而深入探索电针的治疗机制。
[1] Dower A, Chatterji R, Swart A,. Surgical manage- ment of recurrent lumbar disc herniation and the role of fusion[J]., 2016:44-50.
[2] Bjorland S, Røe C, Moen A,. Genetic predictors of recovery in low back and lumbar radicular pain[J]., 2017,158(8):1456-1460.
[3] 潘宁芳,杜俊英,俞婕,等.神经病理性疼痛机制及电针干预作用的研究进展[J].上海针灸杂志,2017,36(1): 103-107.
[4] Li D, Yan Y, Yu L,. Procaine Attenuates Pain Behaviors of Neuropathic Pain Model Rats Possibly via Inhibiting JAK2/STAT3[J].(), 2016, 24(5):489-494.
[5] 李军军.电针对2型糖尿病周围神经痛大鼠脊髓JAK2/STAT3信号通路的影响[D].南昌大学硕士论文, 2016:14-17.
[6] 贺秋兰,魏明,李梅娜,等.蛇床子素对酸诱发髓核致炎大鼠神经节神经元的膜电位改变抑制的作用[J].中国药理学通报,2010,26(11):1459-1462.
[7] Kobayashi Y, Sekiguchi M, Konno SI. Effect of an Acid-sensing Ion Channels Inhibitor on Pain-related Behavior by Nucleus Pulposus Applied on the Nerve Root in Rats[J].(1976), 2017,42(11): E633-E641.
[8] Kang JD, Georgescu HI, Mcintyre-Larkin L,. Herniated lumbar intervertebral discs spontaneously produce matrix metalloproteinases, nitric oxide, interleukin-6, and prostaglandin E2[J].(1976), 1996,21(3):271-277.
[9] Takahashi H, Suguro T, Okazima Y,. Inflammatory cytokines in the herniated disc of the lumbar spine[J].(1976), 1996,21(2):218-224.
[10] Jha MK, Jeon S, Suk K. Glia as a Link between Neuro- inflammation and Neuropathic Pain[J]., 2012,12(2):41-47.
[11] 贾红玲,申伟,张永臣.基于数据挖掘技术分析腰椎间盘突出症的用穴特点[J].针灸临床杂志,2015,31(7): 71-75.
[12] 王志福,俞向梅,姚冉冉,等.SD大鼠坐骨神经体表定位及相关针刺穴位的应用解剖研究[J].福建中医药大学学报,2012,22(6):13-15.
[13] 何晓芬,蒋永亮,叶佳瑜,等.低频电针对SNI神经痛大鼠脊髓背角P物质表达的影响[J].上海针灸杂志, 2017,36(12):1469-1474.
[14] Ding CP, Guo YJ, Li HN,. Red nucleus interleukin-6 participates in the maintenance of neuropathic pain through JAK/STAT3 and ERK signaling pathways[J]., 2018,300:212-221.
[15] Si Y, Bao H, Han L,. Dexmedetomidine protects against renal ischemia and reperfusion injury by inhibiting the JAK/STAT signaling activation[J]., 2013,11:141.
[16] 张克英,唐君,方相春,等.JAK-STAT信号转导通路在神经系统疾病中作用的研究进展[J].神经解剖学杂志, 2014,30(2):237-240.
Effect of Electroacupuncture on Spinal JAK2-STAT3 Pathway in a Rat Model of Lumbar Intervertebral Disc Herniation
--,-,-,-.
,200233,
To observe the intervention effect of electroacupuncture in rats with lumbar intervertebral disc herniation (LIDH) and its effect on spinal Janus kinase 2 (JAK2)-signal transducer and activator of transcription 3 (STAT3) pathway.Forty-eight male Sprague-Dawley (SD) rats were randomized into a normal group, a sham operation group, a model group and an electroacupuncture group, with 12 rats in each group. Autologous nucleus pulposus transplantation was adopted to prepare the rat model of LIDH. The electroacupuncture group was intervened by electroacupuncture at Shenshu (BL23), Dachangshu (BL25), Huantiao (GB30) and Yanglingquan (GB34) on the right side. The right plantar mechanical paw withdrawal threshold (PWT) of rats in all groups was observed before modeling and 1, 3, 5, 7, 9, 11, 13 and 16 days after modeling. The expression of JAK2, phosphorylated JAK2 (p-JAK2), STAT3 and phosphorylated STAT3 (p-STAT3) in rat’s spinal cord were examined by using Western blotting method.The right PWT at different time points (1, 3, 5, 7, 9, 11, 13 and 16 days after modeling) in the model group and electroacupuncture group showed a downward trend, and then remained in a relatively stable range. The right PWTs at different time points (1, 3, 5, 7, 9, 11, 13 and 16 days after modeling) in the model group and electroacupuncture group were significantly different from those in the normal group and sham operation group (<0.05). The right PWTs at different time points (from day 7 till day 16 after modeling) in the electroacupuncture group were significantly different from those in the model group (<0.05). Compared with the normal group and sham operation group, the expressions of p-JAK2 and p-STAT3 proteins were significantly up-regulated at different time points (9 and 16 days after modeling) in the model group(<0.01). Compared with the model group, the expressions of p-JAK2 and p-STAT3 proteins decreased significantly at different time points (9 and 16 days after modeling) in the electroacupuncture group(<0.05,<0.01).Electroacupuncture can relieve neuralgia of LIDH rats, and the action mechanism is possibly related to the inhibition of spinal JAK2-STAT3 pathway.
Electroacupuncture; Lumbar disc intervertebral herniation; Intervertebral disc displacement, Lumbar; Janus kinase 2; Signal transducer and activator of transcription 3; Rats
1005-0957(2018)10-1207-05
R2-03
A
10.13460/j.issn.1005-0957.2018.10.1207
2018-06-03
上海市科学技术委员会科研计划项目(16401933900)
林元杰(1990—),男,2015级硕士生,Email:1034238903@qq.com
吴耀持(1961—),男,教授,博士生导师,Email:18930177222@163.com

