鲑鱼甲病毒逆转录环介导等温扩增(RT-LAMP)检测方法研究
刘艳华,任 彤,谈艳苗,张利峰
(北京出入境检验检疫局检验检疫技术中心,北京 100026)
鲑 鱼 甲 病 毒(Salmonid alphavirus,SAV)隶属于披膜病毒科(Togaviridae)甲病毒属(Alphavirus),是单股正链RNA病毒,基因组长11~12 kb,含有两个开放阅读框,具有5'端帽子和3'端polyA尾巴结构[1]。目前发现鲑鱼甲病毒有6种基因型(I、II、III、IV、V和VI型)[2],主要感染大西洋鲑(Salmo salar)、虹鳟(Oncorhynchus raykiss)和褐鳟(S. trutta)等鲑科鱼类,引起鲑鱼胰脏病(Salmon pancreas disease,PD),主要表现为胰腺炎、心肌炎和昏睡等症状,其临床症状和死亡率受水温和季节的影响[3]。自1976 年首次在苏格兰养殖的大西洋鲑鱼中报道发现PD以来,该病已在北美地区,以及挪威、爱尔兰、法国和西班牙等欧洲国家被确诊,致死率为1%~48%[4]。随着冷水鱼类养殖的不断发展和国际贸易的增加,SAV 有继续扩散的趋势。2013 年世界动物卫生组织(OIE)将鲑鱼甲病毒病列入法定通报的水生动物疫病名录。目前,SAV的检测方法主要有细胞培养法[5]、ELISA方法[6]、RT-PCR[7]方法和RT-qPCR法[8]等。
为提高检测效率,本研究以SAV保守基因片段为模板,设计LAMP引物,建立了一种SAV特异性的逆转录环介导等温扩增(Reverse transcription loop-mediated isothermal ampli fi cation,RT-LAMP)检测方法。
1 材料与方法
1.1 病毒RNA
SAV RNA由东北农业大学动物科学技术学院提供。
传染性鲑鱼贫血病毒(Infectious salmon anaemia virus,ISAV)、病毒性出血性败血症病毒(Viral haemorrhagic septicaemia virus,VHSV)、传染性造血器官坏死病毒(Infectious haematopoietic necrosis virus,IHNV)、病毒性 神经 坏死 病 病 毒(Viral nervous necrosis,VNNV)、草鱼呼肠孤病毒(Grass carp reovirus,GCRV)、鲤春病毒血症病毒(Spring viraemia of carp virus,SVCV)的RNA均由本实验室分离并保存。
1.2 引物设计
以 SAV nsP1(GenBank:AY604238.1) 基因序列保守片段(181 bp)为模板,使用在线软件 http∶//primerexplorer.jp/elamp4.0.0/index.html 和DNASTAR primer select 设计出3对引物(表1)。引物由上海生工有限公司合成。
1.3 反应体系

表1 根据SAV nsP1基因片段设计的RT-LAMP引物
体系为25 µL:RNA模板5 µL,10×反应缓冲液(含MgSQ480 mmol/L和dNTPs 14 mmol/L)2.5 µL,MgSQ4(100 mmol/L)1.5 µL,引物组(含SAV-FIP/BIP各16 μmol/L,SAV-F3/B3各2 μmol/L,SAV-LF/LB 各 4 μmol/L)各 2.5 µL,Bst 2.0 DNA聚合酶(8 000 U/mL)1 µL,AMV反转录酶1 µL(10 000 U/mL),去离子水11.5 µL。
1.4 反应温度优化
以SAV RNA为模板,分别在58、59、60、61、62、63、64、65、67和 69 ℃ 下 进 行 RTLAMP反应。使用浊度仪LA-320C(Lanpu Biotech,China)读取扩增结果。
1.5 检测结果可视化
在1.3反应体系基础上,加入终浓度10 mmol/L的钙黄绿素,体系仍为25 µL。将PCR管放置于烘箱中,反应温度为1.4确认的温度,反应时间为1 h,85 ℃灭活 5 min。
1.6 反应产物克隆及阳性对照制备
使用TIANgel Midi Puri fi cation Kit(TIANGEN,China)胶回收试剂盒,回收纯化引物SAV-F3和SAV-B3的PCR扩增片段,再将片段连接入pGem-T-Esay载体(Novigen),连接产物转化入DH5α中进行蓝白斑筛选。挑选白色菌落提取阳性重组质粒pGem-T-SAV作为RT-LAMP检测用阳性对照。使用微量紫外分光光度计,对重组质粒溶液进行定量,并按照以下公式将重组质粒的质量浓度换算为拷贝数浓度:
拷贝数浓度(copies/mL)=质量浓度(g/mL)×6.02 × 1023/MW(g/mol)
1.7 检测限
根据测量和换算的浓度,将重组质粒pGem-T-SAV溶液稀释为1011copies/µL,再将该溶液以10 倍梯度稀释至 100、101、102、103、104、106、107copies/µL;每稀释度各取5 µL分别进行RTLAMP反应和RT-PCR反应。RT-LAMP反应使用1.5的反应体系和1.4确认的反应温度,RT-PCR反应使用OIE水生动物疾病诊断手册(2018)[9]推荐的RT-PCR检测方法进行。
1.8 交叉反应
以 ISAV、VHSV、IHNV、VNNV、GCRV、SVCV的RNA为模板,各取5 µL分别进行RTLAMP检测(反应体系和温度同1.7)。
2 结果与分析
2.1 反应温度优化
64、65和67 ℃组反应26 min左右出现扩增曲线,为最早出现曲线的反应组,但67 ℃组的曲线线形不好;其他组扩增曲线出现的时间较晚,69 ℃甚至显示阴性。这有可能是当反应温度超过65 ℃时,体系内的反转录酶活性降低,使目的基因扩增效率降低,导致RT-LAMP扩增曲线吸光值较弱,甚至未检测到信号。根据优化试验结果,为提高引物与模板结合的特异性,RT-LAMP的反应条件确定为65 ℃恒温反应1 h,85 ℃灭活5 min(图1)。

图1 SAV RT-LAMP反应条件优化
2.2 检测结果可视化
反应体系内加入钙黄绿素后,检测结果显示,SAV呈绿色,其他样品未变色(图2)。

图2 荧光RT-LAMP检测SAV
2.3 检测限
反应条件为65 ℃恒温反应1 h,85 ℃灭活5 min。随着样品模板量的递减,样品变色时间也逐渐延长,模板稀释到10个拷贝数,PCR 扩增1 h后的结果仍为阳性;模板稀释到100,即1拷贝数时,扩增1 h后的结果则为阴性。由此可得出RT-LAMP检测限为10个拷贝数的目的基因核酸片段(图3)。

图3 RT-LAMP检测限
相对的,RT-PCR检测结果,模板稀释到102个拷贝数,结果为弱阳性;模板稀释到10个拷贝数,结果为阴性。因此RT-PCR的检测限为102个拷贝数的目的基因核酸片段,RT-LAMP的检测限是RT-PCR的10倍(图4)。
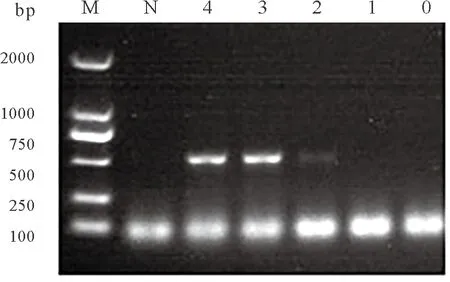
图4 RT-PCR检测限
2.4 交叉反应测试
交叉反应测试结果表明,只有以SAV RNA为模板时,RT-LAMP的反应才呈阳性,而以其他病毒RNA为模板时,反应结果则呈阴性,说明建立的SAV RT-LAMP检测方法特异性良好(图5)。

图5 RT-LAMP交叉反应检测结果
3 讨论与结论
SAV对我国来说是一种外来鱼类疫病病原,目前尚未分离到。随着我国鲑科鱼类养殖面积的逐步增大[10],以及国际鲑鱼进出口贸易量的不断增加[11],该病毒的传入风险逐渐加大,因此必须加强针对SAV的检验检疫工作,避免SAV传入我国[12]。在鱼病的检测工作中,样品量往往非常大,导致检测时间较长。为减轻工作量、提高检测效率,需要在保证检测限和特异性的基础上,建立比传统的RT-PCR方法、RT-qPCR方法和免疫学方法更方便快捷的检测方法。
环介导等温核酸扩增(Loop-mediated isothermal ampli fi cation,LAMP)可在1 h内,将少量拷贝数的目的基因扩增至109~1010个拷贝数,反应产物不仅可以通过浊度仪、real-time PCR仪及凝胶电泳仪进行检测,而且还可以通过SYBR Green I、钙黄绿素、羟基萘酚蓝染色后,进行肉眼识别[13]。因此近年来国内外陆续建立了多种针对水生动物病毒的LAMP检测方法,如疱疹病毒II型[14]、传染性造血组织坏死病毒[15]、真鲷虹彩病毒(RSIV)[16]等。
本研究建立的特异性SAV RT-LAMP检测方法,将病原RNA的反转录与LAMP扩增反应集中于同一反应体系,在恒温条件下一次性完成扩增。相对于传统的方法,该方法主要有以下四点优势:一是耗时短。RT-PCR方法检测SAV,需要3 h左右,RT-qPCR方法需要2 h左右。该RT-LAMP方法省去了制备琼脂糖凝胶、电泳等过程,反应只需要1 h。二是恒温即可完成整个检测过程,不需要PCR仪或荧光定量PCR等设备,检测成本较低。三是检测限比目前通用的RT-PCR检测方法高10倍。四是无需打开反应管电泳,降低气溶胶扩散风险。作为一种高效的核酸扩增技术,打开反应管取样的过程中有一定气溶胶污染风险[17],容易导致检测结果出现假阳性。该RT-LAMP检测技术使用钙黄绿色作为标记物,使阳性样品可显示肉眼可见的黄绿色,不需要打开反应管电泳等步骤,极大降低了气溶胶扩散的风险,可以有效避免核酸扩增结果出现假阳性[18]。
综上所述,本研究建立的SAV RT-LAMP检测方法,特异性强、检测限高、快捷经济、假阳性风险低,适合进出口鱼类大批量样品的临检工作。

