皮肤瘢痕癌组织中MDM2的表达及意义
李 慧,胡成久*
(1.济宁医学院附属医院肿瘤科,山东济宁 272029;2.济宁市第一人民医院病理科,山东 济宁 272011)
皮肤瘢痕癌是一种在皮肤病理性瘢痕基础上,被覆上皮发生癌变的恶性肿瘤。好发于四肢,以鳞状细胞癌(squamous cell carcinoma,SCC)最常见,其次是基底细胞癌(basal cell carcinoma,BCC)。据报道烧伤瘢痕大约有2%发生癌变[1],目前其发生机制尚不清楚。鼠双微体2(murine double minute 2, M DM2)是一种抑制细胞凋亡的癌基因,与肿瘤的发生发展密切相关。许多恶性肿瘤存在MDM2的高表达[2]。研究发现, M DM2基因异常能显著增加患非色素性皮肤癌的风险[3]。MDM2与皮肤病理性瘢痕癌变是否相关及作用机制,目前尚不清楚。本研究采用免疫组化法和RNA原位杂交技术,探讨MDM2蛋白和mRNA的表达与皮肤病理性瘢痕癌变的相关性。
1 材料与方法
1.1 材料
选取于2011年1月—2016年12月济宁市第一人民医院病理科的存档蜡块共45例。蜡块标本分为皮肤瘢痕癌、皮肤病理性瘢痕和正常皮肤3组。瘢痕癌为20例,从皮肤病理性瘢痕形成到癌变,时间长短不一,为3~21年,均为鳞状细胞癌;皮肤病理性瘢痕为15例,正常皮肤为10例。
1.2 主要试剂
鼠抗人MDM2单克隆抗体及二抗MaxVisionTM试剂盒,购于北京中杉金桥公司。MDM2 mRNA原位杂交试剂盒,购于武汉博士德生物公司。
1.3 实验方法
1.3.1 免疫组化染色法 食管癌组织为阳性对照,用PBS代替一抗为阴性对照。3组标本均4 μm切片,二甲苯脱蜡后水化,抗原修复,每张切片滴加20 μL MDM2抗体覆盖组织,4 ℃过夜,PBS缓冲液冲洗,滴加酶标二抗,室温20 min后冲洗,DAB显色,苏木素复染,脱水、透明、封片。染色结果由病理医生在光镜下观察并进行判读。
1.3.2 RNA原位杂交技术 用预杂交液代替探针为阴性对照,阳性对照同上。标本采用6 μm切片,每张切片滴加3%柠檬酸新鲜稀释的胃蛋白酶,37 ℃消化30 min,PBS冲 洗 后 固 定10 min, 滴 加20 μL MDM2 mRNA探针,40 ℃杂交过夜,杂交后洗涤,滴加生物素化鼠抗地高辛,37 ℃、60 min,相继滴加SABC及生物素化过氧化物酶,DAB显色,其余步骤同上。光镜下判读染色结果。
1.4 结果判断
MDM2蛋白以细胞核和(或)胞质出现棕黄或棕褐色颗粒判定为阳性;MDM2 mRNA以细胞质出现棕黄颗粒判定为阳性。采用半定量积分法,根据每张切片的阳性细胞百分数和染色强度计分的乘积来判定。根据积分判定为4个等级:≤2分为阴性(-),>2~3分为弱阳性(+),≥3~6分为阳性(++),≥6分为强阳性(+++)。
每张切片选取随机5个不同的高倍视野,运用计算机图像分析系统分别测出MDM2蛋白和mRNA阳性着色的平均光密度(opticai density,OD)和阳性面积与分析区域面积的比值(positive area/analysis area,PA),OD值越大即表达强度越高,PA值越大即表达水平越高,各取其平均值并记录实验数据。
1.5 统计学分析
2 结 果
2.1 MDM2蛋白的表达
免疫组化法检测MDM2蛋白表达,结果见图1。20例瘢痕癌标本中,14例强阳性,3例阳性,3例弱阳性;15例皮肤病理性瘢痕标本中,1例强阳性,9例阳性,3例弱阳性,2例阴性;10例正常皮肤标本中,7例阴性,3例弱阳性,弱阳性区仅见于基底层。
3组标本的表达强度OD值、表达水平PA值有显著性差异(FOD= 14.082, POD< 0.05; FPA= 10.419, PPA<0.05),在正常皮肤组、皮肤病理性瘢痕组、瘢痕癌组中的MDM2蛋白表达逐渐升高,组间 两 两比较,差异均有统计学意义(P<0.05),如表1所示。
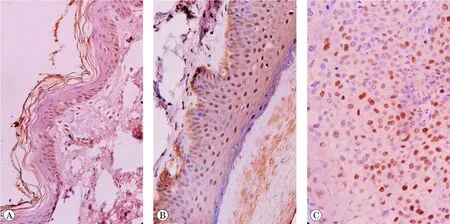
A:在正常皮肤表皮中MDM2蛋白呈弱阳性表达;B:在皮肤病理性瘢痕上皮中MDM2蛋白呈阳性表达;C:在皮肤瘢痕癌中MDM2蛋白呈强阳性表达.
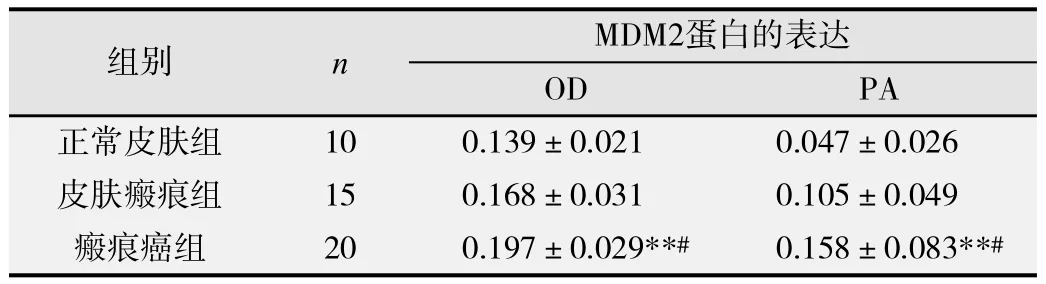
与正常皮肤组比较,**P<0.01;与皮肤瘢痕组比较, #P <0.01.
2.2 MDM2 mRNA的表达
RNA原位杂交法检测MDM2 mRNA表达,结果见图2。20例瘢痕癌组织标本中,15例阳性,4例弱阳性,1例阴性;15例皮肤病理性瘢痕标本中,1例阳性,12例弱阳性,2例阴性;10例正常皮肤标本中,9例阴性,1例弱阳性。
3组标本的MDM2 mRNA表达强度OD值、表达水平PA值差异显著(FOD= 16.009, POD< 0.05; FPA=20.819,PPA< 0.05),在正常皮肤组、皮肤病理性瘢痕组、瘢痕癌组中的MDM2 mRNA表达逐渐升高,组间 两 两比较,差异均有统计学意义(P<0.05)。如表2所示。
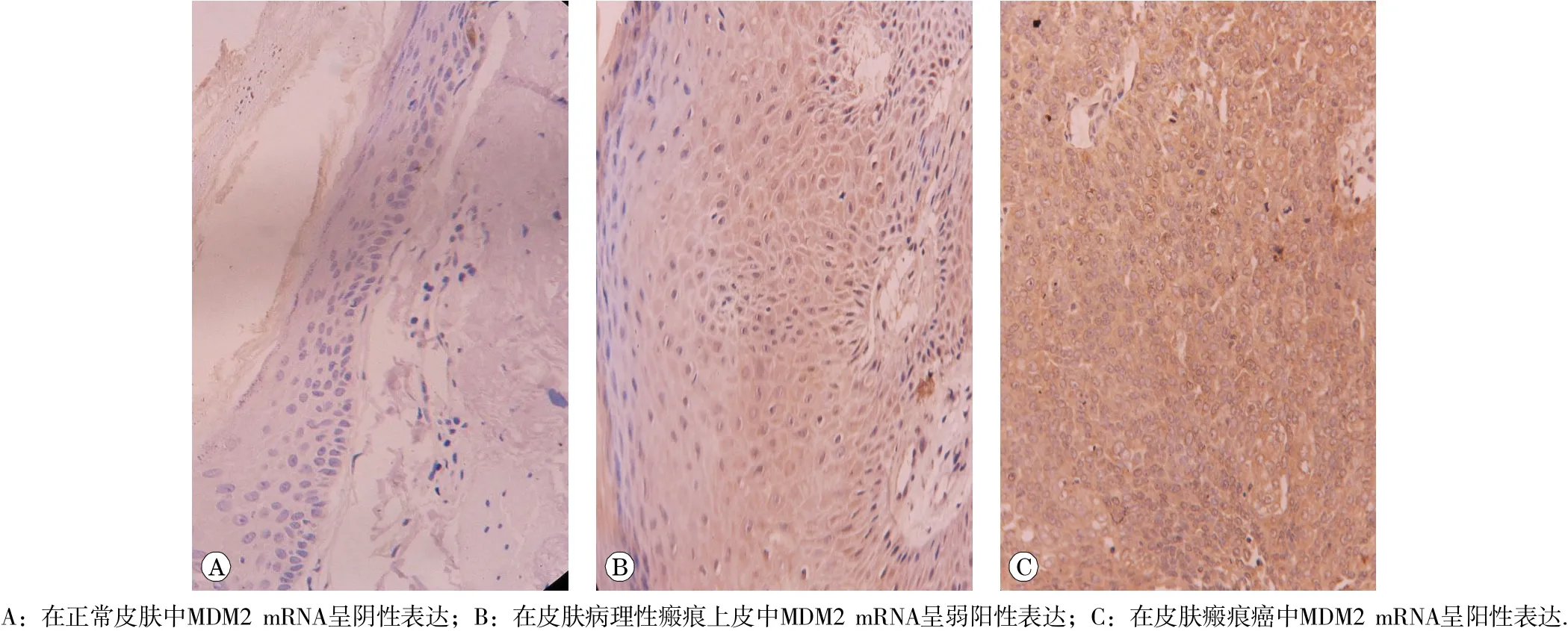
图2 RNA 原 位杂交检测M DM2 mRNA 的 表达情况(× 4 00)
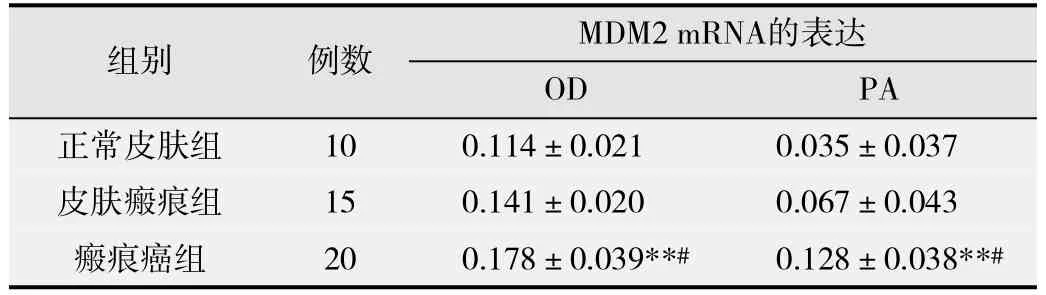
表2 MDM2 mRNA在 正常皮肤、皮肤病理性瘢痕和瘢痕癌中的表达(-x±s)
3 讨 论
MDM2是一种进化保守的癌基因,位于人染色体12q13~14区,其编码蛋白和抑癌基因 P 53之间通过负反馈调节环进行相互作用[4]。野生型P53能促进激活MDM2的转录功能,使MDM2蛋白合成增加及表达升高;同时,过表达的MDM2蛋白与野生型P53相互结合,阻碍了野生型 P 53基因的转录激活,使野生型P53蛋白合成减少并维持在低水平,显著降低其对肿瘤的抑制作用。另外,MDM2还能够通过激活E2F1促进细胞G1→S期的转变,加快细胞周期的循环[4-5]。因而, M DM2作为癌基因,既能增强肿瘤细胞的生存活力,又能促进肿瘤细胞的增生和生长。许多恶性肿瘤的发生与发展和癌基因 M DM2的作用相关[5]。Michalk等[6]对127例食管鳞状细胞癌采用定量PCR技术进行检测后发现,其中23例存在 M DM2基因的扩增和表达;Li等[7]通过药物减少小鼠皮肤黑色素瘤中MDM2的表达,与对照组比较,MDM2低表达抑制了肿瘤的生长;Wang等[8]运用腺病毒载体介导 M DM2基因沉默,使皮肤鳞状细胞癌的增殖得到有效控制,同时诱导了肿瘤细胞的凋亡。
本研究发现,正常皮肤组MDM2蛋白的表达为阴性或弱阳性,皮肤病理性瘢痕组MDM2蛋白的表达为阳性,瘢痕癌组MDM2蛋白的表达为强阳性;正常皮肤组MDM2 mRNA的表达大部分为阴性,皮肤病理性瘢痕组MDM2 mRNA的表达为弱阳性,瘢痕癌组MDM2 mRNA的表达为阳性。在正常皮肤、皮肤病理性瘢痕及瘢痕癌共3组样本的 m RNA水平和蛋白水平中,MDM2 均显示出表达强度、表达水平的逐渐升高趋势;瘢痕癌组分别与皮肤病理性瘢痕组、正常皮肤组相比较,均显著增高,差异有统计学意义(P<0.05)。提示瘢痕癌的发生可能与MDM2、MDM2 mRNA的持续高表达有关。可能的机制为 , MDM2的持续高表达阻遏了野生型 P 53基因的转录激活功能,并使野生型P53蛋白表达水平维持在低水平,同时,MDM2通过促进细胞G1向S期的转变使细胞周期的循环加速,异常细胞生存延长及增殖失控,导致瘢痕癌变及肿瘤的发生。
同时,皮肤病理性瘢痕组MDM2蛋白、MDM2 mRNA的表达水平均高于正常皮肤组,差异均有统计学意义(P<0.05),提示病理性瘢痕可能是一种癌前病变,检测MDM2蛋白、MDM2 mRNA水平有可能作为一个早期指标,预测皮肤病理性瘢痕癌变。

