食管鳞癌ECA109细胞中Survivin通过ERK信号通路调控c-myc基因表达的机制
闫 冬,吴怡娴,董娟娟,李秀梅,封 敏*
(1. 新疆医科大学药学院,新疆 乌鲁木齐830011;2. 新疆医科大学基础医学院,新疆乌鲁木齐 830011;3. 新疆医科大学附属肿瘤医院,新疆 乌鲁木齐 830000)
食管癌的发生发展是多基因参与、信号传导调控网络失调的结果,Survivin、c-myc在多种肿瘤的发生发展中表达上调,但Survivin、c-myc共同高表达的机制并不十分清楚,在前期试验中我们发现Survivin通过调控核因子(nuclear Factor-κB ,NF-κB)的上游关键激酶IKK激酶(IκB kinase)的转录而影响NF-κB蛋白的活化状态[1],充分说明在肿瘤信号传导网络中,Survivin是一个潜在的调控分子。Survivin是目前发现的最强凋亡抑制因子,在正常组织中低表达, c -myc是 原癌基因,其异常扩增及点突变可以促进肿瘤细胞的分裂增值。在哈萨克族食管癌组织中Survivin高表达与cmyc表达正相关, c- myc基 因表达调控与ERK信号通路相关[2]。Survivin调控细胞凋亡和细胞周期的功能研究较为透彻,但其作为一个潜在的转录调控因子,在信号通路中的作用并不清楚,鉴于此我们推测Survivin作为潜在的转录调控因子,可能对c-myc具有调控作用。故本实验采用shRNA技术沉默食管癌ECA109细胞中Survivin的表达后观察c-myc及ERK激酶活化蛋白的表达变化,初步探讨Survivin对c-myc的调控作用。
1 材料与方法
1.1 细胞株、引物与试剂
食管癌ECA109细胞系由新疆医科大学科研中心提供,Survivin短发夹RNA质粒(Survivin shRNA plasmid)、阴性短发夹RNA质粒(control shRNA plasmid)、脂质体转染试剂(shRNA plasmid transfection reagent),均购于美国Santa Cruz公司;ERK信号通路阻断剂PD98059、p38信号通路阻断剂SB203580、PI3K信号通路阻断剂LY294002、JNK信号传导通路特异阻断剂SP600125、JAK阻断剂AG490均购于德国Sigma公司,兔抗人Survivin、兔抗人c-myc抗体、羊抗兔IgG抗体均购于武汉博士德公司,PCR扩增引物购于上海生物工程有限公司。PCR引物序列、产物片段长度及退火温度如表1。

表1 PCR引物序列、产物片段长度及反应条件
1.2 实验方法
1.2.1 细胞培养 食管癌ECA109细胞培养于含10%小牛血清以及100 U/mL青霉素、100 U/mL链霉素的RPMI 1640培养液中,37 ℃、CO2体积分数为5%的培养箱内培养,细胞长至对数生长期用于实验。
1.2.2 shRNA转染实验 分为Survivin shRNA干扰组、阴性质粒对照组、空白细胞株(未加任何处理的食管癌ECA109细胞),每组设置3个复孔。将2 μg Survivin shRNA plasmid和4 μL shRNA plasmid transfection reagent分别用100 μL无血清DMEM 稀释,5 min后将稀释好的Survivin shRNA和shRNA plasmid transfection reagent混匀,室温放置30 min备用。阴性质粒制备方法同前。将转染混合物缓慢的逐滴加入食管癌ECA109细胞中,轻轻晃动,放入37 ℃、CO2体积分数为5%的培养箱中孵育24 h后,用5 μg/μL的嘌呤霉素筛选细胞株,继续培养24 h。
1.2.3 细胞总RNA提取、逆转录及RT-PCR收集各组细胞,采用Trizol试剂一步法提取总RNA,紫外分光光度计测定其纯度。以提取的总RNA为模板,按逆转录试剂盒说明书进行逆转录。以得到的cDNA为模板进行PCR扩增。反应体系为20 μL,其中cDNA模板2 μL,待扩增基因上下引物各1 μL,即用型PCR反应试剂盒反应溶液(2倍浓度)10 μL,双蒸水6 μL,扩增反应结束后进行2%琼脂糖凝胶电泳,凝胶成像仪成像分析。
1.2.4 Western blot检测 收集细胞、加入RIPA裂解缓冲液,冰上裂解30 min,低温离心,取上清分装,BCA蛋白定量试剂盒测定蛋白浓度。蛋白变性,把蛋白样品上样到SDS-PAGE胶加样孔内,电压100 V,时间90~120 min。然后转膜、封闭、一抗孵育(兔抗人Survivin、兔抗人c-myc抗体,1∶400),二抗孵育(羊抗兔IgG抗体,1∶400),X光曝光成像,Quantity One软件分析目标。
1.2.5 信号通路抑制剂的配置及分组 将PD98059、SB203580、LY294002、SP600125、AG490干粉充分溶解于DMSO溶液中,配制成1 mg/mL的储存液,于-20℃冰箱保存,使用前稀释成指定的浓度。待细胞生长至汇合度为70%~80%时,更换为含0.1% FBS的1640培养基24 h使细胞同步化,根据分组情况分别加入干预剂,终浓度为50 μmol/L,24 h后收集细胞。
1.3 统计学方法
- 采 用SPSS 16.0统计软件包进行统计学分析,结果以x± s 表 示,各基因的组间比较采用t 检验;基因间表达的相关性分析采用Spearman相关;以 α=0.05为检验水准。
2 结 果
2.1 Survivin shRNA干扰后各组Survivin、c-myc mRNA及蛋白的表达
Survivin shRNA转染48 h,Survivin mRNA及蛋白表达水平明显下调,与阴性质粒对照组和空白对照组比较差异显著(P<0.01);c-myc mRNA及蛋白表达受到抑制,表达下调,差异有统计学意义(P<0.05)。见图1、图2、表2、表3。

图1 RT-PCR 法 检测各组 S urvivin 和 c-myc mRNA 的表达
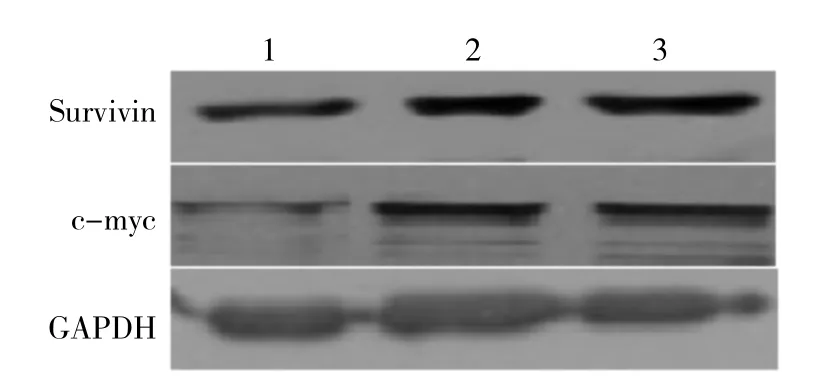
图2 Western blot法 检测各组S urvivin 和 c- myc 蛋白的表达

表2 Survivin shRNA 干 扰后各组S urvivin 和 c-myc mRNA 的表达变化

表3 Survivin shRNA 干 扰后各组S urvivin 和 c-myc 蛋白的表达变化
2.2 信号通路抑制剂处理各组细胞后c-myc的表达
各信号传导通路特异阻断剂PD98059、SB203580、 LY294002、 SP600125、 AG490作 用 24 h后,PD98059抑制剂组 c- myc基 因的表达明显降低,与空白组比较差异具有统计学意义(P<0.05)。其余各组未见明显差异。见图3和表3。
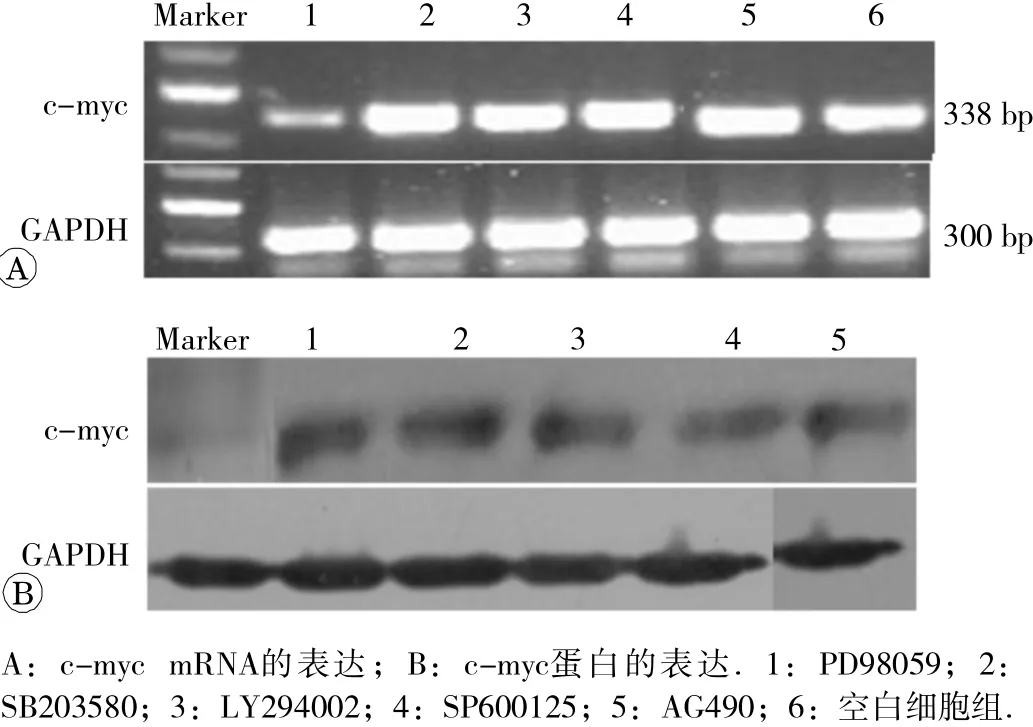
图3 信 号通路抑制剂干预组 c- myc的表达

表 信号通路抑制剂干预组 的表达
2.3 Survivin shRNA干扰后ERK磷酸化蛋白的表达
Western blot电泳结果显示,Survivin shRNA转染后48 h,与空白对照组(1.59±0.28)和阴性质粒对照组(1.63±0.87)比较,p-ERK蛋白磷酸化水平(0.87±0.46)明显降低,差异显著(P<0.05),提示ERK蛋白活化抑制(见图4)。
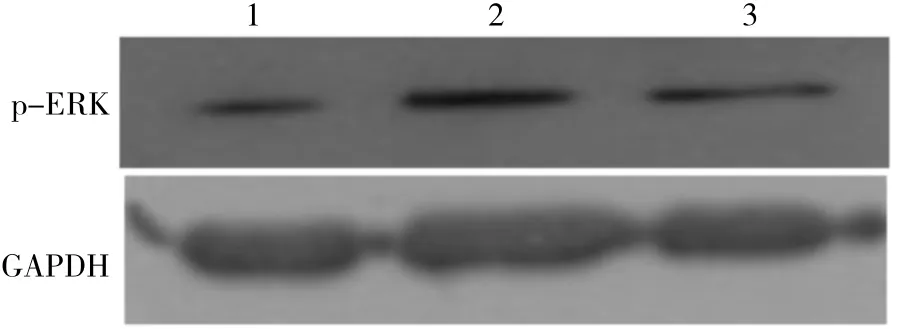
图4 Survivin shRNA 干扰ERK蛋白磷酸化的表达
3 讨 论
本课题组前期实验结果显示在哈萨克族食管癌组织中Survivin与c-myc表达明显上调,且二者的表达呈正相关,提示Survivin、c-myc可能协同发挥作用,促进细胞分裂增殖和抑制细胞凋亡。Survivin和c-myc这种协同表达现象也见于其他肿瘤中[3-4],但机制并不清楚。
RNA干扰(RNA interference,RNAi)是一种由内源性或外源性的双链RNA分子(double s trand RNA,dsRNA)介导,特异性降解相应序列的mRNA,阻断或降低同源基因表达,产生相应的功能缺失现象,RNAi是生物界普遍存在的一种调控基因表达的有效方式和鉴定基因功能的重要手段。利用RNAi技术可以容易地确定复杂的信号转导途径中相关基因的上下游关系及其作用,因此成为研究细胞信号传导通路的新途经[5]。我们将Survivin shRNA质粒转染食管癌细胞株48 h后,Survivin mRNA及蛋白表达下调,c-myc mRNA及蛋白表达明显降低,提示在食管癌ECA109细胞内Survivin具有调控 c- myc基 因表达的作用。在多种肿瘤组织中Survivin与c-myc表达具有一致性,在肿瘤中可能起协同作用,我们推测高表达的Survivin可通过调控作用激活c-myc表达,而c-myc过度表达可以直接激活CDK4、cyclin D/E/A、细胞分裂周期25A等细胞周期基因的表达,从而促进细胞增殖、分裂[6-7]。采用shRNA技术下调Survivin表达后,其对c-myc激活的作用消失或减弱,从而c-myc的表达也明显下调,呈现一致性。
ERK通路、JNK通路、p38通路 和 JAK/STAT通路、PI3K通路是目前研究较多的将细胞表面信号转导至细胞核的信号转导途径,这些信号转导通路激活后都能作用于转录因子,调节特定的基因表达。我们采用ERK1/2信号传导通路特异阻断剂PD98059、p38信号传导通路特异阻断剂SB203580、JNK信号传导通路特异阻断剂SP600125、PI3K的特异阻断剂LY294002,JAK化学阻断剂AG490分别阻断了ERK、p38、JNK、PI3K、JAK/STAT信号传导通路关键激酶ERK、p38、JNK、PI3K、STAT3的活化,RT-PCR、Western-blot结果显示PD98059抑制剂组c-myc mRNA和蛋白的表达降低,与空白细胞组相比差异显著,提示 c- myc是 ERK信号传导通路的下游靶基因。ERK通路是MAPK家族的经典转导通路之一[8-10],在肿瘤细胞凋亡、分化、侵袭转移中发挥重要作用。ERK包括ERK1和ERK2两种异构体,其活性形式是磷酸化ERK(p-ERK),在受到如细胞因子、生长因子激素、丝裂原受体和缺氧等刺激时,ERK发生磷酸化,并从胞浆移位至细胞核作用于c-myc、AP-1等转录因子,促进相关基因的转录与表达,从而诱发多种癌基因的相继激活,导致细胞的恶性转化,在肝细胞癌的研究中发现[11]上调癌细胞内Ras-ERK通路的磷酸化水平,癌基因 c -myc表 达增加,我们试验结果再次证实了c-myc的表达受ERK的调控。Survivin对 c- myc这 个癌基因在转录及蛋白水平具有正向调控作用,而c-myc的表达受ERK的调控,故我们进一步检测了Survivin shRNA沉默下调Survivin后ERK磷酸化的蛋白水平,发现p-ERK活化受到抑制,提示Survivin对c-myc的调控作用可能与ERK信号通路有关,ERK蛋白的活化状态是ERK信号传导通路中的关键点,目前多种肿瘤药物都是以信号通路中的关键激酶为靶点,从而阻断其诱导的生物学效应。Survivin作为多条信号传导通路的下游效应分子[12-13],其高表达导致肿瘤细胞凋亡受到抑制,肿瘤细胞异常增殖,但其作为调控因子的研究并不多见,本实验发现Survivin的表达可以影响ERK磷酸化水平,提示在基因调控网络中,基因与信号通路的关系可能不单单是一种单向调节的作用,高表达的Survivin可能通过影响ERK磷酸化水平从而调节其下游靶基因 c-myc的 表达水平。基因调控网络是一个庞大、作用复杂的系统,我们的研究仅仅证实了Survivin具有影响ERK磷酸化的作用,但其具体作用机制尚待进一步深入研究。

