miR-34a及其下游基因在铁超载大鼠非酒精性脂肪肝发生过程中的作用
曹 玥,孙梦云,蔡静明,张立加,赵 艳*
(哈尔滨医科大学公共卫生学院营养与食品卫生学教研室,黑龙江 哈尔滨 150081)
microRNA作为一类内源性非编码单链小分子RNA,是基因调控网络的重要参与者和调节者[1-3]。近年来发现,microRNA可参与脂代谢,从而调节非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)的发生发展[4-5]。NAFLD被认为是与胰岛素抵抗、肥胖和血脂异常等密切相关的一种临床病理综合征,但其发病机制尚未完全阐明[6-8]。
miR-34a参与多种病理生理过程,如脂肪酸氧化和合成,脂肪和胆固醇代谢以及细胞凋亡等。研究显示,miR-34a可能与NAFLD的发生发展相关[9]。沉默信息调节因子1(silent information regulator 1,SIRT1)是烟酰胺腺嘌呤二核苷酸(NAD+)依赖的组蛋白去乙酰化酶,已被证实为miR-34a的靶基因之一,也是miR-34a特征性的直接作用靶点[10]。SIRT1可改善外周胰岛素抵抗、调节肝脏脂质代谢、改善氧化应激及线粒体功能障碍和减弱炎症反应等,从而在改善NAFLD肝脏病变中起着重要作用[11]。
目前已经发现miR-34a 在NAFLD的发生发展中起着重要的调节作用,但在铁超载大鼠NAFLD发生中的作用尚不清楚。本研究在高脂饮食诱导大鼠建立NAFLD模型的基础上,给予高铁饮食干预,观察miR-34a及其下游基因在大鼠肝脏中的表达情况,进一步探讨NAFLD的发病机制。
1 材料与方法
1.1 实验动物及试剂
5周龄清洁级雄性SD大鼠36只,体质量150 g左右,由北京维通利华实验动物技术有限公司提供,动物合格证号:SCXK(京)2012-0001。血清丙氨酸氨基转移酶(alanine aminotransferase,ALT)和天门冬氨酸氨基转移酶(aspartate transaminase,AST)测定试剂盒购于日本Wako公司;SIRT1兔单克隆抗体购于美国Cell Signaling公司 ; 过氧化物酶体增殖物激活受体α(peroxisome proliferator-activated receptor α, PPARα)兔多克隆抗体购于英国Abcam公司 ; β-actin兔多克隆抗体购于美国Santa Cruz公司; 辣根过氧化物酶标记的二抗购于中杉金桥公司;miRNeasy Mini试剂盒购于QIAGEN公司 ; 引物购于上海捷瑞生物工程有限公司 ; High Capacity cDNA RT和POWER SYBR GREEN购于Applied Biosystem公司。
1.2 主要仪器
全自动生化分析仪,中国日立有限公司;组织匀浆器,美国MP BIO公司;FluorChem E数字成像仪,美国Protein Simple公司;核酸测定仪,Gene Company Limited公司;实时荧光定量PCR仪,美国ABI 7500 Fast。
1.3 动物饲料
动物饲料为合成饲料。基础饲料参考Research Diets D12450H饲料配方,脂肪供能比为10%;高脂饲料参考Research Diets D12451饲料配方,脂肪供能比为35%;高铁饲料是在基础饲料中添加1%硫酸亚铁(FeSO4·7H2O);高脂高铁饲料是在高脂饲料中添加1%硫酸亚铁(FeSO4· 7H2O)。高脂饲料成分包括:酪蛋白(200 g/kg)、L-胱氨酸(3 g/kg)、玉米淀粉(72.8 g/kg)、麦芽糖糊精(100 g/kg)、蔗糖(172.8 g/kg)、纤维素(50 g/kg)、豆油(50 g/kg)、猪油(177.5 g/kg)、矿物质混合物(10 g/kg)、磷酸二钙(13 g/kg)、磷酸钙(5.5 g/kg)、柠檬酸钾(16.5 g/kg)、维生素混合物(10 g/kg)、猪胆盐(4 g/kg)、胆固醇(1.3 g/kg)。
1.4 实验动物分组及方法
适应性喂养1周后,按大鼠体质量随机分为:空白对照组(基础饲料)、高铁组(含1% FeSO4的基础饲料)、高脂组(脂肪供能比为35%的高脂饲料)、高脂高铁组(含1% FeSO4的高脂饲料),每组9只。每周称量大鼠体质量,12周末剔除肥胖抵抗大鼠4只,采用戊巴比妥钠腹腔注射麻醉,腹主动脉取血。摘取肝脏,称取质量后部分肝组织于4%多聚甲醛溶液中固定保存,剩余部分于液氮中冷冻,保存于-80 ℃冰箱。
1.5 大鼠肝脏油红O染色
采用肝脏油红O染色观察大鼠肝脏中脂质堆积程度。分别取各组用4%多聚甲醛溶液固定好的肝脏约50 mg,并用10%、20%和30%的蔗糖溶液进行梯度脱水,切片约10 µm,油红O染色10 min,经60%异丙醇分化后,双蒸水洗涤1~2 min,苏木精复染1 min,甘油明胶封片,光学显微镜下观察。
1.6 血清ALT、AST含量测定
取实验大鼠血清300 µL于全自动生化分析仪检测大鼠血清中ALT和AST的水平。
1.7 实时荧光定量PCR检测miR-34a及其下游基因的表达
分别取每只大鼠新鲜冰冻肝组织25 mg,使用miRNeasy Mini试剂盒提取总RNA,测定RNA纯度及浓度后,根据High Capacity cDNA RT逆转录试剂盒使用说明将RNA样品逆转录为cDNA。再以cDNA为模板,使用POWER SYBR GREEN试剂盒,进行实时荧光定量PCR(quantitative real-time PCR,qPCR)。反应条件为:95 ℃、10 min;95 ℃、15 s;60 ℃、60 s(40个循环),分别采用 U 6 和 β-actin为 内参照基因进行校准。用2-△△CT法计算目的基因的表达量,△△ CT=(CT, 实验组目的基因- CT,实验组内参) -(CT,对照组目的基因- CT,对照组内参)。相关引物序列见表1。

表1 实 时荧光定量 P CR引物序列
1.8 Western blot法检测miR-34a下游SIRT1和PPARα蛋白的表达
称取100 m g冰冻的大鼠肝组织,使用组织匀浆器充分匀浆,用强效裂解液在冰上裂解1 h后,4 ℃、15 000 r/min离心15 min,取上清,采用BCA法测定蛋白浓度。蛋白样品加入上样缓冲液,加热变性后等量上样,经SDS聚丙烯酰胺凝胶电泳,4 ℃转膜。5%脱脂奶粉封闭1 h,加入SIRT1、PPAR α、 β -actin一抗4 ℃过夜,用TBST漂洗3次。加入二抗,室温孵育1 h,TBST中漂洗3次。ECL法显色,数字成像仪拍照。
1.9 统计学处理
2 结 果
2.1 高脂高铁饮食对大鼠体质量的影响
实验开始时各组大鼠体质量无统计学差异,12周时高脂组和高脂高铁组大鼠体质量均明显高于对照组(P<0.05)。见图1。
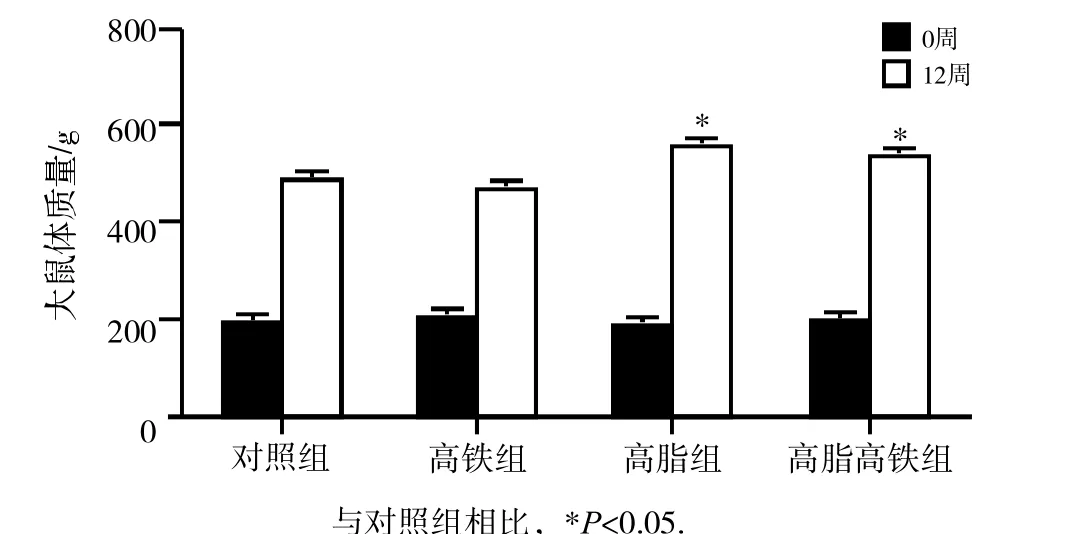
图1 高脂高铁饮食对大鼠体质量的影响
2.2 大鼠肝脏油红O染色结果
大鼠肝脏油红O染色结果显示,与对照组相比,高脂组与高脂高铁组肝脏内红色脂滴的数量明显增加且体积增大,高脂高铁组脂滴体积大于高脂组。见图2。
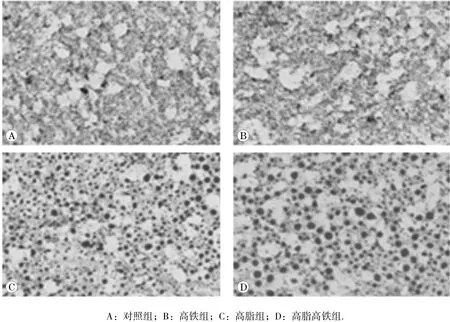
图2 高 脂高铁饮食对大鼠肝脏的影响(油红 O 染 色,×200)
2.3 高脂高铁饮食对大鼠肝功能酶的影响
大鼠血清ALT和AST检测结果显示,高脂组和高脂高铁组大鼠血清ALT含量明显高于对照组(P<0.05),而血清AST含量在各组间差异无统计学意义(P>0.05)。见图3。

与对照组相比,*<0.05.P
2.4 高脂高铁饮食对大鼠肝脏miR-34a表达的影响
qPCR检测miR-34a的表达结果显示,高脂组和高脂高铁组大鼠肝脏中miR-34a表达水平明显高于对照组(P<0.05)。见图4。

2.5 高脂高铁饮食对大鼠肝脏SIRT1和PPARα表达的影响
与对照组相比,高铁组、高脂组和高脂高铁组大鼠肝脏中SIRT1 mRNA及蛋白表达均显著降低(P均<0.05);与高脂组相比,高脂高铁组大鼠肝脏中SIRT1的mRNA及蛋白表达水平也明显降低(P均<0.05)。见图5A和5B。
与对照组相比,高脂高铁组大鼠肝脏中PPARα mRNA和蛋白表达均明显降低(P均<0.05), 高脂组仅PPARα蛋白表达水平显著降低(P<0.05);与高脂组相比,高脂高铁组大鼠肝脏中PPARα mRNA及蛋白表达水平均明显降低( P 均<0.05)。见图5C和5D。
3 讨 论
NAFLD的显著特征是脂肪在肝细胞内过度沉积[12-14]。本研究采用高脂饮食诱导SD大鼠建立NAFLD动物模型,在12周的干预期内,大鼠体质量明显增加,肝组织内脂滴数量明显增多,体积明显增大,表明NAFLD大鼠模型成功建立,而且高脂高铁联合作用后,出现了更为明显的脂质堆积,表明铁超载加重了肝脏脂质沉积。
ALT与AST均为非特异性细胞内功能酶,主要分布于肝细胞内,当肝细胞受损时,其内所含ALT和AST释放入血,引起血液中ALT和AST浓度升高。为观察高脂高铁膳食对大鼠肝脏功能的影响,我们对大鼠血清ALT和AST含量进行检测。结果显示,高脂组和高脂高铁组大鼠血清ALT含量明显高于对照组。由此说明,随着干预时间延长,单纯高脂和高脂高铁膳食对大鼠肝功能的损伤加重。
研究发现,NAFLD患者的肝组织中miR-34a的表达显著上升[15]。 Shan等[16]发现,在高脂饮食诱导的NAFLD大鼠肝脏中miR-34a表达也上调。本研究结果显示,高脂组和高脂高铁联合组大鼠肝组织中miR-34a 的表达水平较对照组均显著上调,与上述结果一致。我们还发现,高脂和高脂高铁饮食可抑制大鼠肝脏SIRT1的表达。SIRT1作为miR-34a特征性靶点,在调节肝脏脂质代谢中发挥着重要的作用,并且miR-34a上调会抑制SIRT1的表达[17-18]。SIRT1下游的靶基因PPARα对于促进脂肪酸 β氧化,加速脂肪酸分解,以及减少氧化应激和抑制炎症反应起到关键作用[19-21]。本研究显示,在高脂组和高脂高铁联合组大鼠肝组织中,SIRT1表达下调会抑制下游靶基因 P PARα的表达,并且高脂高铁组与高脂组相比下降更明显。与高糖高脂饮食可下调非酒精性脂肪肝炎(nonalcoholic steatohepatitis,NASH)大鼠肝脏PPAR α的表达,从而增加脂质蓄积和氧化应激的结果一致[22]。
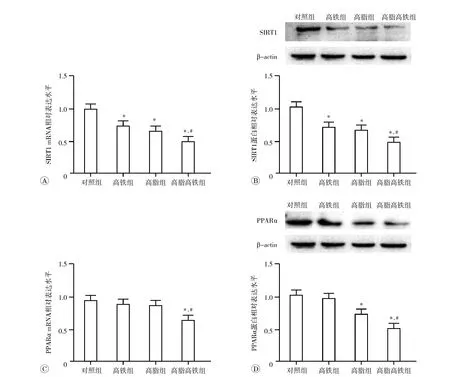
A:SIRT1 mRNA水平;B:SIRT1蛋白表达水平;C:PPARα mRNA水平;D:PPARα蛋白表达水平. 与对照组相比,*P<0.05;与高脂组相比,#P<0.05.
本研究结果提示,激活miR-34a及其下游基因的表达,可能是导致NAFLD大鼠肝脏脂质代谢紊乱,过量脂质在肝脏沉积的重要因素。高脂高铁联合作用后,miR-34a及其下游基因表达水平变化更为显著,肝脏脂肪堆积及损伤程度也更严重,表明高脂高铁联合作用可能进一步激活了miR-34a表达,进而抑制了其下游基因的表达,因此加重了NAFLD大鼠肝脏脂肪变性的程度。
综上所述,高脂饮食能够成功诱导大鼠NAFLD模型,铁超载可进一步改变大鼠脂质代谢过程,激活miR-34a表达,进而抑制其下游基因的表达,从而加重脂代谢紊乱,造成肝脏内脂质累积,并使肝脏损伤程度加重,促进NAFLD的发生发展,但其机制还有待于进一步研究和证实。

