2,4-二氯苯氧乙酸对初断乳SD大鼠生殖器官发育的影响及相关机制
苟 练,张梦云,刘科亮,庞定国,刘丽达,徐培渝,*
(1. 四川大学华西公共卫生学院营养食品卫生与毒理学系,四川 成都 610041;2. 苏州瑞博生物技术有限公司药代毒理部,北京 100085;3. 四川省疾病预防与控制中心毒理所,四川 成都 610041)
2,4-二氯苯氧乙酸(2,4-dichlorophenoxyacetic acid,2,4-D),又称2,4-D滴或2,4-D酸,是一种低毒型农药。其低剂量可作为植物生长调节剂,能促进果实生长,提高果实率,并延缓果实衰老;高浓度时2,4-D可用作除草剂,鉴于此,被广泛应用于世界各地果蔬产业。2,4-D在自然界中不易分解,且随着使用量的剧增,其残留率大于分解率而积聚在土壤及空气中,对机体和环境存在潜在危害。研究表明,2,4-D对皮肤和眼睛均有刺激作用,急性经口毒性表现为神经毒性,亚慢性毒性主要表现为对血液、肝、肾等毒性及抑制某些酶的活力,并能抑制某些蛋白质的合成[1];2,4-D会诱导体内产生氧化应激进而导致癌症或者其他慢性疾病[2]。流行病学报告指出,长期暴露2,4-D的农民患非何杰金淋巴瘤的风险增加[3-6],帕金森与膀胱癌发病率也增加[7-9]。
国内外关于2,4-D的研究主要集中在发育毒性方面,涉及生殖毒性的研究较少。有研究发现,胚胎期接触2,4-D可影响胎儿头骨、胸骨、掌骨和跖骨骨化的延迟、泌尿生殖道畸形、吸收胎与死胎增多[10]。2,4-D还可干扰青蛙性激素和阻止蛙卵成熟[11],抑制精子功能[12],引起精子功能障碍和不孕症等[13]。因此,本研究拟探讨2,4-D对初断乳SD大鼠生殖器官发育是否具有毒性以及毒作用的相关机制,为评价2,4-D的安全性提供数据支持。
1 材料与方法
1.1 试验动物
SPF级刚断乳(21 d)SD大鼠,体质量50~70 g,由四川省中医药科学院实验动物中心提供,合格证号SCXK(川)2008-19。幼鼠适应性喂养3 d后进行试验,饲养于屏障级动物房,许可证号SYXK(川)2011-043。动物自由饮水和摄食,饲养室温度控制在20~24 ℃,相对湿度保持在55%~65%之间。
1.2 受试物与主要试剂
2,4-D原药购自北京精华耀邦医药科技有限公司(纯度98%,CAS号94-75-7);卵泡刺激素(folliclestimulating hormone,FSH)、促黄体生成素(luteotropic hormone, LH)、 雌 二 醇 (estradiol, E2)、 睾 酮(testosterone,T)定量检测试剂盒(化学发光法)购自德国拜耳医药公司;总胆固醇检测试剂盒(酶法)购自北京世纪沃德生物科技有限公司;苏木精-伊红染色(HE)试剂均购自成都博奥维新生物科技有限公司。
1.3 实验动物分组和染毒方法
将SD幼鼠适应性饲养3 d后,随机分为4组,每组20只,雌雄各半,实验设2,4-D 低剂量组(18.125 mg/kg)、中剂量组(36.25 mg/kg)、高剂量组(72.5 mg/kg)3个染毒组和溶剂对照组,用1%羧甲基纤维素作为样品溶剂,各组动物按1 mL/100 g每天经口灌胃1次,连续染毒28 d,每周称体质量2次。
1.4 检测指标
1.4.1 一般观察 每日观察试验动物的一般行为,大小便及中毒症状等。
1.4.2 生殖器官发育观察 观察并记录每只雌性大鼠阴道开口的时间,同时计算染毒28 d后雌性大鼠阴道开口率。实验结束时,用真空采血管股动脉取血5 mL后,将动物处死,立即分离出雌鼠卵巢、子宫,雄鼠的附睾、睾丸,称取质量并计算脏器系数,然后将脏器置入装有40 mL 10%甲醛的细口瓶中固定。待检标本进行石蜡包埋,横断面切片,HE染色。
1.4.3 血清中性激素的测定 将股动脉血800 r/min离心5 min,取血清上清液测定SD大鼠的FSH、LH、E2、T(利用德国西门子拜耳化学发光仪ADVIA Centaur进行测定)和胆固醇(采用全自动生化仪进行)含量,具体操作严格按照试剂盒说明书进行。
1.4.4 病理学观察 将子宫、卵巢、睾丸和附睾固定于浓度为10%的甲醛溶液中,依次经酒精脱水,二甲苯透明,石蜡包埋之后切片(厚5 μm),常规苏木精-伊红(HE)染色,光镜下观察。
1.5 统计学方法
采- 用 SPSS 17.0 for Windows软件进行统计分析,结果以x± s 表 示,组间比较采用方差分析,以Dunnett-t进行各剂量组与对照组的两两比较;率的比较用 χ2检验。检验水准 α=0.05。
2 结 果
2.1 一般情况
实验期间各组动物除72.5 mg/kg组以外,其余组动物活动状态良好,均未出现死亡。与对照组比较,在染毒28 d内,2,4-D 18.125与36.25 mg/kg组大鼠染毒后体质量增长无明显差异,但72.5 mg/kg组动物于染毒第7天起,体质量增长速度明显较对照组有所减缓,36.25 mg/kg组雄鼠于染毒第21天体质量增长速度较对照组明显减缓,至染毒28 d结束时,36.25 mg/kg组雄性大鼠、72.5 mg/kg组雄鼠和雌鼠体质量较对照组明显降低,差异均有统计学意义(P<0.05),如图1所示。
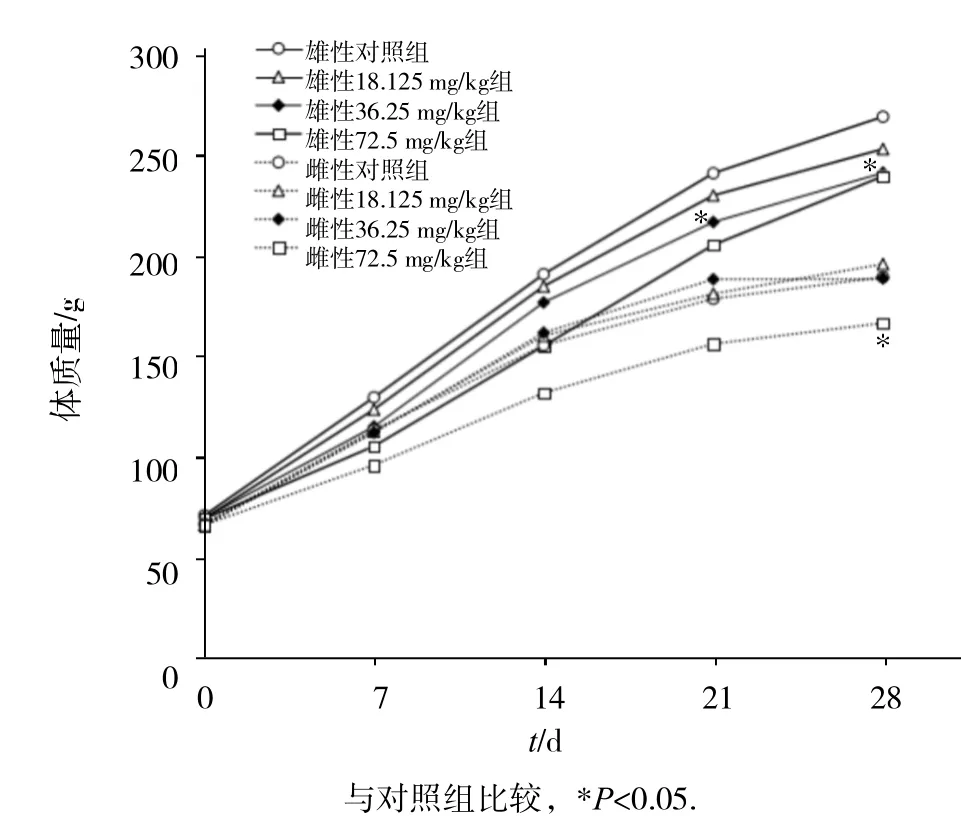
图 染毒对大鼠体质量的影响(- )12,4-D x s±
2.2 2,4-D染毒对大鼠睾丸、附睾、子宫、卵巢质量及脏器系数的影响
随着2,4-D染毒剂量的增加,睾丸、附睾、子宫和卵巢的湿质量均呈递减趋势,与对照组比较,72.5 mg/kg 2,4-D染毒组雄鼠睾丸和雌鼠子宫湿质量均明显降低,差异均有统计学意义(P<0.05),见图2和图3;但各染毒组大鼠上述各器官的脏器系数与对照组比较无明显差异(P 均 >0.05)。
2.3 2,4-D染毒对雌性大鼠阴道开口时间及开口率的影响
对照组大鼠于染毒第11天(35日龄)开始出现阴道开口,染毒第14天(38日龄)所有大鼠的阴道开口完毕;36.25 mg/kg 2,4-D染毒组大鼠于实验染毒第8天(32日龄)即出现阴道开口,且于第11天(35日龄)所有的大鼠阴道开口完毕;而72.5 mg/kg 2,4-D染毒组大鼠于染毒第14天(38日龄)才出现阴道开口,阴道开口比仅为1/10。与对照组比较,36.25 mg/kg 2,4-D染毒组阴道开口时间提前,72.5 mg/kg 2,4-D染毒组阴道开口时间延迟且阴道开口率较低,差异具有统计学意义(P<0.05),见表1。
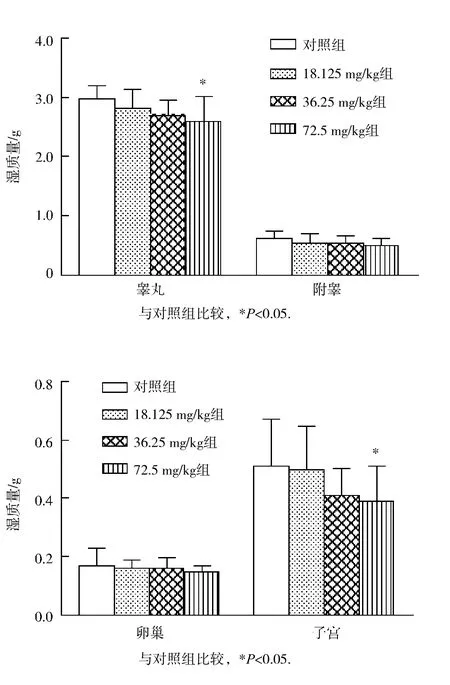

表1 2,4-D染毒对雌性SD大鼠阴道开口时间(日龄)及开口率的影响(n =10)
2.4 2,4-D染毒对SD大鼠性激素水平的影响
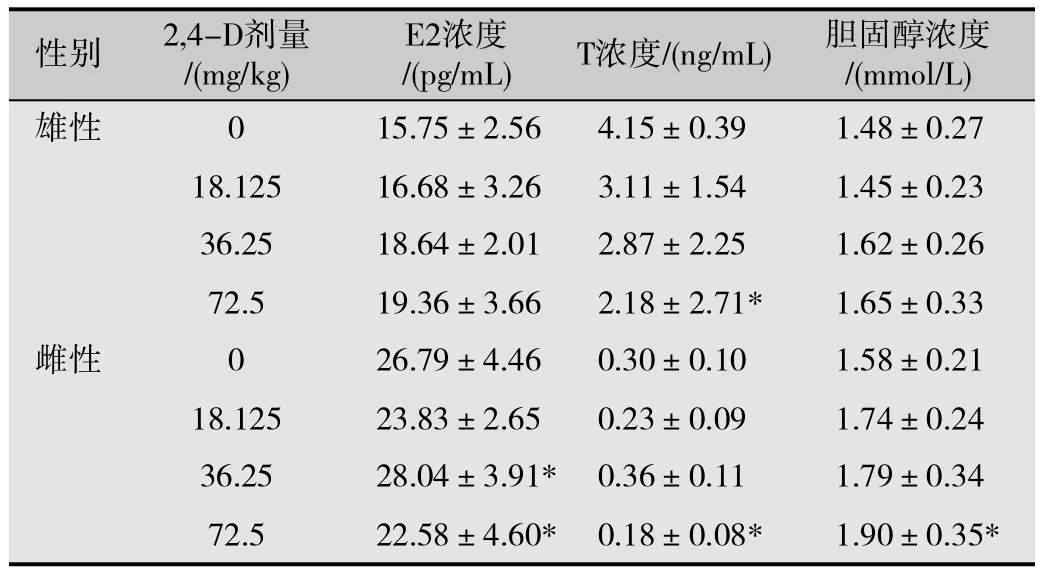
各染毒组雄性大鼠T的含量随着染毒剂量的增加,其含量逐渐降低,其中高剂量染毒组与对照组比较显著降低,差异有统计学意义(P<0.05),而各染毒组雄性大鼠E2的含量随着染毒剂量的增加,E2的含量逐渐升高,但差异无统计学意义(P>0.05);此外,各染毒组LH所测值均小于0.1,FSH所测值均小于0.3,与对照组间差异不明显(P均>0.05)。而36.25 mg/kg染毒组雌性大鼠E2较对照组升高,高剂量染毒组雌性大鼠E2较对照组降低,差异均有统计学意义(P<0.05);高剂量组雌性大鼠的T含量较对照组也降低,胆固醇含量较对照组升高,差异均有统计学意义(P均<0.05)。见表2。
2.5 SD大鼠睾丸、附睾发育的组织学观察
与对照组比较,各剂量组睾丸组织无明显异常(图4A~D),而高剂量组附睾组织曲细精管内(层数)生精细胞较少,其他两组无明显异常(图4E~H)。
2.6 SD大鼠卵巢、子宫发育的组织学观察
与对照组比较,各剂量组卵巢组织无明显异常(图5A~D),但72.5 mg/kg 2,4-D染毒组子宫腔略大,子宫壁略薄(图5E~H),其他组子宫无明显异常。
与对照组(0)比 较,*P<0.05.

A:睾丸,对照组(×10);B:睾丸,对照组(×40);C:睾丸,72.5 mg/kg组 (×10);D:睾丸,72.5 mg/kg组 (×40);E:附睾,对照组(×10);F:附睾,对照组(×40);F:附睾,72.5 mg/kg组 (×10);H:附睾,72.5 mg/kg组 (×40).
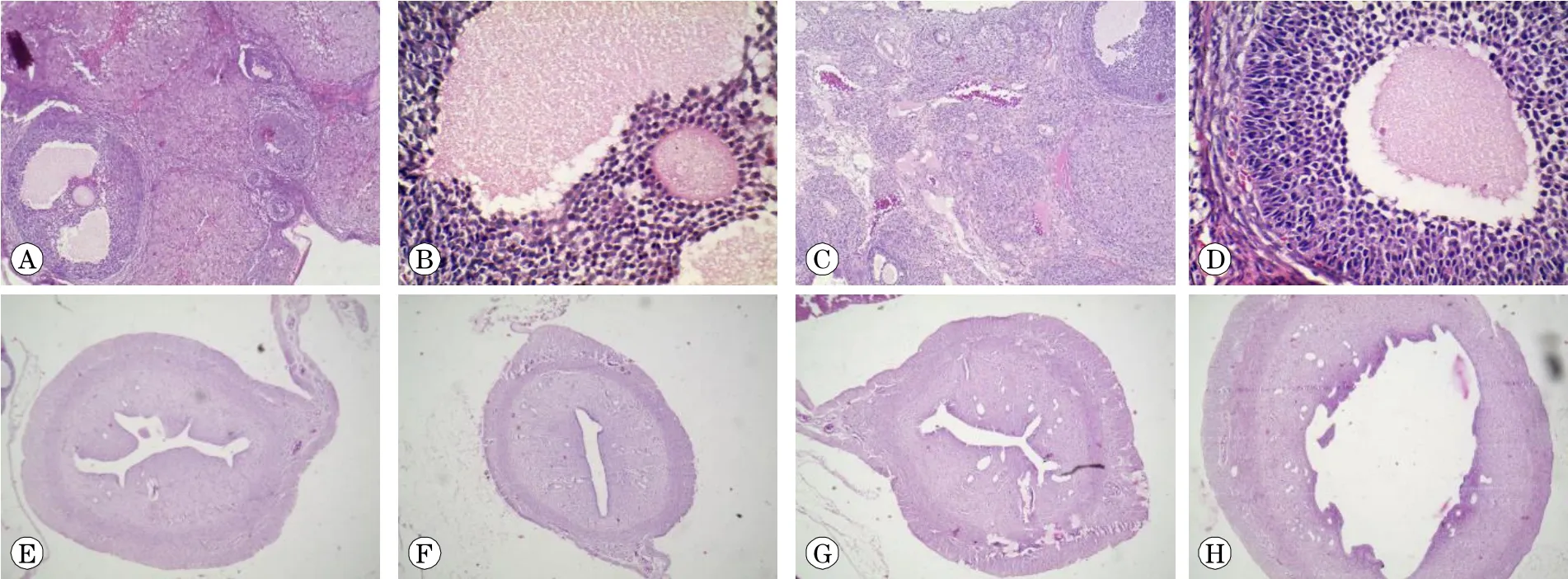
A:卵巢,对照组(×10);B:卵巢,对照组(×40);C:卵巢,72.5 mg/kg(×10);D:卵巢,72.5 mg/kg(×40);E:子宫,对照组(×4);F:子宫,18.125 mg/kg组 (×4);G:子宫,36.25 mg/kg组 (×4);H:子宫,72.5 mg/kg组 (×4).
3 讨 论
2,4-D可通过多种途径进入人体,并在体内广泛分布。在正常机体pH值下,2,4-D主要以离子的形式存在,通过主动转运方式进入到细胞当中。我国2001年新颁布的《饮用水水质卫生规范》将2,4-D的极限值规定为0.03 mg/L[14],2,4-D原药大鼠急性经口LD50为600 mg/kg,200 ppm(11.25 mg/kg)会产生亚慢性毒性[15],2,4-D最大耐受剂量为675 mg/kg(死亡率大于67%)[16]。在啮齿类动物中,2,4-D剂量50 mg/kg可超过肾脏阴离子的转运能力,产生全身毒作用[17]。鉴于此,确定了本研究的剂量设置(0、18.125、36.25、72.5 mg/kg)。
本研究采用体质量、器官湿质量、脏器系数和阴道开口时间等观察指标结合病理学指标以及血清激素指标从方法学上综合评价了2,4-D对SD雌鼠的生殖毒性,具有客观性和全面性。动物体质量指标能综合反映动物的一般生长发育情况,本研究72.5 mg/kg组从第14天起雌鼠体质量明显低于对照组,雄鼠36.25 mg/kg组 第 21、28天体质量也显著低于对照组,差异均有统计学意义(P<0.05),说明一定剂量的2,4-D会对大鼠生长发育产生毒性作用。72.5 mg/kg 2,4-D染毒组雄鼠睾丸和雌鼠子宫湿质量均明显降低(P<0.05),但各染毒组大鼠生殖器官脏器系数与对照组比较无明显差异,说明本研究剂量设置在保证了无明显毒性的基础上,证实了高剂量2,4-D对生殖器官的发育具有毒性影响。阴道开口时间指标作为青春期开始的标志长久以来对研究动物生殖毒性判定具有重要意义,36.25 mg/kg组雌鼠阴道开口时间明显早于对照组(P<0.05),使大鼠青春期提前;而72.5 mg/kg组阴道开口时间则明显滞后于对照组(P<0.05),结合高剂量组子宫湿质量及体质量均低于对照组说明高剂量组延迟了雌鼠的生殖器官的发育。此外,高剂量组在病理结果中雌鼠子宫腔增大,子宫壁变薄,且雄鼠附睾组织曲细精管内(层数)生精细胞减少,进一步证实了高剂量2,4-D会对大鼠生殖器官产生毒性作用。
性激素对机体至关重要,其具有促进性器官成熟、副性征的发育以及维持正常性功能等作用。性激素主要包括雌性动物的卵巢分泌雌激素与孕激素,雄性动物的睾丸主要分泌睾酮。性激素的合成以胆固醇为前体,通过缩短侧链,产生21C的孕烯醇酮或者是孕酮,去侧链,衍变为19C的雄激素,最后通过A环的芳香化,生成18C的雌激素[18]。
本研究结果显示,72.5 mg/kg的2,4-D可增加雌性大鼠血清中胆固醇的含量,降低E2和T的含量,与对照组比较差异有统计学意义(P<0.05)。结合性激素在体内的合成过程,我们推测2,4-D可能是通过抑制胆固醇转换成睾酮的过程中所需的某种因子,进而使雌二醇的合成过程受到抑制。此外,对于处于生长发育期的大鼠,性激素分泌的含量会直接影响进其生殖器官的发育,因此,在本实验条件下,E2和T含量降低同时,也观察到2,4-D可使动物阴道开口时间延迟。雄性SD大鼠暴露于72.5 mg/kg的2,4-D可降低睾酮T的含量,与对照组比较,差异有统计学意义(P<0.05),可见高剂量2,4-D影响雄性大鼠T的合成与分泌,Zhang等[19]的研究也显示2,4-D染毒(50、100、200 mg/kg,14 d)会降低血清中睾酮含量,血清中FSH和LH改变无明显差异,结合Leydig细胞病理学改变(100、200 mg/kg),他们认为2,4-D对Leydig细胞直接影响干扰了睾酮合成和释放,而本研究并没有观察到睾丸组织的异常病理变化,可能与本研究剂量不够大有关,因此其相关机制有待进一步探究。此前有研究者已经证实2,4-D(130 mg/kg)通过抑制胆固醇合成酶(Hmgcs1/Hmgcr)降低睾丸Leydig细胞中的胆固醇含量,导致睾丸减少,他们还观察到2,4-D损害小鼠正常精子的形成是通过过氧化物酶体增殖物激活受体 α( P PARα)破坏Leydig细胞中的胆固醇/睾酮稳态,因此认为,长期接触2,4-D诱发的人类睾丸毒性可能与PPARα有关[20]。这也与此前美国学者[11]对非洲爪蟾进行的研究结果相似,他们认为2,4-D抑制了成熟黄体酮的表达进而阻断了性激素的分泌,而通过Western blot分析和U0126抑制剂研究,他们得出2,4-D能刺激MAPK信号通路启动的结论。
此外,机体性激素的分泌受神经内分泌系统调节。FSH、LH是垂体细胞分泌的两种激素,FSH的作用主要是促进卵泡成熟、促进精子形成;LH的主要作用是刺激卵巢分泌女性雌激素与刺激睾丸间质细胞分泌男性激素。但本试验由于所用的检测方法所能检测到的LH、FSH的最低限分别为0.1、0.4 U/L,而低于该限值则无法显示具体数值,因此在实验中尚不能表明2,4-D可通过下丘脑-垂体-性腺轴对性激素的分泌产生影响。而有关2,4-D是如何引起E2以及T含量变化的,还需做进一步的研究。

