变异型EBER2通过抑制PKR通路增强鼻咽癌细胞抗凋亡能力
贺荟静,刘金成,刘芡芡,王 云,*
(1. 青岛大学医学院病原生物学系,山东 青岛266021;2. 山东省莱钢医院检验科,山东莱芜 271126)
鼻咽癌(nasopharyngeal carcinoma,NPC)是在中国南方高发的一种头颈部肿瘤,其发生与EB病毒(Epstein-Barr virus,EBV)感染密切相关,但EBV致癌机制尚不明确[1]。EBV编码小RNA(EBV-encoded small RNAs, EBERs)为 非 编 码 RNA, 包 括 EBER1和EBER2,是所有EBV感染类型中表达丰度最高的mRNA,其致癌作用已在多种细胞系中得到证实,因此EBERs在NPC及其他EBV相关肿瘤中可能发挥重要作用[2-3]。我们前期对EBV相关肿瘤中 EBV基因多态性的研究中发现了可能与NPC相关的 EBERs基因变异型EB-8m,该变异型在 EBER2基因转录区出现6处共有突变[4],进一步的功能学研究发现变异型EBER2可促进NPC细胞系增殖,并对 α-干扰素(interferon-α, IFN-α)诱导的细胞凋亡具有抵抗作用[5]。以往有研究表明EBERs可通过与RNA激活蛋白激酶(RNA-activated protein kinase,PKR)结合并抑制其激活从而增强细胞抗凋亡能力[6-9]。PKR是丝氨酸/苏氨酸激酶,可被IFN或双链RNA激活发生磷酸化,是IFN抗病毒作用中的效应因子,在细胞生长和细胞凋亡中也具有调控作用,多数研究认为PKR激活后可诱导翻译起始因子eIF2α磷酸化从而抑制细胞蛋白质合成,导致细胞凋亡,在肿瘤发生中发挥抑癌基因的作用[10-11]。EBER1和EBER2均可形成茎环结构,并通过茎环与包括PKR在内的几种细胞蛋白结合[2,12]。由于EB-8m变异型在EBER2的6处突变有5处位于茎环内[4,13],因此本研究在以往实验基础上,进一步检测EB-8m变异型EBER2对NPC细胞系细胞凋亡的影响,同时检测其对PKR结合和磷酸化以及相关因子磷酸化和蛋白表达的影响,探讨变异型EBER2增强NPC细胞抗凋亡作用的机制。
1 材料与方法
1.1 细胞、主要试剂与仪器
EBV阴性NPC细胞系HONE1和CNE1由广东医学院病理科朱伟教授馈赠; EBER2基因慢病毒表达载体由上海吉玛生物制药有限公司构建;真核表达质粒载体pcDNA3.1-PKR-FLAG由上海迈浦生物科技有限公司构建。PCR引物由南京金斯瑞生物科技有限公司合成;细胞凋亡检测试剂Annexin V-APC和 7-氨基-放线菌素D(7-amino-actinomycin D, 7 -AAD)分别购自美国eBioscience公司和美国BD公司;RNA蛋白结合免疫共沉淀试剂盒Magna RIPTM RNA-Binding Protein Immunoprecipitation Kit购于美国Millipore公司;质粒提取试剂盒购于北京天根生化科技有限公司;Real-time PCR试剂盒购于德国Roche公司;Lipofectamine 2000购于美国Invitrogen公司;BCA蛋白质定量试剂盒、蛋白质分子量标准、 β-actin单克隆抗体和二抗购于武汉博士德公司;PKR、eIF2α、c-Jun及磷酸化PKR(phosphorylated PKR,P-PKR)、P-eIF2 α、P-c-Jun多克隆抗体,Flag-Tag单克隆抗体和Bcl-2单克隆抗体购于美国ImmunoWay公司;DMEM培养基和胎牛血清购于美国Hyclone公司;Trizol RNA提取试剂购于美国Gibco公司;Active人类IFN-α全长蛋白质购于英国Abcam公司。
Roche Light Cycler 96型Real-time PCR扩增仪购自德国Roche公司;FUSION FX7显影仪购自法国VILBER公司;电转仪购自美国Bio-Rad公司。
1.2 EBER2基因稳定转染细胞的构建
含 EBER2原型和变异型基因的慢病毒表达载体构建、细胞转染及稳定转染细胞筛选的步骤见参考文献[5],EBER2-B95-8、EBER2-8m和对照分别表示含原型EBER2基 因、变异型E BER2基因以及只含载体的细胞。
1.3 凋亡诱导实验
分别对上述含有两种 EBER2基因的HONE1和CNE1细胞以及只含载体的对照细胞进行IFN-α和顺铂凋亡诱导实验。收集对数生长期的细胞,并且将细胞悬液浓度调整为6×104/mL,铺6孔板,CO体积分数为2 5%、37 ℃条件下培养过夜,IFN-α诱导时加入浓度10 000 IU/mL的IFN-α作用72 h后检测细胞凋亡;顺铂诱导时加入2 μg/mL顺铂分别作用24和48 h后检测细胞凋亡。采用Annexin V-APC和7-AAD双染,流式细胞术检测细胞凋亡情况,计算细胞凋亡率,具体步骤按照试剂盒说明书进行。每种细胞设置3个复孔,取3次试验均值。
1.4 蛋白表达检测
采用Western blot检测 EBER2基因转染HONE1和CNE1细胞及对照细胞中各种蛋白的表达情况。将10 0 00 IU/mL的IFN-α加入EBER2-B95-8、EBER2-8m和对照细胞培养液中作用24 h后,收集各组细胞,提取蛋白,BCA法测定蛋白质浓度,取50 μ g蛋白进行SDS-PAGE电泳,转膜,封闭1~2 h后与一抗(1∶1 000稀释) 4 ℃孵育过夜,用TBST洗膜3次,加入二抗(1∶2 000稀释),室温反应2 h,再用TBST洗膜3次,最后用发光试剂ECL(A液和B液)进行显色,暗室曝光并保存图片。Image J软件进行条带灰度分析,目的蛋白灰度值/β-actin灰度值表示目的蛋白相对表达量,取3次实验均值。
1.5 RNA蛋白结合免疫共沉淀
对含有两种 EBER2基因的HONE1和CNE1细胞进行RNA和PKR蛋白结合免疫共沉淀实验。首先制备PKR真核表达质粒载体pcDNA3.1-PKR-FLAG。人PKR基因的GenBank序列号为M85294,cDNA全长1 656 bp。PKR cDNA序列前连接FLAG短肽标签(DYKDD DDK)编码序列(GATTACAAGGATGACGACGATAAG),然后克隆至pcDNA3.1,转化大肠杆菌 D H5α,通过氨苄青霉素抗性、PCR扩增及测序鉴定,选择PKR序列完全正确的阳性克隆,提取质粒DNA,进行细胞转染实验。待细胞融合至90%时,用Lipofectamine 2000将质粒pcDNA3.1-PKR-FLAG分别瞬时转染EBER2-B95-8和EBER2-8m细胞。收集转染48 h后的细胞,制备细胞裂解产物,吸取1/10细胞裂解产物作为“input”,-80 ℃储存直至RNA纯化,剩余细胞裂解产物与以anti-FLAG抗体制备的免疫沉淀磁珠混合进行免疫共沉淀反应,阴性对照为试剂盒提供的IgG抗体免疫磁珠。取免疫共沉淀产物,分别提取纯化RNA和蛋白,用于EBER2 RNA和PKR蛋白检测。免疫共沉淀反应、RNA纯化和蛋白提取的步骤详见RNA蛋白结合免疫共沉淀试剂盒说明书。
采用Real-time PCR检测EBER2 RNA,引物序列及扩增片段长度见文献[5]。对提取纯化的“input”和免疫共沉淀产物中的RNA,进行逆转录获得cDNA,参照试剂盒说明书进行Real-time PCR反应,以3%的琼脂糖凝胶电泳鉴定扩增条带。参照免疫共沉淀试剂盒说明书,计算免疫共沉淀产物中EBER2的富集倍数:用input的 CT值 对实验组和IgG组的 CT值 进行标准化,∆CT,normalized= CT- [CT,input- log2(input稀释因子)],由于Realtime PCR的“input”为免疫共沉淀细胞溶解产物量的10%, 所 以input稀 释 因 子 为10; 实 验 组 ∆ ∆CT=∆CT,normalizedtested- Δ CT,normalizedIgG, 实验组目的RNA的富集倍数为2-ΔΔCT,取3次 试 验均值。分别以PKR多克隆抗体和Flag-Tag单克隆抗体作为一抗,采用Western blot检测免疫共沉淀产物中携带FLAG的PKR蛋白。
1.6 统计学分析
采用SPSS 18.0统计软件进行统计学分析,EBER2-B95-8组和EBER2-8m组免疫共沉淀产物中EBER2富集倍数间差异的分析采用t检验,EBER2-B95-8组、EBER2-8m组和对照组细胞凋亡率间和蛋白表达量间差异的分析采用完全随机资料方差分析及q检 验。以 α=0.05为检验水准。
2 结 果
2.1 凋亡诱导实验结果
流式细胞术检测结果见图 1。IFN-α诱导实验中,两种细胞系EBER2-B95-8组和EBER2-8m组细胞凋亡率均低于 对 照组,差异有统计学意义(P<0.05),且EBER2-8m组细胞凋亡率低于EBER2-B95-8组,差异有统计学意义(P<0.05)。顺铂凋亡诱导实验中,在诱导后的24和48 h,两种细胞系EBER2-B95-8组和EBER2-8m组细胞凋亡率均低于 对 照组,差异有统计学意义(P<0.01),且EBER2-8m组细胞凋亡率低于EBER2-B95-8组,差异有统计学意义(P<0.05)。
2.2 EBER2基因转染细胞中PKR通路相关蛋白的表达
EBER2基因转染细胞中PKR和相关因子磷酸化及蛋白表达情况见图2。与 对 照组细胞比较,EBER2-B95-8和EBER2-8m组细胞中总PKR、eIF2α和c-Jun表达水平无明显差异,但P-PKR、P-eIF2α和P-c-Jun表达减少,Bcl-2表达增多,差异均有统计学意义(P<0.05或 P<0.01)。变异型基因和野生型基因转染细胞比较,HONE1细胞中,P-PKR和P-eIF2α在EBER2-8m组的水平低于EBER2-B95-8组,差异有统计学意义(P<0.05), P-c-Jun和 Bcl-2的 表 达 尚 无 明 显 差 异 (图2A和B);CNE1细胞中P-PKR在EBER2-8m组的水平低于EBER2-B95-8组,差异有统计学意义(P<0.05),其他蛋白的表达无明显差异。
2.3 免疫共沉淀产物中EBER2 RNA和PKR蛋白检测结果
Real-time PCR产物的琼脂糖凝胶电泳结果见图3A,“input”组和anti-FLAG免疫共沉淀产物可观察到EBER2扩增条带,IgG组未观察到EBER2扩增条带。CNE1和HONE1细胞中,EBER2-8m组免疫共沉淀产物中EBER2的富集倍数(2-∆∆CT)高于EBER2-B95-8组,差异均有统计学意义(P<0.01)(图3B)。以FLAG抗体和PKR抗体作为一抗,通过Western blot均可在anti-FLAG免疫共沉淀产物中检测到FLAG-PKR蛋白,IgG组未检测到FLAG-PKR蛋白(图3C)。
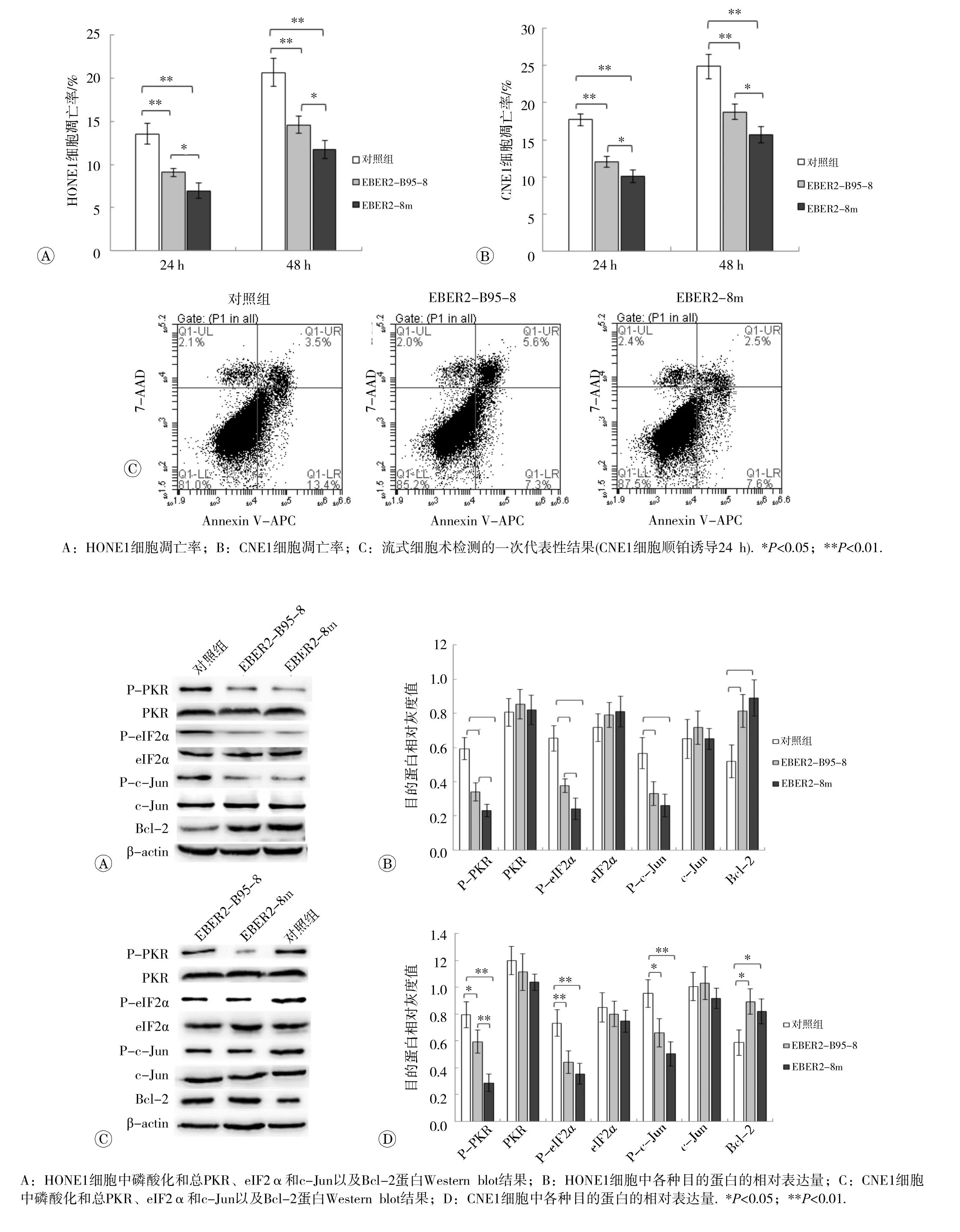
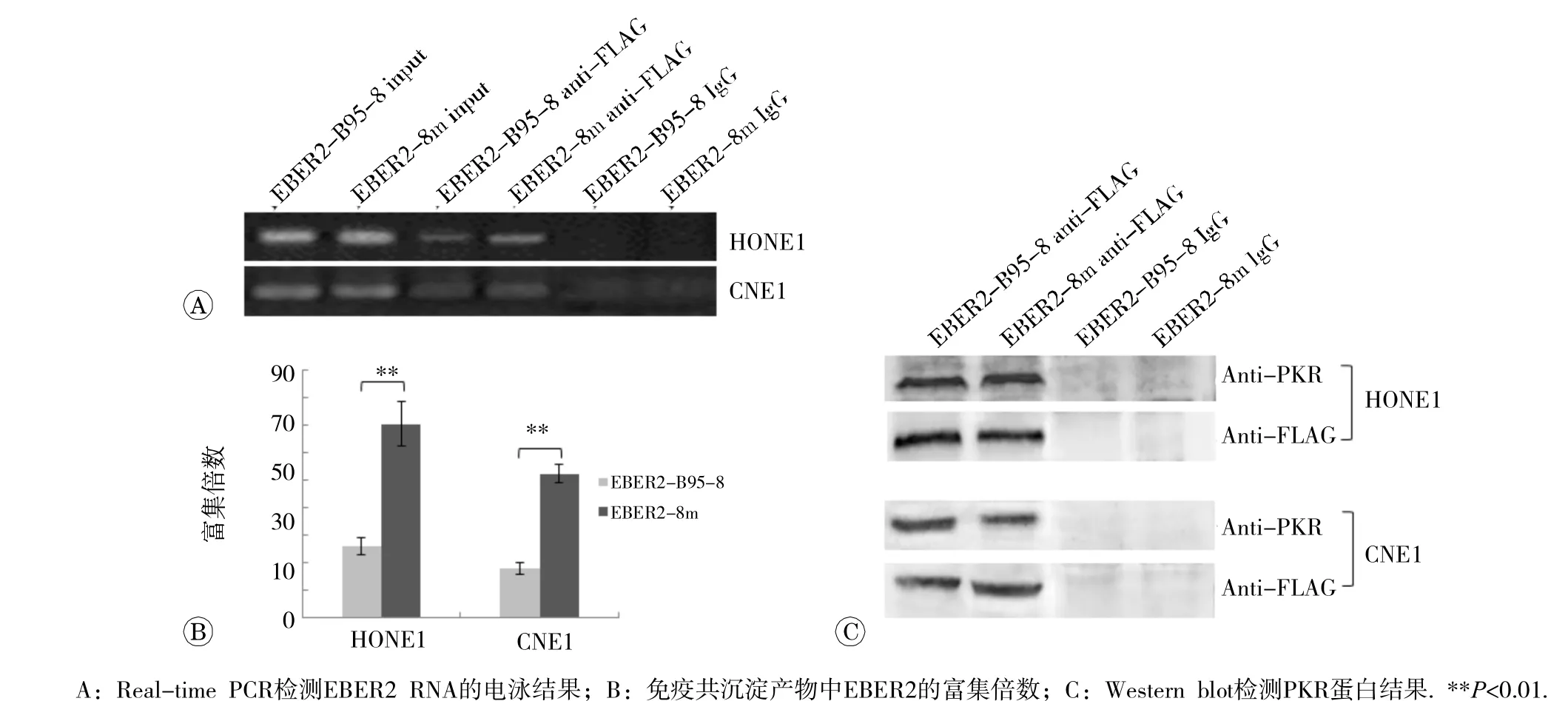
图3 PKR免 疫共沉淀产物中 EBER2 RNA 和 PKR蛋白检测结果
3 讨 论
EBERs 是近年来得到认可的EBV致癌基因,本研究顺铂和IFN-α凋亡诱导实验的结果显示野生型和变异型EBER2均可增强NPC细胞的抗凋亡能力。以往实验也表明EBERs在肿瘤细胞系中可以抵抗多种因素诱导的细胞凋亡,如IFN-α、Fas、低氧、放线菌酮和糖皮质激素等诱导的细胞凋亡[6-9,14]。PKR是一种各组织细胞广泛表达的双链RNA依赖的蛋白质激酶,正常情况下处于无活性状态,当与双链RNA结合后,PKR构象发生变化,通过自身及相互磷酸化激活,作用于下游因子eIF2α、 NF-κB或丝裂原活化蛋白激酶(mitogenactivated protein kinase,MAPK)等调节细胞凋亡或生长[11,15-17]。EBERs属非编码RNA,可与细胞双链RNA识别因子相互作用[2-3,12],EBERs与PKR的结合能抑制其发生磷酸化进而失活。有研究在B淋巴瘤细胞系BJAB[6]、 鼻咽上皮细胞NP69[7]、 BL细胞系Akata[8]以及肠上皮细胞407[9]中均发现EBERs可通过结合PKR抑制其发生磷酸化从而增强细胞抗凋亡能力。以往研究均采用包括EBER1和EBER2在内的完整EBERs进行实验,本研究结果显示独立的EBER2对抑制NPC细胞凋亡及PKR激活均具有与完整EBERs类似的作用,提示了EBER2功能的重要性,以往基因敲除实验表明EBER2是引起B细胞转化的关键基因[18-19]。
EBER1或EBER2通过形成茎环结构与细胞蛋白结合[2,12-13],EBERs二级结构对于其发挥功能至关重要,诱导突变实验表明EBER1茎环碱基突变会影响EBER1与核糖体蛋白L22的结合,进而影响EBER1的促细胞增殖能力[20]。EB-8m变异型EBERs在 EBER1基因转录区序列保守,但在 EBER2基因转录区发生6处突变,其中5处位于茎环内[4,13]。本研究采用Real-time PCR检测RNA-PKR免疫共沉淀产物中的EBER2,对实验的各环节严格定量,将扩增反应控制在指数增长的线性范围内,计算RNA富集倍数时分别以“input”和IgG组进行标准化处理和排除非特异性结合RNA,获得的富集倍数值能在一定程度上反映EBER2与PKR蛋白的结合能力。由于EBER2-8m变异型EBER2的富集倍数高于野生型EBER2,且Western blot结果也显示EBER2-8m对PKR磷酸化的抑制作用更为明显,提示EB-8m变异型在EBER2二级结构茎环处发生的突变可能促进EBER2与PKR的结合,增强了对PKR磷酸化的抑制作用,进而提高了细胞的抗凋亡能力。EBER2变异如何影响其与PKR的结合尚需进一步研究。
对PKR通路相关因子的检测结果显示野生型和变异型EBER2均可抑制eIF2α和c-Jun磷酸化并 上调Bcl-2蛋白表达,该结果与以往EBERs在其他几种细胞中的结果类似。如在Burkitt淋巴瘤细胞系Akata中,EBERs过表达可通过与PKR结合抑制eIF2α磷酸化[8];在双链RNA类似物poly(I):poly(C)处理后的鼻咽上皮细胞NP69中,EBERs过表达导致PKR、p38 MARK和c-Jun的磷酸化水平降低,Bcl-2水平升高,凋亡标志物caspase-3和PARP裂解产物的表达水平降低[7]。c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)信号通路是参与调节细胞增殖和凋亡的重要通路,c-Jun磷酸化被抑制可抑制细胞凋亡,促进细胞转化[21-22]; B cl-2是最有代表性的凋亡抑制基因[23]。eIF2α是PKR激活后的直接作用底物[15-16],而 c- J un和 B cl-2也可以作为PKR调节的下游基因[24-26],本研究 EBER2基因转染细胞中PKR磷酸化被抑制,上述3种基因磷酸化和表达也随之发生变化,进一步证实PKR对3种基因的调控作用。同时变异型EBER2对PKR磷酸化的抑制作用比野生型EBER2更为显著,且在HONE1细胞中,变异型EBER2 对eIF2α的抑制作用亦比野生型EBER2明显,但变异型和野生型EBER2转染细胞之间c-Jun磷酸化和Bcl-2表达尚无明显差异,提示EBER2变异型可能还通过PKR 以外的途径调节c-Jun磷酸化和Bcl-2表达。
总之,本研究结果表明EB-8m变异型EBER2可能增强EBER2与PKR的结合作用及对PKR磷酸化的抑制作用,同时抑制eIF2α和c-Jun磷酸化并上调Bcl-2蛋白表达,进而增强NPC细胞的抗凋亡能力。

