姜黄提取物对猪链球菌溶血素活性的影响
张 伟,张 沛,孙 忻,李 莉*
(1.吉林大学动物医学学院,吉林长春 130062;2.天津农学院动物科学与动物医学学院,天津 300384;3.吉林大学动物科学学院, 吉林长春 130062)
猪链球菌(Streptococcussuis,SS)是一种世界范围内广泛分布的革兰性阳性机会致病菌,也是一种重要的人兽共患致病菌,其感染可以引起人和动物的细菌性脑炎、关节炎及败血症等多种疾病,严重危害养猪业的发展和人类健康。根据荚膜抗原的不同,通常将猪链球菌分为35个血清型(1~34,1/2)[1-2],其中猪链球菌2型是毒力最强、临床分离率最高的血清型,感染后表现高致病性和高致死率的临床特征[3-5]。目前,临床实践上主要采用抗生素来应对猪链球菌的感染,而传统抗生素主要是通过抑菌或杀菌的方式发挥治疗作用,容易给病原菌造成较大的生存选择压力,进而易诱导细菌耐药性的产生,影响治疗效果。因此,面对着日益严重的猪链球菌耐药性问题,临床上急需新的抗感染思路和策略。
随着分子生物学、免疫学等前沿学科的发展和生物技术的进步,人们发现病原菌致病作用及毒力的发挥与其携带或分泌的毒力因子有着密切联系,毒力因子在整个致病过程中起着重要的作用[6]。猪链球菌所携带或分泌的溶血素、分选酶及溶菌酶释放蛋白等毒力因子在其致病过程中起着重要作用[7]。猪链球菌溶血素(suilyin,SLY)是一种属于胆固醇依赖性家族的成孔毒素,被认为是一种重要的毒力因子。Staats J J等[8]从死亡率、发病率和病理学角度对猪链球菌进行分析研究,发现SLY阳性猪链球菌2型是高毒力猪链球菌菌株。也有研究表明,相较于野生株,SLY缺失型菌株毒力显著下降,在猪链球菌感染小鼠模型中几乎不引起小鼠死亡[9]。Takeuchi D等[10]通过对小鼠感染猪链球菌模型分析,发现SLY是猪链球菌的一种重要毒力因子。接种溶血素敲除株和溶血素低分泌株的小鼠死亡率显著低于接种野生株小鼠。其研究还发现SLY在猪链球菌脑炎中发挥着作用,SLY高分泌菌株更容易诱发细菌性脑炎,进而提示SLY在猪链球菌透过血脑屏障的过程中发挥一定作用。此外,SLY可以损伤宿主内皮等细胞,具有细胞毒性,有助于细菌躲避宿主免疫系统的清除[9]。因此,SLY是治疗和控制猪链球菌感染新型药物开发的一个重要潜在靶点。
姜黄很早便有入药记载,是一味传统的中药,主要来源于姜科植物根系,具有活血、行气等多种功效,现代中药学研究表明,姜黄还具有抗炎、抗肿瘤等多种药理学作用[11]。本研究选择SLY为作用靶标,通过溶血活性抑制试验和生长曲线的测定试验等验证分析姜黄提取物对SLY生物活性和猪链球菌生长的影响,并通过体外细胞试验进一步验证姜黄提取物对猪链球菌毒力发挥的影响,为临床治疗猪链球菌感染药物开发提供新的思路和一种潜在的先导天然复合物。
1 材料与方法
1.1 材料
1.1.1 菌株和细胞 猪链球菌2型菌株ZY05719由南京农业大学范红结教授惠赠;腺癌人类肺泡基底上皮细胞A549和小鼠巨噬细胞J774为吉林大学动物医学院兽医药理实验室保存。
1.1.2 主要仪器和试剂 酶标仪,美国伯腾,Synergy HT公司产品;姜黄,安徽汇中州中药饮片有限公司产品;二甲基亚砜,Sigma公司产品;THB(todd-hewitt broth)培养基,青岛海博生物技术有限公司产品;Trans well小室,美国Corning 公司产品;DMEM(dulbecco's modified eagle medium)培养基,美国Invitrogen公司产品;乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒,Roche试剂公司产品。
1.2 方法
1.2.1 姜黄提取物的制备 精确称取2 kg姜黄粗粉,溶解于3 L含量700 mL/L乙醇中进行回流提取,反复在60 ℃条件下进行3次回流提取,每次进行6 h,合并上述提取到的回流液,用脱脂棉进行过滤并收集滤液,在45℃下进行减压浓缩至浸膏后,经过真空干燥至恒重,得到姜黄提取物。用二甲基亚砜(dimethyl sulphoxide,DMSO)制备终浓度为10 240 μg/mL工作液备用。
1.2.2 最小抑菌浓度的测定 采用肉汤微量稀释法测定姜黄提取物对猪链球菌ZY05719的最小抑菌浓度(minimal inhibitory concentration,MIC)[9]。
1.2.3 生长曲线的测定 挑取猪链球菌ZY05719单菌落于2 mL THB培养基过夜培养,取200 μL上述菌液扩大培养至100 mL THB培养基中,37℃、250 r/min振摇培养至对数生长期即OD 600 nm=0.3,等量分装至50 mL三角锥形瓶,并且分别加入提取的上述姜黄提取物工作液,使共培养体系中姜黄素提取物的终浓度分别达到0、8、16、32、64 μg/mL,其中未加入姜黄提取物组加入等体积的DMSO,每隔60 min分别测定每个样品光密度值并绘制出其生长曲线。
1.2.4 溶血素活性抑制试验 同“1.2.3”中细菌培养操作,培养至数生长期后,等量分装至50 mL锥形瓶,并且分别加入上述姜黄提取物工作液,使共培养体系中姜黄素提取物的终浓度分别达到0、8、16、32、64 μg/mL,其中未加入姜黄提取物组加入等体积的DMSO继续培养对数生长后期,将细菌培养物进行离心(10 000 r/min、1 min)获得上清液。取875 μL PBS (phosphate buffer saline)、100 μL上述培养物上清以及入25 μL脱纤维兔红细胞于1.5 mL离心管中,混合均匀,静置于37℃ 30 min,10 000 r/min离心1 min,取上清液测定543 nm光密度值(OD)。
1.2.5 Trans well小室穿膜试验 选用含100 mL/L胎牛血清的DMEM培养基培养A549细胞(37℃、体积分数为5% CO2,湿度95%),选取生长状态良好的细胞,加入胰蛋白酶消化,并铺板加入于Trans well小室(6×104个细胞/小室)中,继续培养至细胞在小室长满。同1.2.3中细菌培养操作,猪链球菌2型ZY05719培养至OD 600 nm=0.3后,用含有2.5 mL/L胎牛血清的DMEM培养基将上述菌液稀释至浓度为1×108CFU/mL,同时加入姜黄提取物工作液,使终浓度分别达到0、8、16、32、64 μg/mL。取含不同浓度姜黄提取物的上述稀释好的菌液加入小室,每室200 μL,37℃静置孵育30 min,收集下室培养物,依次进行倍比稀释,均匀涂布于固体THB培养基上计算细菌穿透膜的成功率,穿透率=穿入下室的菌体量/加到小室的菌体量×100%。
1.2.6 LDH释放检测试验 选用含100 mL/L胎牛血清的DMEM培养基培养小鼠巨噬细胞J774,选取生长状态良好的细胞,加入胰蛋白酶消化,加入96孔板中,每孔5×104CFU,同1.2.3中细菌培养操作,猪链球菌2型ZY05719培养至OD 600 nm=0.3后,用DMEM培养基将上述菌液稀释至浓度为1×108CFU/mL,同时加入姜黄提取物工作液,使终浓度分别达到0、8、16、32、64 μg/mL。取含不同浓度姜黄提取物的上述稀释好的菌液10 μL加入每孔,在37℃、体积分数为5% CO2条件下静置培养5 h,离心(1 000 r/min 10 min),取上清液,按照LDH检测试剂盒操作说明,用酶标仪在490 nm下测定上清液的光密度值,并计算相应的细胞LDH的释放量。
2 结果
2.1 姜黄提取物的体外抑制结果
MIC测定试验结果表明,姜黄提取物对猪链球菌的MIC浓度高于1 024 μg/mL,提示姜黄提取物几乎无抑菌活性,并且姜黄提取物在作用浓度8 μg/mL~64 μg/mL条件下对猪链球菌的生长几乎无影响,结果见图1。说明姜黄提取物对猪链球菌几乎无生存选择压力。
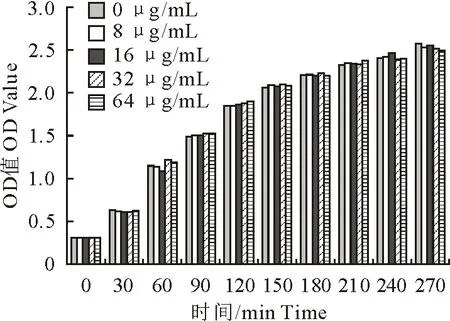
图1 猪链球菌在不同姜黄提取物浓度作用下的的生长曲线
2.2 姜黄提取物抑制SLY溶血活性结果
SLY具有细胞毒性,可以直接裂解红细胞。溶血素活性抑制试验结果表明,经过不同浓度姜黄提取物与猪链球菌共培养后,共培养物上清的溶血活性被明显抑制,结果见图2。当姜黄提取物浓度为64 μg/mL时,共培养物上清的溶血活性仅为对照组的22.36%,并且该抑制作用呈显著的剂量依赖性。
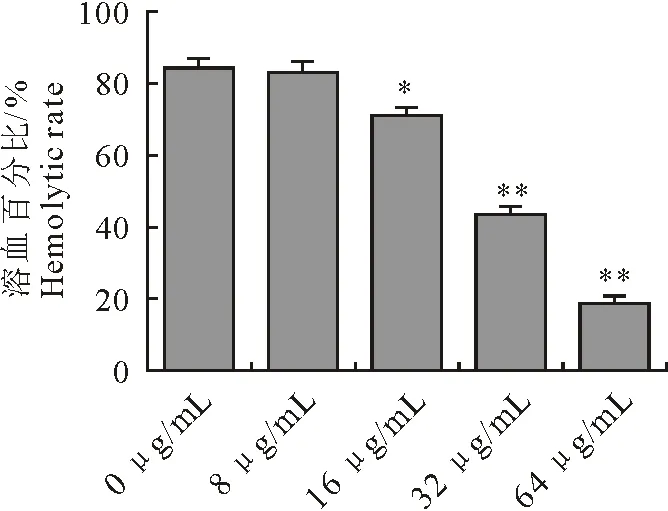
“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01)
“*” means significant difference(P<0.05).“**” means extremely significant difference(P<0.01)
图2姜黄提取物对猪链球菌培养物上清溶血活性的抑制作用
Fig.2 Inhibitory effect of curcuma extract on hemolytic activity ofS.suisculture supernatant
2.3 姜黄提取物降低猪链球菌穿透上皮细胞屏障能力结果
通过体外细胞试验分析了姜黄提取物对猪链球菌穿过上皮细胞屏障的影响,结果见图3。结果表明,姜黄提取物可以显著抑制猪链球菌穿透上皮细胞屏障的能力,并且这一抑制作用呈现剂量依赖性,当姜黄提取物浓度分别达到32 μg/mL和64 μg/mL时,猪链球菌穿透上皮细胞的通透率明显下降,此结果与姜黄提取物抑制猪链球菌培养物上清溶血活性一致。

“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01)
“*” means significant difference(P<0.05).“**” means extremely significant difference(P<0.01)
图3姜黄提取物对猪链球菌模拟穿透上皮细胞屏障的作用
Fig.3 The effect of curcuma extract onS.suistraversal across epithelial barrier
2.4 姜黄提取物对猪链球菌介导细胞毒性LDH的作用结果
采用LDH试剂盒检测了细菌和姜黄提取物共感染体系中LDH释放量,结果见图4。图4的定量结果表明,姜黄提取物可以显著保护猪链球菌介导的细胞毒作用。猪链球菌和J774细胞共培养后表现了明显的毒性作用,造成细胞大量死亡。但加入不同浓度的姜黄提取物后,LDH释放量显著降低,并呈现剂量依赖性,说明死亡细胞显著降低。当姜黄提取物浓度分别达到32 μg/mL和64 μg/mL时,相较于未加入姜黄提取物组,加入姜黄提取物组LDH释放量极显著降低(P<0.01)。

“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01)
“*” means significant difference(P<0.05).“**” means extremely significant difference(P<0.01)
图4姜黄提取物缓解猪链球菌所诱导的对宿主细胞的细胞毒作用
Fig.4 Effect of curcuma extract on relief ofS.suis-induced cytotoxicity
3 讨论
抗生素的发现和临床应用对人类的健康和养殖业的发展做出不可磨灭的贡献。但自从青霉素应用以来,任何新型抗生素的使用都会在短短几年内出现对该抗生素产生显著抵抗性的现象。而目前为止,新抗生素研发的速度远不及细菌耐药性产生的速度。美国传染病学会估计,70%的美国医院获得性感染对1种或多种抗生素具有抗性。然而,除了最近开发的窄谱药物达托霉素和利奈唑胺以外,在40多年中没有发现新类别的临床相关抗生素[12]。传统抗生素的主要作用机制多为抑制细菌细胞壁、细胞膜、核苷酸及蛋白质等细菌生存所必须成分,因而给予了细菌较大的生存选择压力,极易诱导抗药性的产生[6,13]。因而,新的抗感染策略和机制迫切需要被提出,与传统抗生素作用不同,抗毒力策略选择细菌携带分泌的毒力因子作为靶点,而不是作用于细菌本身,因而给细菌较强的生存选择压力,从而可以减缓细菌耐药的产生,还可以显著降低细菌毒力,越来越多的受到人们关注[14]。
猪链球菌携带分泌多种毒力因子,其中SLY是猪链球菌的一种重要的毒力因子,在致病过程中发挥重要的作用。基于死亡率、发病率和病理学角度研究,SLY阳性猪链球菌2型菌株多被鉴定为高毒力猪链球菌菌株[8]。也有研究发现,SLY缺失株相较于野生株毒力显著下降,几乎不造成感染小鼠死亡[9]。猪链球菌感染可引发猪脑炎、关节炎、心内膜炎、流产等,其中脑炎是危害严重的疾病[15]。SLY在细菌性脑炎的发生过程中也发挥重要作用,有研究表明SLY高分泌菌株更容易诱发细菌性脑炎[10]。因而,选择SLY作为筛选药物靶点,从而选择抑制剂,为治疗和控制猪链球菌感染提供了一种新的思路和方法。
本研究以猪链球菌SLY作为作用靶标,发现姜黄提取物对猪链球菌培养物上清的溶血活性具有显著的抑制作用,并且对猪链球菌的生长不产生肉眼可见的影响,因而对猪链球菌不造成生存选择压力,但却可以显著抑制SLY的溶血活性,故而提示姜黄提取物是一种复合抗毒力策略的抗猪链球菌感染的天然先导化合物。进一步通过体外细胞试验研究表明,姜黄提取物可以明显抑制猪链球菌介导的细胞毒性和透膜作用。综上所述,姜黄提取物在不影响猪链球菌正常生长的前提下,可以直接抑制SLY的溶血活性,并且可保护缓解细菌介导的细胞毒性所造成细胞的死亡率,以及降低细菌的穿透细胞膜的能力,从而提示,姜黄提取物是以SLY为作用靶点的抗猪链球菌感染的天然先导化合物。

