猪繁殖与呼吸综合征病毒实时荧光定量PCR检测方法的建立及初步应用
杨 峰,周宏超,许信刚,张为民,张 琪
(西北农林科技大学动物医学院,陕西杨凌 712100)
猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)属于动脉炎病毒属,猪感染后造成以严重的繁殖障碍(妊娠母猪流产、产死胎、木乃伊胎、弱胎或畸形胎和公猪精液质量下降等)与呼吸障碍(咳嗽、气喘、呼吸困难等)为主要临床症状的猪繁殖与呼吸综合征(PRRS),因发病猪的耳朵发绀呈蓝紫色又称猪蓝耳病,我国将猪高致病性猪蓝耳病列为一类动物疫病[1]。PRRSV在猪群传播2个月~3个月就可导致95%以上的猪为血清学阳性[2],世界范围内的养猪企业均认为猪蓝耳病严重阻碍了养殖集约化,对养猪业的发展造成了极大的影响[3]。猪感染PRRSV后,常伴随继发感染,临床症状复杂,且当前PRRSV毒株种类多,加之不同毒株疫苗的使用,给临床诊断猪是否感染PRRSV造成了较大的困难[4-5]。常规逆转录PCR(reverse transcription PCR,RT-PCR)方法是目前实验室检测PRRSV的常用方法,然而在灵敏度和病毒含量测定等方面尚存在一些不足[6]。实时荧光定量PCR(real-time PCR)凭借其简单的操作,较高的灵敏度、良好的重复性和量化的结果以及较短的检测时耗等优点,逐渐在实验室的检测中得到了广泛应用,尤其是费用相对较低的荧光染料法实时定量PCR[7-10]。本研究根据NCBI中登录的PRRSV的ORF7基因设计特异性引物,建立基于Eva Green的 real-time PCR检测方法,以期为PRRSV的临床诊断提供一种特异、灵敏、快速及量化的方法。
1 材料与方法
1.1 材料
1.1.1 毒株、菌株及病料 猪繁殖与呼吸综合征病毒(PRRSV)、猪流行性腹泻病毒(PEDV)、猪瘟病毒(CSFV)、猪伪狂犬病病毒(PRV)、猪圆环病毒2型(PCV2),均由西北农林科技大学动物医学院兽医微生物实验室分离保存;感受态细胞DH5α,康维世纪生物科技公司产品。
1.1.2 待检病料 27份病料为陕西省不同地区规模化养猪场临床疑似PRRSV感染发病猪的肺脏和脾脏,每头猪的各种组织混合为1份病料。
1.1.3 主要试剂 DNA Marker DL 2 000和2×TaqMaster Mix,康维世纪生物科技公司产品;Trizol试剂、RNA逆转录试剂盒,天根生化科技公司产品;EasyPure Quick Gel Extraction Kit、pEAST-T1克隆试剂盒、质粒提取试剂盒,全式金生物公司产品;2×Eva Green Premix,ABM 生物科技公司产品。
1.2 方法
1.2.1 引物设计及合成 参考NCBI中登录的猪繁殖与呼吸综合征病毒的ORF7基因序列(KU950375.1、KP771739.1等),分析保守序列,用Primer 5设计一对特异性引物。所设计的荧光定量特异性上、下游引物序列分别为PRRSV-F:5′-GAAGCCCCATTTCCCTCT-3′,PRRSV-R:5′-CTTATCCTCCCTGAATCTGACA-3′,扩增片段长度为144 bp。引物由西安擎科泽西生物公司合成,稀释至浓度为10 μmol/L,4℃保存备用。
1.2.2 PRRSV RNA的提取及逆转录 取保存的病毒液200 μL,加1 mL Trizol试剂,使用Trizol法提RNA,使用逆转录试剂盒进行逆转录,获得的cDNA置-20℃存储或进行后续试验。
1.2.3 常规RT-PCR扩增 50 μL反应体系:2×TaqMaster Mix和模板分别为25 μL和6 μL,上、下游引物均为4 μL,双蒸水补足。反应条件:95℃ 5 min;95℃ 25 s,56℃ 20 s,72℃ 20 s,循环30次;72℃ 10 min。
1.2.4 real-time PCR阳性质粒及标准模板制备 按照胶回收试剂盒回收1.2.3扩增的目的片段,并将其按照pEAST-T1克隆试剂盒构建重组质粒菌。重组质粒菌经常规PCR鉴定为阳性后,将重组质粒菌中的阳性质粒按照试剂盒的操作步骤提取,进行测序分析。用超微量光谱分析仪测定阳性质粒浓度,按照以下公式将浓度转化为拷贝数,然后进行10-1~10-9的梯度稀释。稀释后的质粒作为标准模板,置-20℃保存备用。拷贝数(copies/μL)=C×NA/MW,其中C为阳性质粒测定的浓度,单位ng/μL,NA取值为6.02×1023copies/mol,MW为平均分子质量,单位Dolton。
1.2.5 real-time PCR扩增 10 μL反应体系:2×Eva Green Premix、标准模板、上游和下游引物分别为5、1、0.3、0.3 μL,ddH2O补足。反应条件:95℃ 10 min:95℃ 3 s,60℃ 30 s,采集荧光信号,35次循环。
1.2.6 real-time PCR反应标准曲线建立 选取浓度稀释10-4~10-8的标准模板为阳性模板,以双蒸水为阴性对照模板,进行real-time PCR扩增。结果以real-time PCR仪自带软件分析绘制扩增曲线、标准曲线和熔解曲线。
1.2.7 real-time PCR特异性试验 用建立的real-time PCR方法分别检测PEDV、CSFV、PCV2、PRV的cDNA或者DNA,验证建立的real-time PCR方法的特异性。
1.2.8 real-time PCR灵敏性试验 选取浓度稀释了10-6~10-10的标准模板为阳性模板,双蒸水为阴性对照模板,real-time PCR方法扩增。选取浓度稀释了10-6~10-9的标准模板为阳性模板,双蒸水为阴性对照模板,常规PCR方法扩增。通过比较2种方法可以检测到阳性结果的最低浓度,以此得出灵敏程度。
1.2.9 real-time PCR重复性试验 分别以同一批次104~106copies/μL浓度的标准模板和不同批次104~106copies/μL浓度的标准模板为阳性模板,用双蒸水作为阴性对照模板,进行real-time PCR扩增,计算组内和组间变异系数。
1.2.10 临床样本的检测 取疑似PRRSV感染的病料,加适量PBS研磨,将研磨液冻融3次后提取RNA并反转录,得到的cDNA做待测样本,以标准模板做阳性对照模板,以双蒸水为阴性对照模板,用所建立的real-time PCR方法检测,然后将real-time PCR方法检测为阳性的样品进行常规RT-PCR方法检测,统计结果进行比较。
2 结果
2.1 阳性质粒常规PCR鉴定
将菌液用荧光定量特异性引物进行常规PCR检测,结果为144 bp目的片段(图1)。将鉴定为阳性的质粒测序,通过BLAST比对,结果同源性达99%,说明重组质粒构建成功。
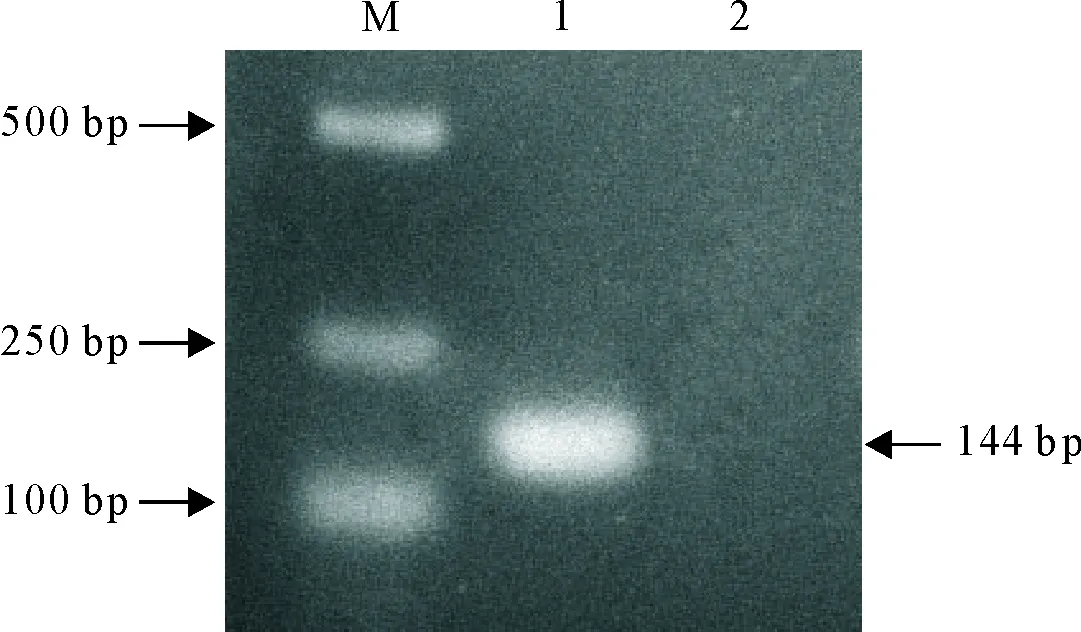
M.DNA标准DL 2 000;1.阳性质粒常规PCR产物;2.阴性对照
M.DNA Marker DL 2 000; 1.PCR products of positive plasmid; 2.Negative control
图1阳性质粒常规PCR鉴定
Fig.1 The conventional PCR identification of positive plasmid
2.2 real-time PCR标准模板的制备
用超微量光谱分析仪测定提取质粒的浓度为280.2 ng/μL,OD260/OD280值为1.872,计算得拷贝数为6.276×1010copies/μL,将其稀释至浓度分别为6.276×109、6.276×108、6.276×107、6.276×106、6.276×105、6.276×104、6.276×103、6.276×102、6.276×101、6.276×100copies/μL,置-20℃保存备用。
2.3 real-time PCR反应标准曲线建立
real-time PCR标准模板的扩增曲线见图2,相应的标准曲线见图3,其熔解曲线见图4。在6.276×102copies/μL 至 6.276×106copies/μL的浓度区间内,所得拷贝数(x)与Ct值(y)的线性方程为y=-3.164x+34.635,斜率为-3.164,截距为34.635,线性相关系数R2=0.999,显示了良好的线性关系。熔解曲线峰型单一,无杂峰,熔解温度一致,Tm=83℃。

1~5. 6.276×106copies/μL~6.276×102copies/μL 5个不同浓度标准模板的real-time PCR扩增曲线;NC.阴性对照
1-5.real-time PCR amplification curves of 6.276×106copies/μL to 6.276×105copies/μL diluted standard template,respectively;NC.Negative control
图2实时荧光定量PCR扩增曲线
Fig.2 The amplification curves of real-time PCR
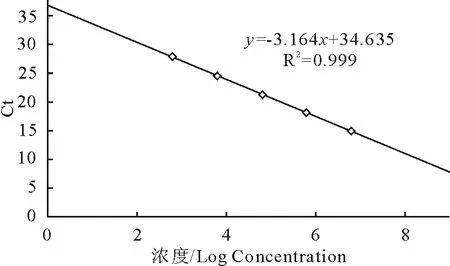
图3 实时荧光定量PCR标准曲线

图4 实时荧光定量PCR熔解曲线
2.4 real-time PCR特异性试验
分别以PEDV、CSFV、PRV和PCV2的cDNA或者DNA为反应模板,用建立的real-time PCR方法扩增,结果表明只有PRRSV有荧光信号(图5),说明所建立的real-time PCR方法特异性好。
2.5 real-time PCR灵敏性试验
以6.276×104copies/μL~6.276×100copies/μL的标准模板为反应模板,进行real-time PCR方法扩增。以 6.276×104copies/μL~6.276×101copies/μL的标准模板作为反应模板,进行常规PCR方法扩增。结果表明,real-time PCR方法检出限为6.276×101copies/μL(图6),常规PCR方法检出限为6.276×103copies/μL(图7),说明建立的real-time PCR检测方法与常规RT-PCR相比灵敏100倍。
2.6 real-time PCR重复性试验
以6.276×106、6.276×106、6.276×104copies/μL的标准模板为反应模板,每个模板做3个重复,进行组内重复试验(表1),每隔1周做1次,每次做3个重复,计算平均值,做3次,进行组间重复试验(表2)。结果显示,建立的real-time PCR方法的变异系数在1%以下,其重复性表现优异。
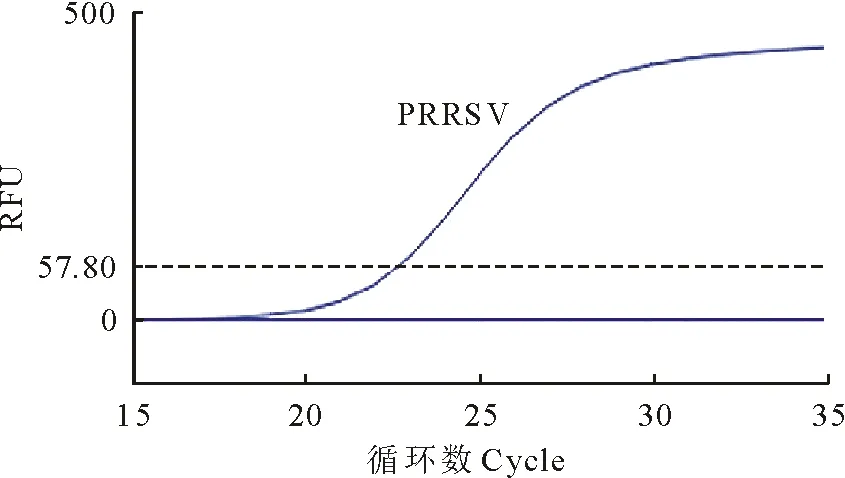
图5 实时荧光定量PCR特异性试验扩增曲线

1~5. 6.276×104copies/μL~6.276×100copies/μL 5个不同浓度标准模板的real-time PCR扩增曲线;NC.阴性对照
1-5.real-time PCR amplification curves of 6.276×104copies/μL to 6.276×100copies/μL diluted standard template,respectively;NC.Negative control
图6实时荧光定量PCR灵敏性试验
Fig.6 Sensitivity test of real-time PCR

M.DNA标准DL 2 000;1~4. 6.276×104copies/μL~6.276×101copies/μL 4个不同浓度标准模板的常规PCR产物;NC.阴性对照
M.DNA Marker DL 2 000; 1-4.The PCR products of 6.276×104copies/μL to 6.276×101copies/μL diluted standard template; NC.Negative control

图7 常规PCR灵敏性试验

表2 实时荧光定量PCR组间重复试验
2.7 检测方法的初步应用
对疑似PRRSV感染的27份临床组织或病料用常规RT-PCR方法和建立的real-time PCR方法分别进行检测。结果用常规RT-PCR方法检出21份阳性,real-time PCR方法检测出24份阳性(包括常规RT-PCR方法检出的21份阳性在内),real-time PCR 方法比常规RT-PCR方法多检出3份。
3 讨论
我国自1995年发现猪蓝耳病后,到目前在全国大部分区域均见有报道,随着PRRSV毒株的变异和基因型分布的差异,以及疫苗的使用,临床上仅根据发病症状和病理变化诊断猪蓝耳病已变得相对比较困难,因此,借助实验室检测手段对早期感染和隐性带毒者高效、快速的检出,可以为猪蓝耳防控与净化提供一定的帮助[11]。目前,实验室诊断PRRSV的方法主要有血清学试验诊断和分子生物学诊断。血清学试验一般用作抗体水平的检测;分子生物学诊断包括常规RT-PCR、依赖核酸序列扩增技术、原位杂交技术、环介导等温扩增技术、基因芯片技术、实时荧光定量PCR等。其中用荧光标记方法检测特异性产物的real-time PCR技术,因其灵敏度高、重复性好、定量准确、耗时短、过程封闭、操作简单、成本相对较低等众多优点,逐渐在病原体检测、目的基因表达量、疫苗质量控制等方面得到广泛的使用[12]。
由于荧光染料能够被嵌入到任何脱氧核糖核酸的双链间,所以real-time PCR荧光染料法的引物在设计时要认真考虑长度、退火温度、保守性、二聚体、发夹结构等方面的问题,尤其是其中的引物二聚体和发夹结构问题,其关系到定量的准确性[13]。在试验时,还要注意做好防污染工作,尽管试验操作比较简单,但操作中的污染如气溶胶的污染会出现假阳性的结果;在制作标准模板时,要使阳性质粒完全混合均匀,以此保证标准模板的浓度梯度正确性。以上方面考虑的越周全,得到的结果越稳定,越可靠。Eva Green作为饱和荧光染料,没有SYBR Green等非饱和染料的缺点—“染料重排”,制作的熔解曲线分辨率相对较高,而且可以在扩增过程当中及时的从DNA双链中释放出来,从而降低了对PCR扩增过程的影响,因此使用Eva Green染料定量,比使用SYBR染料准确性高[14-15]。
在我国,目前流行的PRRSV毒株的基因型主要为北美型[16],在PRRSV的9个开放阅读框中,ORF7最为保守,因此ORF7常被作为PCR、ELISA等检测方法中主要的检测目标[17-19]。本研究根据NCBI上登录的PRRSV的ORF7基因,设计了1对扩增的目的片段为144 bp的特异性引物,构建阳性质粒标准模板,使用Eva Green作为信号报告荧光,建立PRRSV real-time PCR的检测方法。结果表明,该检测方法的标准曲线具有良好的线性关系,熔解曲线峰单一;特异性强,只能检测出PRRSV,最低检测拷贝数为6.276×101copies/μL,与常规RT-PCR相比灵敏100倍;重复试验变异系数在1%之下,重复性良好;用建立的real-time PCR方法检测27份怀疑PRRSV感染的样本,结果比常规RT-PCR的检测结果高出3份阳性;整个real-time PCR扩增过程只需45 min,时间过程短。
综上所述,本研究建立的PRRSV real-time PCR检测方法,具有良好的特异性、灵敏性和重复性,而且耗时短,可用于临床检测猪繁殖与呼吸综合征病毒感染,对猪蓝耳病的防控提供一定的帮助。

