猪流行性腹泻病毒变异株GDqy2017的分离及S和ORF3基因序列分析
楚品品,蒋智勇,林德锐,徐志宏,李 艳,勾红潮,卞志标,李春玲*,蔡汝健*
(1.广东省农业科学院动物卫生研究所/广东省畜禽疫病防治研究重点实验室/农业部兽用药物与诊断技术广东科学观测实验站,广东广州,510640; 2. 广东永顺生物制药股份有限公司,广东广州 511356)
猪流行性腹泻(Porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)引起的一种高度传染性肠道疾病,临床症状以呕吐、水样腹泻及脱水等为主。各年龄猪均可感染,对1周龄~2周龄尤其10 d内的仔猪影响最大,发病率与病死率可高达100%。2010年前,我国PED的发生一直处于散发状态,直到2010年秋,在我国南部出现暴发,尤其是变异株的不断出现,尽管使用疫苗,却依然对我国养猪业造成了持续而重大的影响[1]。
PEDV基因组为不分段的单股正链RNA,基因组全长约28 kb,除5′端非编码区与3′端非编码区外,至少还有7个开放阅读框,编码4个主要结构蛋白,即纤突(S)蛋白、小膜(E)蛋白、膜(M)蛋白与核衣壳(N)蛋白,3个非结构蛋白,即复制酶1 a和1 b及ORF3辅助蛋白。其中,由于S基因存在高频变异,对S基因的监控在一定程度上反映了毒株的变异性[2]。另外,已有研究表明PEDV弱毒疫苗株与亲代野毒株相比,ORF3存在不同程度的大片段连续缺失,该缺失可能与PEDV的毒力有关,也为疫苗株与野毒株的区分提供了一定依据[3]。
病毒的分离与培养为其进一步研究提供了必要的基础,1988年,Hoffmann M等[4]建立了以Vero细胞为基础的PEDV分离方法,并得到了广泛的应用。由于病毒对细胞的适应性往往与细胞的特性、病毒的特性及培养条件相关,本研究参考Hoffmann等所建立方法,分离到1株对Vero敏感的PEDV变异株,同时扩增及测序获得了其S基因和ORF3基因序列,分析了S蛋白的主要抗原表位,同时做了序列一致性及进化树分析,以期为后续PEDV分子生物学分析、流行病学调查及筛选更为有效的疫苗提供理论依据。
1 材料与方法
1.1 材料
1.1.1 病料与细胞 病料为广东省某养猪场送检腹泻死亡仔猪小肠和内容物,保存于-70℃。Vero细胞为广东省农业科学院动物卫生研究所猪病研究室保存。
1.1.2 主要试剂 胎牛血清、胰酶及DMEM基础培养液,Gibco公司产品;病毒DNA/RNA提取试剂盒,Magen公司产品;RT-PCR相关试剂盒,Vazyme公司产品;DNA Marker DL 2 000,TaKaRa公司产品;胶体金检测试剂盒,Bionote公司产品;引物合成及序列测定由上海生工生物工程技术服务有限公司完成;其他所用试剂均为进口或者国产分析纯。
1.2 方法
1.2.1 病料处理 将病料样品剪碎后,与PBS缓冲液以1∶5(W/V)比例进行研磨处理,反复冻融3次后,4℃、10 000 r/min离心3 min,收集上清,使用0.22 μm微孔滤器过滤,滤液分装,置-70℃保存。
1.2.2 胶体金试剂盒检测 采用猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)、猪轮状病毒(Porcine rotavirus,PoRV)及猪传染性胃肠炎病毒(Transmissible gastroenteritis virus,TGEV)胶体金试剂盒对病料进行初步检测,结果判定如说明书所述,在视窗左边出现2条带结果为阳性,仅出现对照带为阴性,未出现对照带结果无效。
1.2.3 腹泻病原RT-PCR检测 对于猪腹泻病毒的检测已建立了多种多重RT-PCR方法,参照文献[5]所建立多重RT-PCR方法(PEDV上游引物:5′-TTCTGAGTCACGAACAG-CCA-3′,PEDV下游引物:5′-CATATGCAGCCTGCTCTGAA-3′,目的片段大小为651 bp;TGEV上游引物:5′-TTCAAGGT-CACGCTCTCA-3′,TGEV下游引物:5′-GCTT-CCAAACAAAATGCTA-3′,目的片段大小为397 bp;PoRV上游引物:5′-TCTTTCGT-TCTTGTGAGT-3′,PoRV下游引物:5′-TTGAGATAATGTGTCCTTC-3′,目的片段大小为270 bp) 对病料进一步检测。
1.2.4 病毒分离 PEDV的分离参考Hoffmann M等[4]建立的方法,稍做修改,具体如下:按常规方法培养Vero细胞,传入6孔板,待其长至单层且状态良好,弃去培养液,PBS洗板2次,将上述处理好的病毒液用细胞培养液DMEM稀释5倍,500 μL/孔传入6孔板,轻轻晃动,使病毒液均匀覆盖细胞表面,将6孔板置于37℃、体积分数为5%CO2的培养箱中孵育1 h,期间晃动数次,1 h后取出培养板,弃去病毒液,PBS洗板1次,加入含10 μg/mL胰酶的DMEM培养液2 mL,再次置于培养箱培养,每天观察,待其出现明显细胞病变(cytopathic effect,CPE)或者培养至7 d,收毒,记为第1代,置于-70℃保存或者反复冻融3次,在Vero细胞中继续传代培养。
1.2.5 S基因和ORF3基因序列克隆及测序 根据GenBank收录的PEDV CV777全基因组序列设计特异引物(引物序列见表1),扩增分离毒株的S基因和ORF3基因全序列,电泳结果为阳性的PCR产物,进行纯化并克隆测序。

表1 PEDV S基因和ORF3基因特异引物序列
1.2.6 序列分析 利用DNA Star软件对测得S基因相关序列进行拼接,获得S基因全序列。登录NCBI GenBank下载国内外PEDV分离株和疫苗株的S基因和ORF3基因序列做参考(PEDV参考毒株信息见表2),利用DNA Star及Biodit软件进行序列比对分析,同时利用MEGA6.0软件选择NJ方法(Bootstrap 1 000)对核苷酸序列进行遗传进化分析。
2 结果
2.1 腹泻病原检测
采用猪流行性腹泻病毒、猪轮状病毒及猪传染性胃肠炎病毒胶体金试剂盒对病料进行初步检测,仅PEDV胶体金呈现阳性结果,其他2种腹泻相关病毒为阴性结果。参考已建立的多重RT-PCR方法对病料进一步检测,经电泳分析,结果如图1,与胶体金结果一致,仅出现了PEDV相应条带,而另外2种腹泻相关病毒无条带产生,为阴性。
2.2 病毒的分离与培养
将研磨冻融过滤除菌后的病料接于Vero细胞上,第1代培养至第7天时出现细胞病变特征,传至第4代时在1天内细胞病变特征明显,细胞肿胀、变圆、融合、合胞体形成,最终脱落等,连续传至第12代,细胞病变特性及病变时间稳定。细胞病变情况如图2,将分离到的病毒命名为GDqy2017。

表2 PEDV参考毒株信息
注:S和O分别代表S基因和ORF3基因序列登录号,未标注的为全基因序列登录号。
Note:S and O represent the GenBank accession numbers of the S and ORF3 gene sequences,and others represent the GenBank accession numbers of the full genome sequences.
2.3 分离株特异性RT-PCR鉴定
对病变产物用3种腹泻病原特异引物进行RT-PCR鉴定,结果显示,仅PEDV引物扩增获得了预期大小条带,而其他病原结果为阴性(图3)。

M.DNA标准DL 2 000;1.阴性对照;2.猪流行性腹泻病毒;3.猪传染性胃肠炎病毒;4.猪轮状病毒
M.DNA Marker DL 2000;1. Negative control;2.PEDV;3.TGEV;4.PoRV
图1 PEDV、PoRV和TGEV的RT-PCR检测结果
Fig.1 RT-PCR detection results of PEDV,PoRV and TGEV
2.4 S基因及ORF3基因序列扩增
使用前期设计的3对S基因特异引物,分段扩增分离株的S基因全序列,结果见图4A,分别获得了大小为1 654、1 610、1 447 bp的条带,与预期大小相符。利用ORF3基因的特异引物进行RT-PCR扩增,同样获得了预期大小的目的条带(848 bp),结果见图4B。
2.5 分离株S基因序列分析
利用DNA Star软件对测得的3段S基因相关序列进行拼接与组装,获得了GDqy 2017 S基因的全序列,由4 158个核苷酸组成,编码1 385个氨基酸。与经典毒株CV777相比,S基因存在较大变异,其氨基酸序列中出现98处突变,2处插入(58QGVN61和140N),2处缺失(158DI159和1194Y)(图5),不存在中国疫苗株CV777 vaccine中157位的缺失,另外与CH/GDQY/2011、GDQY/2011插入缺失情况不同,与CHGD01、GD1及HBHG4的插入缺失相同,但是存在不同的位点突变。
以国内外具有代表性及国内近几年分离的PEDV毒株为参考株,与本次分离株GDqy2017进行S基因核苷酸序列和氨基酸序列比对分析,序列同源性分别为93.7%~99.1%和92.4%~98.8%,与国内2010年后出现的参考株(除CH-XBC-01-2015、CH/GDQY/2011)序列同源性较高,分别为95.8%~99.1%和94.8%~98.8%,与2010年以前出现的参考株(包括CH-XBC-01-2015、CH/GDQY/2011)同源性偏低,仅93.7%~95.2%和92.5%~94.6%,与2016年湖北分离株HBHG4的同源性最高,分别为99.1%和98.8%;与国外大部分参考株序列同源性偏低,分别为93.9%~95.2%和92.4%~95.2%,与SBPED0211-1(泰国)、PEI-023(加拿大)和USA/Colorado/2013 (美国)序列同源性较高,分别为96.1%、97.5%、97.6%和96.2%、97.5%、97.7%,与CV777及疫苗株CV777 vaccine的序列同源性分别为94.1%(核苷酸序列)、92.7%(氨基酸序列)和94.2%(核苷酸序列)、93.4%(氨基酸序列)。

A.正常Vero细胞;B.样品处理后接种Vero细胞-F1;C.感染 Vero细胞-F4A.Normal Vero cells; B.Infected Vero cells-F1; C.Infected Vero cells-F4
M.DNA标准DL 2 000;1.阴性对照;2.猪传染性胃肠炎病毒;3.猪流行性腹泻病毒;4.猪轮状病毒
M.DNA Marker DL 2 000;1.Negative control;2.TGEV;3.PEDV;4.PoRV
图3 PEDV、PoRV和TGEV RT-PCR鉴定结果
Fig.3 RT-PCR identification results of PEDV,PoRV and TGEV

M.DNA标准DL 2 000;4、5.阴性对照;1.S1-P1/P2扩增产物;2.S2-P1/P2扩增产物;3.S3-P1/P2扩增产物;6.ORF3-P1/P2扩增产物
M.DNA Marker DL 2 000;4,5.Negative control;1.Amplification product of S1-P1/P2;2.Amplification product of S2-P1/P2;3.Amplification product of S3-P1/P2;6.Amplification product of ORF3-P1/P2
图4 S基因和ORF3基因的RT-PCR扩增结果
Fig.4 RT-PCR amplification resultes of S gene and ORF3 gene

方框内为插入或缺失位点,黑色三角标注为本次分离株GDqy2017Insertions and deletions are marked by boxes; GDqy2017 is marked by black triangle
系统进化树分析由图6结果显示,PEDV毒株可分为3个群,GDqy2017与14株2010年后国内分离毒株、泰国分离株(SBPED0211-1)、加拿大分离株(PEI-023)、美国分离株(USA/Colorado/2013)及韩国株(Chinju99)、日本株(NK)同属群1,3株中国分离株株(CH/S、 LZC和CH/GDQY/2011)、比利时株CV777、英国株Br1/87和疫苗株(CV777 Vaccine、attenuated DR13)共同构成群2,3株2010年前国内分离株(JS-2004-2、LJB/03、DX)与2015年国内分离株CH-XBC-01-2015,以及越南分离株HUA-PED58、美国分离株OH851、德国分离株GER/L00721/2014构成群3。
PEDV S蛋白作为膜表面糖蛋白,包含4个重要的中和抗原表位,对本次分离株以及其他3株广东分离株与经典毒株CV777的4个关键抗原表位分析可知(图7),所有参与比对毒株,抗原表位748YSNIGVCK755与1368GPRLQPY1374较为保守,不存在突变,在所有广东株中抗原表位764SQSGQVKI771保持一致,而不同于CV777764SQYGQVKI771,在最长的抗原表位中,GDqy2017株存在1处不同于其他对比株的独特突变,即640处F→S。
2.6 分离株ORF3基因序列分析
比对分析发现GDqy2017 ORF3基因完整序列其由675个核苷酸组成,编码224个氨基酸。将GDqy2017、CV777、 我国疫苗株CV777及韩国疫苗株attenuated DR13的ORF3氨基酸序列进行比对(图8)发现中国疫苗株CV777 vaccine和韩国疫苗株attenuated DR13仅编码91个氨基酸,GDqy2017与经典株CV777一样,编码224个氨基酸,不存在疫苗株中特有的大片段缺失及截短现象,但与经典株CV777相比,存在10处突变,与中国疫苗株CV777 vaccine相比,仅存在1处突变(25位L→S)。
GDqy2017 ORF3基因核苷酸序列和氨基酸序列与参考株比对分析结果显示, GDqy2017 ORF3与国内外参考株序列同源性分别为93.4%~99.0%和91.2%~100%。其中与中国疫苗株CV777 vaccine的同源性为95.3%(nt)和91.2%(aa),与CH/GDQY/2011核苷酸序列同源性最高(99.0%),与AJ1102、CH/GDQY/2011和CHGD-01氨基酸序列完全一致,达到100%。系统进化树分析结果显示(图9),PEDV毒株分4个群,13株2010年后国内分离株、1株2010年前国内分离株(CH/S)及2株美国分离株(USA/Colorado/2013、OH851)和1株韩国分离株(Chinju99)组成群1,2株疫苗株(CV777 Vaccine、attenuated DR13)构成群2,CV777、Br1/87和LZC构成群3,GDqy2017、广东其他分离株及2007年分离株DX构成群4。
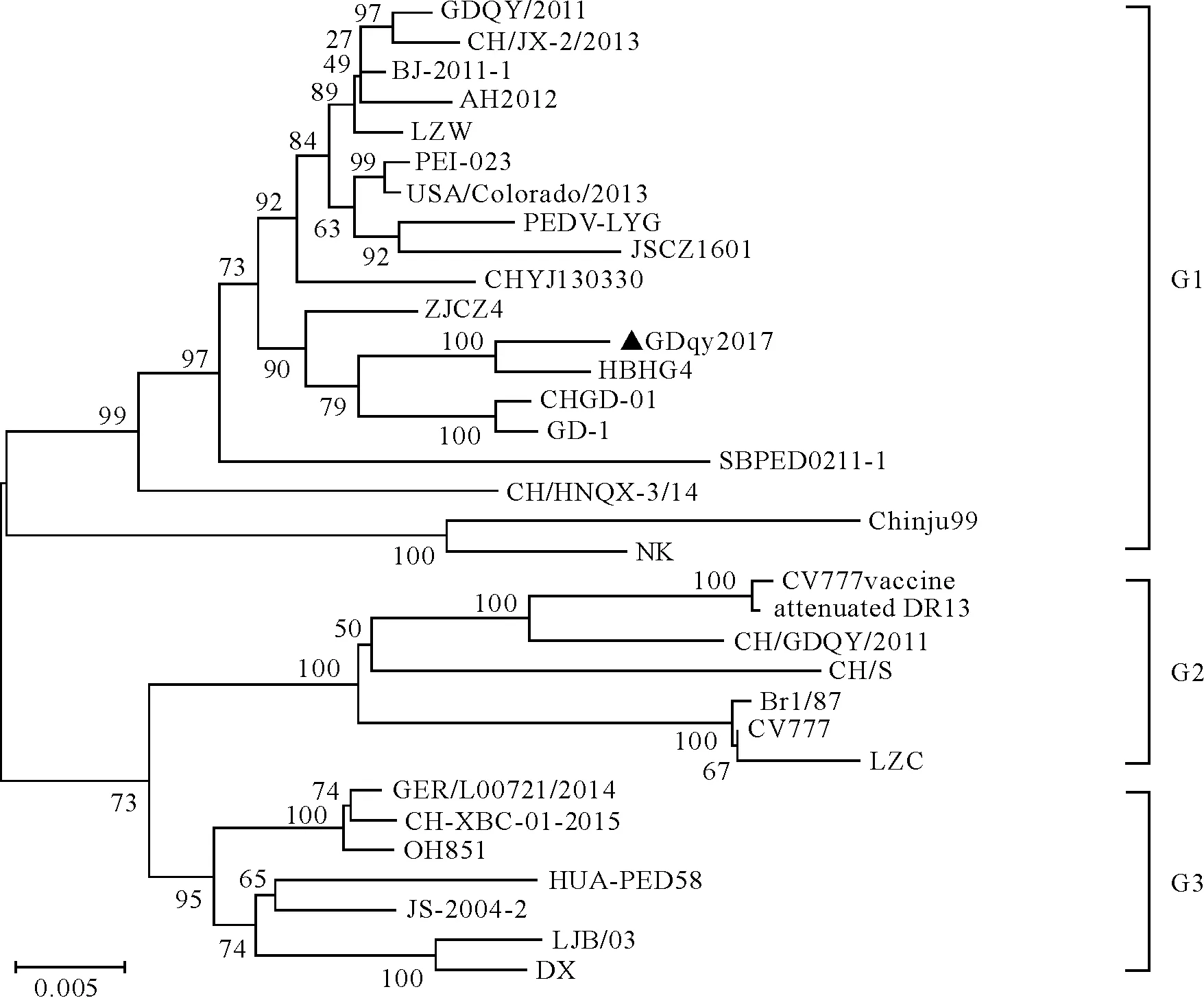
黑色三角标记为本次分离株GDqy2017
GDqy2017 is marked by black triangle
图6 PEDV S基因核苷酸序列遗传进化分析
Fig.6 Phylogenetic analysis based on the nucleotide sequences of PEDV S gene

方框内为主要抗原表位,黑色三角标记为本次分离株GDqy2017The major epitopes are marked by boxes,GDqy2017 is marked by black triangle

方框内为突变位点,黑色三角标记为本次分离株GDqy2017Insertions and deletions are marked by boxes; GDqy2017 is marked by black triangle

黑色三角标记为本次分离株GDqy2017GDqy2017 is marked by black triangle
3 讨论
猪流行性腹泻自出现以来,已广泛流行于欧洲和亚洲的多个国家和地区,我国于1984年分离到了第1株PEDV,之后各地零星发生PEDV的感染,至2010年秋出现大范围暴发,2013年,美国也出现了PEDV的相关报道[6]。尽管有疫苗的使用,但却依然无法阻止新毒株的流行。PEDV更广泛的传播以及变异株的不断出现,给养猪业带来了更大的压力,也对PEDV更为有效疫苗的研发提出了更为迫切的需求。
本研究在Hoffmann M建立的方法基础上,稍加修改,利用本研究室保存的Vero细胞分离到了1株PEDV变异株,命名为GDqy2017。由于病毒对细胞的适应性往往与细胞的特性、病毒的特性及培养条件相关,部分报道分离到的PEDV前几代并不在Vero细胞上产生细胞病变,仅通过分子生物学检测手段可检测到PEDV的存在,盲传多代后才可观察到细胞病变[7-11]。而该分离株对本研究所使用Vero细胞敏感,接种第1代在第7天便出现细胞病变,传至第4代在1天内便出现明显细胞病变特征,连续传至第12代,细胞病变时间与形态稳定。
为进一步了解该病毒,对其关键基因S基因与ORF3基因进行扩增与分析。本研究所获得分离株GDqy2017全长4 158 nt,编码1 385个氨基酸。PEDV作为冠状病毒Ⅰ群成员,S蛋白同样可分为2个功能区,即负责与受体结合的S1和膜融合的S2,研究表明S蛋白的变异集中在S1区,尤其集中在其氨基端[12]。与经典毒株CV777 S蛋白相比,本次分离株氨基酸序列中出现98处突变、2处插入及2处缺失,大部分突变及全部插入和1处缺失存在于S1区的氨基端,有1处缺失出现在了较为稳定的S2区。PEDV S蛋白作为膜表面糖蛋白,包含4个重要的中和抗原表位[13],插入与缺失并未发生在GDqy2017的4处抗原表位中,但是存在部分突变,这些突变在广东分离株中大部分一致,有1处仅发生在GDqy2017中,即640处的F(苯丙氨酸)突变为S(丝氨酸),苯丙氨酸属疏水氨基酸,而丝氨酸为亲水氨基酸。这些变化对病毒的致病性、抗原性乃至体外培养对细胞的适应性有怎样的影响有待研究。
从S基因序列同源性及系统进化树分析可知,GDqy2017与国内2010年后出现的参考株(除CH-XBC-01-2015、CH/GDQY/2011)序列同源性较高,分别为95.8%~99.1%和94.8%~98.8%,且同属于一个进化群,其中与GDQY/2011处于同一进化群的不同分支,与CHGD01亲缘关系近。与CH/GDQY/2011的差异较大,序列同源性仅为94.7%(核苷酸序列)和93.6%(氨基酸序列),属于不同的进化群。与经典毒株CV777、国内早期经典株及中国疫苗株CV777 vaccine、韩国疫苗株attenuated DR13序列差异较大,同源性较低且进化关系较远,提示当前流行毒株仍以变异株为主,对以CV777为原型改造的疫苗株的有效性提出了挑战。
ORF3基因位于S基因与E基因之间,编码一辅助蛋白,研究表明其与病毒致病性密切相关,疫苗株CV777与疫苗株attenuated DR13基因中存在大片段连续缺失,该缺失导致了基因表达的截短(仅编码91个氨基酸),使得PEDV毒性变弱,也为临床诊断提供了一定依据[14]。本研究分离株GDqy2017基因675 nt,编码224个氨基酸,与经典毒株CV777相同,不存在疫苗株中的大片段缺失及表达截短现像。与经典毒株CV777相比,存在10处突变,与中国疫苗株CV777相比,仅存在一处突变。进化树分析显示,GDqy2017(G4)与经典毒株CV777(G3)以及疫苗株(G2)分别属于不同的群,亲缘关系较远,与各群的核苷酸序列同源性分为93.4%~96.1%(G1)、95.3%(G2)、94.8%~96.1%(G3)和97.8%~99.0%(G4),与广东其他分离株处于同一分支,具有一定地域性,其中与2012年广东分离株CHGD01核苷酸序列同源性为98.8%,具有完全同源性的氨基酸序列。
综上所述,本研究分离到一株猪流行性腹泻病毒变异株(GDqy2017),对其关键基因S基因与ORF3基因分析显示,其与国内近几年分离株相关性较大(尤其2012年广东分离株CHGD01),但与CHGD01相比,它对Vero细胞更敏感,有更强的适应性,为筛选与研制更为有效的疫苗提供了备选与依据。

