ULK1、p53在大肠癌及癌前病变中的表达及临床意义
詹义凤 薛敬玲 汤泉泉 张功学
(武汉大学基础医学院 武汉 430071)
大肠癌是多种致癌因素作用导致的恶性病变,在我国恶性肿瘤疾病中其发病率和病死率均居前5位[1]。据报道,随着早期检测和治疗技术不断发展,可提高大肠癌患者的存活率[2],在提高大肠癌患者治疗疗效及改善预后方面均有着十分重要的意义,但目前尚缺乏敏感的实验室指标。有研究认为,ULK1(unc-51 like kinase 1)自噬基因可能成为探讨肿瘤疾病发生发展、抑制肿瘤组织生长、克服肿瘤化疗耐药性研究的新作用靶点[3]。p53是抑癌基因,它参与细胞生长和转录调节,p53能与多种编码调节自噬蛋白的基因启动子结合,如AMPK和mTORC1的调控分子,自噬核心通路蛋白和溶酶体相关蛋白等[4]。近来研究表明,p53蛋白作为细胞核内一种促进自噬的转录因子,以依赖转录的方式参与自噬过程[5]。本实验通过免疫组化方法检测ULK1和突变型p53在大肠组织中的表达,探讨其与肿瘤大小、肿瘤浸润深度、分化程度、淋巴结转移和TNM分期等临床病理因素的相关性,为临床患者的临床诊断及预后判断提供有力的依据。目前尚无ULK1及p53同时在大肠癌及癌前病变中的表达及临床意义的探讨,本研究拟予以探讨。
1 资料与方法
1.1 临床资料
选取2016年7月~2017年6月在湖北省枣阳市第一人民医院进行手术切除及活检切除的组织标本,其中正常大肠黏膜组织,共20例,大肠腺瘤伴低级别上皮内瘤变组织、大肠腺瘤伴大肠高级别上皮内瘤变组织以及大肠癌组织,分别为30、30、40例。所有组织标本均已经病理组织学诊断证实。
1.2 研究方法
1.2.1试剂
兔抗人ULK1单克隆抗体购自武汉博士德生物生物技术有限公司,突变型p53单克隆抗体购自福州迈新生物技术公司,Maxvision3 Ultra DAB酶底物显色试剂盒购自福州迈新生物技术公司。
1.2.2检测方法
各组组织学标本均采用10%甲醛溶液固定处理,常规予以石蜡包埋,3~4μm厚度连续组织切片。各组组织切片脱蜡至水,采用柠檬酸缓冲液高压修复作用2min,滴加一抗溶液ULK1(工作浓度为1∶15),p53溶液(即用型)在4℃温度条件下过夜处理,然后滴加羊抗兔二抗溶液孵育30 min,DAB显色作用5 min,然后予以苏木素复染、脱水、透明及封片,以PBS溶液代替一抗作为阴性对照,在光学显微镜下对组织切片予以判读。
1.3 结果评估
由两位有经验的病理科医生采用双盲法分别独立阅片。免疫组化结果主要根据阳性细胞在全部组织细胞中所占比例以及阳性细胞染色强度来判定。ULK1表达在细胞质,按染色强度:无染色为0分、浅黄色为1分、黄色为2分、深棕色(黄褐色,颜色偏深)为3分;按阳性细胞所占百分比:<5%为0分、6%~25%为1分、26%~50%为2分、51%~75%为3分、>75%为4分。两项评分相乘,乘积结果行最后评分:0~1分为(-),2~3分为(+),4~6分为(++),>6分为(+++)。截断点为3分,总分≤3分为阴性,>3分为阳性[6]。p53表达在细胞核:缺乏或弱染色1 分,中度染色2 分,强染色3 分;阳性细胞百分比:<10% 为1 分,10%~50%为2 分,>50% 为3 分。将染色和阳性细胞百分比2 项得分相乘,1~3分为p53 阴性,>3 分p53为阳性[7]。
1.4 统计学方法
采用SPSS19.0统计软件进行数据分析,率比较采用χ2检验,P<0.05表示差异有统计学意义。
2 结果
2.1 ULK1和p53在正常大肠组织、低级别上皮内瘤变、高级别上皮内瘤变和大肠癌组织中的表达
图1显示,ULK1阳性染色为细胞质内出现棕黄色颗粒,p53阳性染色为细胞核出现棕黄色颗粒。表1所示,正常大肠组织、低级别上皮内瘤变、高级别上皮内瘤变和大肠癌组织中,ULK1蛋白的阳性表达率分别为30%、53%、67%、78%,阳性表达率呈升高趋势,4组之间ULK1蛋白阳性率表达差异均有统计学意义(P<0.05);p53蛋白的阳性表达率分别0、7%、40%、63%,阳性表达率也呈升高趋势,4组之间p53蛋白阳性率表达差异均有统计学意义(P<0.05)。
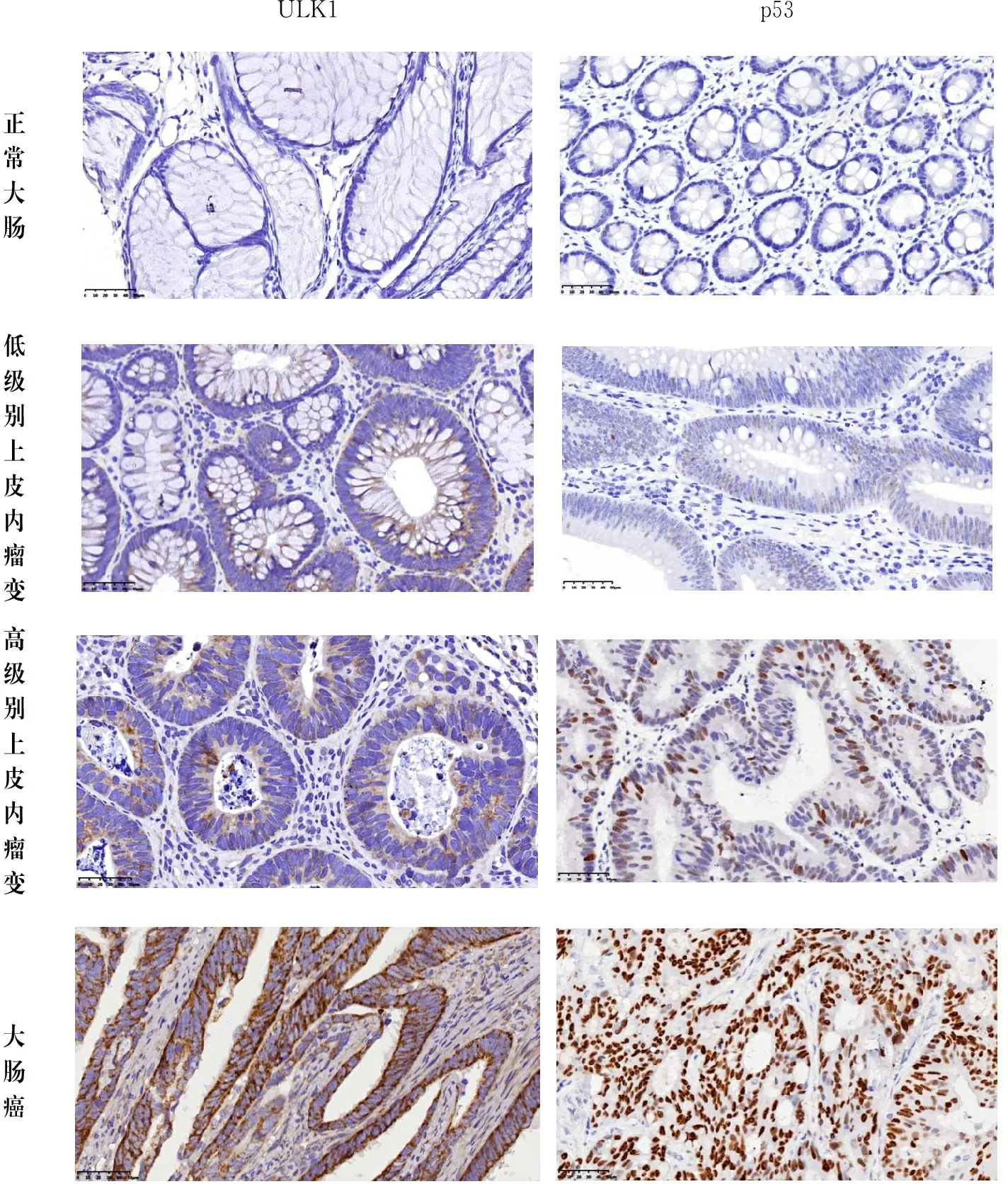
ULK1p53正常大肠低级别上皮内瘤变高级别上皮内瘤变大肠癌
图1 ULK1和p53在不同病理特征的大肠组织中的表达
表1 ULK1和p53在不同病理特征的大肠组织中阳性率表达情况
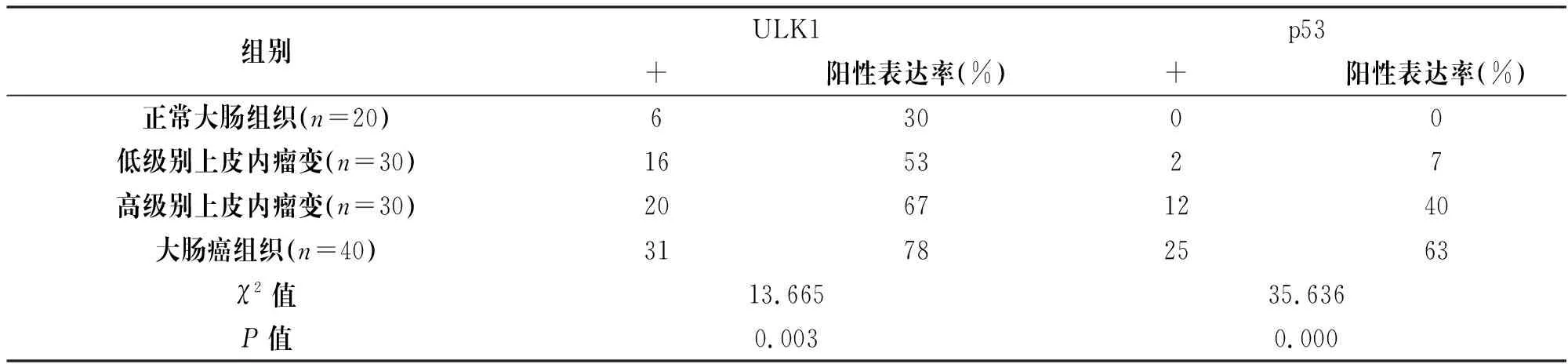
组别ULK1p53+阳性表达率(%)+阳性表达率(%)正常大肠组织(n=20)63000低级别上皮内瘤变(n=30)165327高级别上皮内瘤变(n=30)20671240大肠癌组织(n=40)31782563χ2值13.66535.636P值0.0030.000
2.2 大肠癌ULK1、p53表达与临床病理特征的关系
表2显示,ULK1、p53的阳性表达率与大肠癌的组织学分化、浸润深度、淋巴结转移以及TNM分期有关;ULK、p53阳性率的表达,低分化腺癌组高于中-高分化腺癌组,浸润深度深组高于浸润浅组,有淋巴结转移组高于无淋巴组,TNM分期Ⅲ~Ⅳ期组高于分期Ⅰ~Ⅱ期组(P<0.05)。大肠癌中ULK1、p53表达与肿瘤大小无关。
3 讨论
细胞自噬是一种防御和应激调控机制。细胞通过细胞自噬和溶酶体,可及时清除和回收失活的蛋白分子和受到严重损伤的细胞器,为细胞的再生提供原料和能量。在肿瘤形成过程中,自噬可以作为抗癌机制发挥作用,它可以抑制ROS引起的损伤,并在DNA修复中发挥作用以及通过降解长寿蛋白质、缺陷细胞器控制细胞内稳态,抑制肿瘤的发展,也可以让肿瘤细胞耐受缺氧、饥饿、放疗、化疗等的刺激,甚至使肿瘤细胞长期存活[8]。在细胞内ULK1与Atg13、FIP200、Atg101等紧密结合形成的ULK1复合物位于自噬诱导的核心地位[9]。实验证明干扰ULK1的表达就可以阻断自噬的发生[10]。p53是一个抑癌基因,野生型p53参与对自噬的调节,这种调节依赖于p53蛋白在细胞内所处的部位,即核内的p53能促进自噬[11],而胞质内的p53则抑制自噬[4]。p53通过哺乳动物雷帕霉素靶蛋白(mTOR)依赖通路和非依赖 mTOR 通路[12],参与自噬的调控。在哺乳动物雷帕霉素靶蛋白(mTOR)依赖通路中mTORC1 直接与 ULK1 相互作用或使之磷酸化从而影响ULK复合体的形成[13]。野生型p53(WTp53)因为半衰期短,特别不稳定,在细胞内的含量很低,免疫组化的方法根本无法检测到,因此本实验中的p53为突变型p53。本研究显示ULK1和突变型p53在大肠各组标本中变化趋势一致,那么突变型p53对ULK1是否起正向调节作用,还有待进一步研究。
表2 大肠癌ULK1、p53表达与临床病理特征的关系
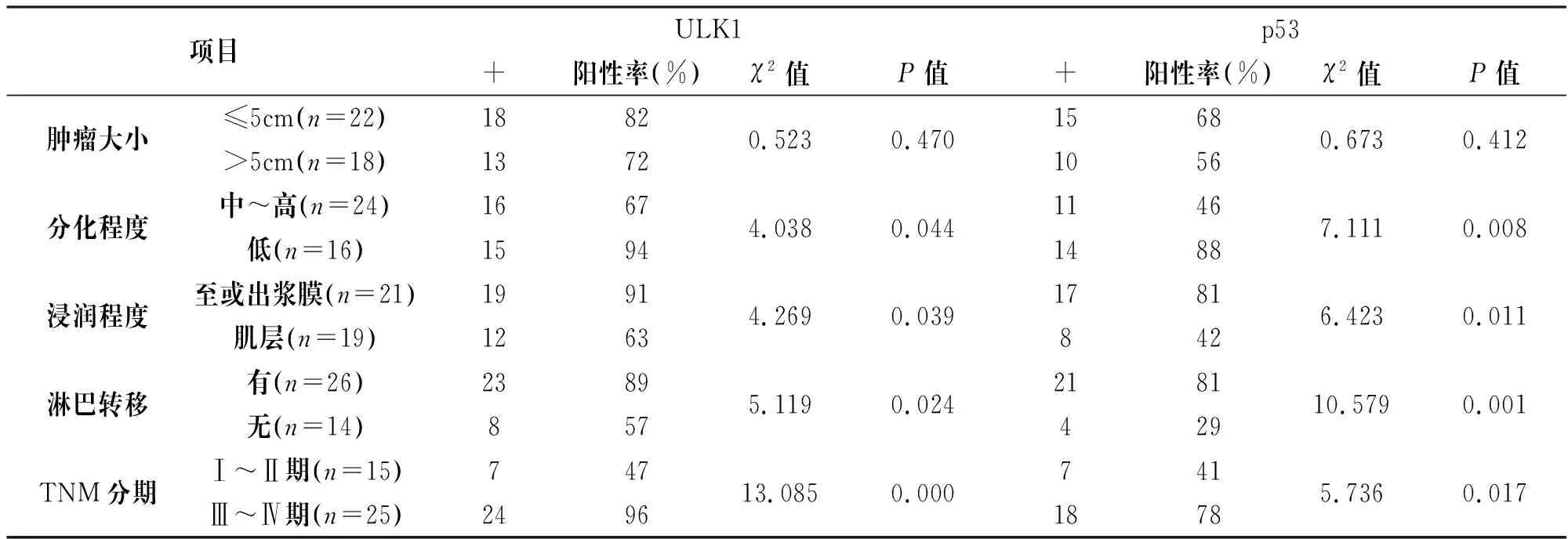
项目ULK1p53+阳性率(%)χ2值P值+阳性率(%)χ2值P值肿瘤大小≤5cm(n=22)1882>5cm(n=18)13720.5230.470156810560.6730.412分化程度中~高(n=24)1667低(n=16)15944.0380.044114614887.1110.008浸润程度至或出浆膜(n=21)1991肌层(n=19)12634.2690.03917818426.4230.011淋巴转移有(n=26)2389无(n=14)8575.1190.024218142910.5790.001TNM分期Ⅰ~Ⅱ期(n=15)747Ⅲ~Ⅳ期(n=25)249613.0850.00074118785.7360.017
随着大肠癌组织、高级别上皮内瘤变组织、低级别上皮内瘤变组织、正常结肠黏膜组织,本研究结果显示ULK1,p53阳性率均明显降低(P<0.05),有研究表明ULK1蛋白在人类乳腺癌组织、外阴癌组织中表达水平较正常组织明显下调[6,14],这与本研究结果不一致。这可能与自噬的双重调节机制有关[15],一方面自噬可以抑制肿瘤的发生、发展;另一方面,一旦肿瘤形成后,自噬可以使癌细胞在应激的条件下存活。在大肠腺瘤癌变及早期大肠癌阶段,突变型P53高表达,提示进展期腺瘤转变为大肠癌过程中,突变型p53起了很重要的作用。突变型p53基因通过抑制野生型p53基因,使DNA 受损的细胞无受控的发生异型增殖,同时还直接或间接地抑制受p53基因上调表达的凋亡调控基因(PUMA)、p63、p73的促凋亡功能,促进大肠癌的发生。本研究P53的表达与王莉[16]等研究是一致的.大肠癌ULK1、P53表达在分化程度、浸润深度、淋巴结转移TNM分期方面差异均有显著性意义,结果提示ULK1、P53在大肠癌的发生、发展、浸润和转移中起重要的调控作用,并可作为相对独立的参考指标进行检测,临床检测ULK1、P53在大肠癌早期诊断、治疗等方面具有重要的临床应用价值。

