急性早期前体T淋巴细胞白血病伴CD15、CD58、CD123阳性表达1例报道
刘雅宁, 孟予城, 杨淑莲, 刘军锋
(1. 廊坊市中医医院检验科,河北 廊坊 065000;2. 廊坊市中医医院五病区,河北 廊坊 065000;3.中国医学科学院 北京协和医学院 泰达国际心血管病医院,天津 300457)
急性早期前体T淋巴细胞白血病(early T-cell precursor acute lymphoblastic leukemia,ETP-ALL)属于早期非成熟的急性 T 淋巴细胞白血病(T-cell acute lymphoblastic leukemia,T-ALL)[1],占T-ALL的5.5%~35.0%。此病在2009年由COUSTANSMITH等[2]最先诊断。他们认为这是一种独特的生物学亚型白血病,肿瘤细胞非常早地从骨髓游移到胸腺细胞,并表达丰富的T淋巴细胞系标志以及干细胞和髓系的相关标志,有淋巴系和髓系的分化潜能,是一种成熟阻滞、分化很差的干细胞白血病。目前的治疗方法对许多罹患ETPALL的患者不起作用,无法使疾病进入缓解期,只有30.0%~40.0%的患者能成为长期幸存者[3]。儿童患此病治疗效果差,诱导缓解失败率、复发率均较成人高。此类型白血病没有特殊的临床表现,骨髓像亦无明显的诊断相关性,主要依赖于免疫分型对此类疾病进行诊断[4],我国鲜有报道。我们报道1例伴发白细胞分化抗原(cluster of differentiation,CD)15、CD58、CD123阳性表达的ETP-ALL。
1 临床资料
1.1 病史
患者,女,53岁,无明显诱因自觉面色萎黄、乏力、牙痛、牙龈肿胀10 d,就诊于当地县医院。初步检查无发热、无骨痛、无牙龈出血,给予抗炎症和对症治疗,效果不佳。血常规检查示:白细胞计数14.10×109/L,红细胞计数2.16×1012/L,血红蛋白69 g/L,血小板计数19×109/L,初步拟诊为血液病待查。为进一步诊断及治疗转至廊坊市中医医院。
1.2 体格检查
体温36.0 ℃;脉搏84次/分;呼吸20次/min;血压80/60 kPa,神志清,面色萎黄,无出血倾向,舌质淡,苔薄白,脉细数。中度贫血貌,浅表淋巴结未触及肿大,皮肤未见瘀斑,口唇色淡。咽部无充血。胸骨中下段压痛,双肺运动对称,叩诊正常清音,听诊双肺呼吸音对称清晰,未闻及干湿啰音和胸膜摩擦音。心相对浊音界不大,心率84次/min,律齐,各瓣膜听诊区未闻及病理性杂音。全腹软,无压痛及反跳痛,Murphy征(+)。无肌紧张,无包块,肝、脾肋下未及,脊柱及四肢外形无畸形,活动度正常。关节无红、肿、热、痛,无杵状指等。双下肢无水肿。四肢肌力、肌张力正常,深、浅反射正常存在,病理反射未引出。
1.3 实验室检查
1.3.1 全血细胞计数 白细胞计数13.06×109/L,红细胞计数2.14×1012/L,血红蛋白69 g/L,血小板计数16×109/L,平均红细胞体积102.8 fL,平均红细胞血红蛋白含量32.2 pg,平均红细胞血红蛋白浓度314 g/L,中性粒细胞百分比2.9%,淋巴细胞百分比85.5%,单核细胞百分比11.6%。外周血涂片显微镜分类幼稚淋巴细胞百分比64%。
1.3.2 生化项目检测 总蛋白64.4 g/L,白蛋白37.2 g/L,球蛋白27.2 g/L,白蛋白/球蛋白比值1.37,总胆红素8.69 μmol/L,直接胆红素2.37 μmol/L,尿素氮6.92 mmol/L,尿酸
247.5 μmol/L,肌酐46.2 μmol/L,丙氨酸氨基转移酶7 U/L,天门冬氨酸氨基转移酶6 U/L,乳酸脱氢酶96 U/L,肌酸激酶8 U/L,总胆固醇2.69 mmol/L,甘油三酯2.16 mmol/L,高密度脂蛋白胆固醇0.6 mmol/L,低密度脂蛋白胆固醇1.22 mmol/L,载脂蛋白A10.82 g/L, 载脂蛋白B 0.59 g/L。
1.3.3 免疫项目检测 乙型肝炎病毒血清标志物5项检测均阴性,抗丙型肝炎病毒抗体检测阴性,抗人类免疫缺陷病毒检测阴性。
1.3.4 骨髓涂片检查 骨髓涂片良好,骨髓小粒可见。淋巴细胞增生极度活跃,粒系增生受抑制,红系增生受抑制,成熟红细胞形态正常。原幼淋巴细胞占86.4%,细胞胞体大小不等,以大细胞为主,呈圆形、椭圆形或不规则形;胞核呈圆形、类圆形,部分细胞核扭曲、折叠;染色质细致,胞浆量少,呈蓝色或灰蓝色,未见颗粒。见图1。

图1 患者骨髓细胞象(瑞氏-吉姆萨染色,×1 000)
1.3.5 免疫分型 采用Cytomics FC500流式细胞分析仪(美国Beckman-coulter公司)进行免疫分型。取肝素抗凝骨髓样本直接进行免疫荧光标记法测定,荧光标记抗体组合如下:CD5/CD10/CD19/CD34/CD45、CD38/HLA-DR/CD117/CD45、CD15/CD16/CD13/CD45、CD64/CD14/CD11b/CD45、CD7/CD56/CD20/CD45、CD58/CD33/CD123/CD45、CD4/CD8/CD3/CD45、CD2/CD1a/CD45、cMPO/cCD79a/cCD3/CD45。应用CXP软件对流式细胞免疫分型图进行分析,筛选出异常细胞群,并对幼稚细胞的荧光表达进行计算。抗原表达占幼稚细胞群20%以上定义为阳性。患者免疫分型图及计算结果见图2、表1。
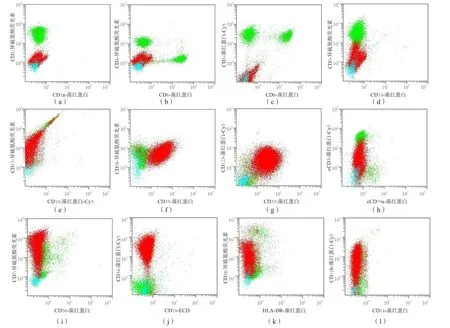
图2 患者流式细胞免疫分型

表1 患者免疫分型CD表达计算结果
患者骨髓样本CD表达: CD1a-、CD8-、CD5-、CD4-、CD15+、CD58+、CD123+、CD7+、CD11b+、CD33+、CD34+、CD38+、cCD3弱表达。依据白血病细胞缺乏CD1a和CD8表达,CD5弱表达或者不表达,至少1个髓系或干细胞相关的抗原表达(CD13、CD33、CD34、CD117、HLA-DR等)[5]或除了CD7+外,CD34+和/或CD13/CD33+、CD1a-、CD4-、CD8-[6]的ETP-ALL的诊断标准,本例患者西医临床诊断为ETP-ALL,中医诊断为髓毒,邪毒内蕴,气阴两虚。进行对症治疗并给予急性淋巴细胞白血病化疗方案诱导化疗3周未达完全缓解,于第4周加用培门冬,组合用药4 d后,患者放弃治疗出院。
2 讨论
起源于早期前体T细胞的ETP-ALL,其生物学的高度异质性尚未被完全认识,没有一种基因异常超过1/3的病例,ETP-ALL致白血病的转录因子与典型T-ALL病例表达无明显差异,不能以此来区分这2种白血病亚型。有研究结果显示,ETP-ALL突变主要出现在调控细胞因子受体和Ras信号通路的基因中,这些基因突变很多是因为染色体重排造成的,重排会产生新的嵌合式融合基因,且会被高频率激活,其突变模式与恶性骨髓瘤突变模式相似[3]。与ETP-ALL相关的基因突变包括IL 7R基因突变、NOTCH1基因突变、BCL11B基因突变、TCRγ链双等位基因缺失、RUNX1基因突变等。与其他急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)相比,ETP-ALL调节细胞因子受体和Ras信号、造血发育、组胺修饰等基因改变明显升高。NEUMANN等[7]的研究结果显示,在成人ETP-ALL中,FLT3突变率高达35.0%,这类有FLT3突变的ETP-ALL患者有特异的免疫表型、独特的基因表达模式和突变状态,提示白血病转化发生在多能前体胸腺细胞阶段。COUSTAN-SMITH等[2]在17例ETP-ALL患者中发现有高度变异的染色体核型,其中4例伴有13q-异常,而116例T-ALL患者中仅有4例发生相似的染色体改变。常见的RUNX1相关染色体重排和染色体数量改变有t(8,21)、inv(16)、t(12;21)、+21等,然而既往研究结果显示,RUNX1点突变仅见于髓系肿瘤[5]。由于1/3的ETP-ALL患者无单一基因突变或拷贝数变化,故基因及染色体检测敏感性较高,但其特异性较差。
早期T前体细胞(early T-cell precursor,ETP)直接起源于造血干细胞,往往高表达CD34、CD117、BAALC基因和MNl等造血干细胞标志分子以及CD13、CD33等髓系标志分子,具有髓系分化潜能[8]。全基因测序提示ETP-ALL代表了一种有干细胞和髓系细胞特点的不成熟白血病。ETP-ALL的典型免疫表型是表达T细胞的标志,异常表达干细胞和髓系标志,不表达或者弱表达CD5(表达强度不足正常外周血T细胞的1/10),不表达CD1a和 CD8,同时表达干细胞或髓系相关标志 CD117、CD34、HLADR、CD13、CD33、CD11b和CD65中的至少1个[9-10]。CHOPRA等[6]改良了以上标准:除CD7+外,CD34+和/或CD13/CD33+,CD1a-,CD4-,CD8-,可能更接近于人类ETP-ALL免疫表型,敏感性为77.0%,特异性为94.0%。本研究病例的免疫分型完全满足以上诊断标准:不表达CD1a、CD8、CD4、CD5,表达CD7、CD11b、CD33、CD34。除此之外,此患者还异常表达CD15、CD58、CD123相关标志,这一现象目前尚未见文献报道,提示患者体内存在这些CD分子的相关转录物,保留着多能分化潜能。虽然本研究的病例诊断符合相应指南以及免疫分型的标准[5-6,11],但患者由于经济方面的原因未进行基因及染色体的检测,使本研究存在一定的局限性。
ETP-ALL相关文献比较少,一方面是因为疾病的病例数较少,而且检验标志物有限 ,容易被误诊,一部分被错误划分为T-ALL,一部分因为强表达髓系标志被划分为急性髓细胞白血病或混合白血病;另一方面,因ETP-ALL没有特殊的临床表现,免疫表型是最强的预后危险因素,意义比微小残留病变重大,但此类检测未普遍开展。ETP-ALL患者比典型T-ALL患者临床转归更差,缓解失败或血液学复发的累积发生率比典型T-ALL患者高得多。ETP-ALL患者与典型T-ALL患者10年总生存率分别为19.0%和84.0%[2]。因ETP-ALL停滞在T细胞分化早期且具有髓系分化潜能,髓系白血病化疗方案或许对治疗ETP-ALL有一定的作用[12],使用髓系或者干细胞白血病治疗药物,如大剂量阿糖胞苷治疗可能会有效,但还有待临床证实。异基因干细胞移植可作为ETP-ALL患者第1次缓解后的一线治疗方法。使用转染FLT3的T-ALL细胞系的研究结果显示,肿瘤细胞对酪氨酸激酶抑制剂特别敏感,提示使用FLT3抑制剂联合异基因造血干细胞移植,可能会成为有效的临床治疗ETP-ALL的方法。

