重型急性胰腺炎患者血清α-MSH、TNF-α、内毒素水平变化及其与病情的关系
杨艳英,张建民
(1河南护理职业学院,河南安阳455000;2 河南省人民医院)
重型急性胰腺炎(SAP)病情进展迅速,临床预后较差[1]。炎症因子能够通过多种途径促进胰腺组织的自身性消化作用,参与SAP的病情进展。α黑色素细胞刺激素(α-MSH)是重要的炎症抑制因子,能够抑制IL-6、IL-10等炎症因子激活,降低单核细胞等炎症细胞的浸润程度,改善病情[2];肿瘤坏死因子α(TNF-α)、内毒素能够通过诱导胰腺导管上皮的损伤,增加导管内消化酶的压力,促进导管破裂导致的蛋白酶对自身组织的分解[3, 4]。2014年1月~2017年8月,我们观察了SAP患者血清α-MSH、TNF-α、内毒素水平变化,并分析其与患者病情严重程度的相关性,从而为临床上SAP患者的病情评估提供参考。
1 资料与方法
1.1 临床资料 收集同期河南省人民医院收治的急性胰腺炎(AP)患者。纳入标准:①符合中华医学会消化内科分会制定的AP、轻型急性胰腺炎(MAP)、SAP诊断及分型标准;②年龄18~69岁;③起病后24 h内入院,无院外治疗史。排除标准:①伴有高血压、糖尿病、心脏病;②合并恶性肿瘤疾病;③有药物滥用史;④妊娠、哺乳期妇女。共收集AP患者114例(AP组),男66例、女48例,年龄(43.5±12.2)岁,基础病因为胆源性48例、高脂血症15例、酒精性38例、特发性13例,MAP 72例、SAP 42例。选取同期40例体检健康者作为对照组,男28例、女12例,年龄(42.1±14.6)岁。两组性别、年龄具有可比性。本研究获医院医学伦理委员会批准,受试者均签署知情同意书。
1.2 血清α-MSH、TNF-α、内毒素检测方法 采集空腹静脉血约5 mL并分为2份。1份自然抗凝后以3 000 r/min离心10 min,取上清液以ELISA法检测血清α-MSH,试剂盒购自北京中杉金桥生物有限公司;1份置于枸橼酸钠抗凝管内,用胶体金法检测TNF-α、内毒素水平,试剂盒购自上海奥普生物医药有限公司。
1.3 病情评价方法 AP组均行CT检查,由同一医生行Balthazar CT评分[4]。①AP分级标准:A级(0分)为胰腺正常;B级(1分)为胰腺局限性或弥漫肿大;C级(2分)为除B级改变外,还有胰周改变;D级(3分)为除B级改变外,胰腺具有单发性积液区;E级(4分)为胰腺有2个或多个积液区。②胰腺坏死程度积分:未发生坏死为0分,坏死程度≤30%、﹥30%~50%、﹥50%分别为2分、4分、6分。Balthazar CT评分=急性胰腺炎分级评分+胰腺坏死程度积分。APACHE Ⅱ评分:主要依据患者的体温、平均动脉压、心率、呼吸频率、电解质、血气指标等进行评分,总分0~71分,评分越高患者的病情越重。
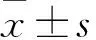
2 结果
2.1 两组血清α-MSH、TNF-α、内毒素水平比较 与对照组比较,AP组血清TNF-α、内毒素水平升高而α-MSH水平降低(P均<0.01)。见表1。
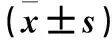
表1 两组血清α-MSH、TNF-α、内毒素比较
2.2 不同病情AP患者血清α-MSH、TNF-α、内毒素水平比较 与MAP患者比较,SAP患者血清TNF-α、内毒素水平升高而α-MSH水平降低(P均<0.01)。见表2。
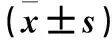
表2 不同病情AP患者血清α-MSH、TNF-α、内毒素水平比较
2.3 不同病情AP患者Balthazar CT评分、APACHE Ⅱ评分比较 与MAP患者比较,SAP患者Balthazar CT评分、APACHE Ⅱ评分增加(P均<0.01)。见表3。
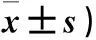
表3 不同病情AP患者Balthazar CT评分、APACHE Ⅱ评分比较(分,
2.4 SAP患者血清α-MSH、TNF-α、内毒素水平与病情的关系 SAP患者血清TNF-α、内毒素水平与Balthazar CT评分、APACHE Ⅱ评分均呈正相关(r分别为0.594、0.618和0.633、0.648,P均<0.01),血清α-MSH与Balthazar CT评分、APACHE Ⅱ评分均呈负相关(r分别为-0.628、-0.584,P均<0.01)。
3 讨论
过度饮酒、胆管系统疾病及遗传易感因素[5]等,均可以促进AP的发生发展。AP特别是SAP的远期生存指标较差,5年生存率不足10%,病死率可达5%以上[6]。早期诊断和评估病情,可提高病情缓解率,降低病死率,改善远期临床预后指标。
α-MSH由间脑中叶分泌,并通过神经递质或者激素效应作用于靶器官组织,发挥抗炎、改善免疫功能、提高局部体液免疫屏障等作用。TNF-α以通过诱导下游细胞炎症因子如IL-6、IL-10等的表达,进而促进巨噬细胞、单核细胞等对于胰腺细胞膜的浸润或损伤。TNF-α在促进氧化应激损伤,或加剧细胞膜的不稳定性等方面同样发挥了重要作用;研究也显示,TNF-α可以通过影响细胞膜上钙离子通道的开放,进一步加剧胰腺组织的缺血再灌注损伤[7, 8]。内毒素是重要的致病因子,其血清水平升高主要与细菌或者病毒颗粒扩增过程中的膜完整性的破坏有关;过度升高的内毒素能够诱导自身免疫性因子CD4+T淋巴细胞等免疫缺陷,导致胰腺组织局部免疫功能的下降,炎症反应更显著[9, 10]。研究已表明,SAP患者血清TNF-α、内毒素水平升高,是促进SAP患者病死率增加、多器官功能障碍的重要因素[11],但缺乏对于α-MSH的分析探讨。
本研究发现,与健康对照比较,AP患者血清α-MSH水平下降而TNF-α、内毒素水平上升。这提示α-MSH、TNF-α、内毒素等均参与了AP发生、发展,能够通过影响到炎症反应、免疫损伤及消化酶的自身性组织损伤促进病情进展[12, 13]。α-MSH通过抑制体内炎症NOTCH信号通路,能够降低下游中性粒细胞对于胰腺导管上皮的损伤,降低消化酶溢出的风险。TNF-α、内毒素主要通过促进氧化应激损伤、线粒体功能障碍等,进而加速胰腺导管上皮完整性的破坏,增加胰腺消化酶的压力,促进消化酶在胰腺自身组织及腹腔内扩散的风险。徐贵川等[14]研究发现,AP患者多器官功能损伤的发生率越高、心肺功能衰竭的程度越高,血清TNF-α、内毒素等指标的上升越为明显。本研究发现,在病情严重的SAP患者血清α-MSH、TNF-α、内毒素水平异常程度高于病情较轻的MAP患者,提示临床可以通过监测上述变化早期判断SAP。这主要因为α-MSH、TNF-α、内毒素等与胰酶消化酶分解自身组织器官的过程中伴发的瀑布式炎症反应有关,相关指标越高,瀑布式炎症反应越严重[15,16]。Balthazar CT评分、APACHE Ⅱ评是评估SAP患者病情的重要生理病理评分系统,其对于患者的胰腺损伤、全身多器官损害及临床预后转归的评估等均具有一定的参考价值。本研究显示,SAP患者血清TNF-α、内毒素水平与Balthazar CT评分、APACHE Ⅱ评分均呈正相关,血清α-MSH与Balthazar CT评分、APACHE Ⅱ评分均呈负相关,进一步提示了α-MSH、TNF-α等指标与SAP的关系。但部分学者未发现α-MSH、TNF-α等与患者的生理病理相关评分有关,可能与SAP合并脏器损伤程度、基础性合并症或α-MSH、TNF-α等指标检测时机的差异有关。总之,本研究发现,SAP患者血清α-MSH水平低于MAP患者和健康人群,而TNF-α、内毒素高于MAP患者及健康人群,并且与患者的病情严重程度关系密切。

