非小细胞肺癌组织中P27Kip1蛋白的表达
张锦丰,李 亮,杨权烈,吴静娜
(梅州市人民医院化疗科,广东 梅州 514031)
非小细胞肺癌(non-small cell lung cancer, NSCLC)是临床常见的恶性肿瘤之一,预后较差[1]。P27Kip1是细胞周期依赖性蛋白激酶抑制因子(cyclin-dependent kinase inhibitor, CKI)之一,研究[2]表明P27Kip1蛋白的表达异常与多种恶性肿瘤的发生、发展相关。然而在NSCLC的研究中,尚不能确定P27Kip1是一种有价值的肿瘤标志物。本研究应用免疫组织化学SABC法检测43例NSCLC组织和27例肺良性病变组织中P27Kip1蛋白的表达情况,结合临床、病理、随访资料,了解P27Kip1蛋白的表达与非小细胞肺癌的关系。
1 资料与方法
1.1一般资料选取2004年3月至2008年12月在我院经手术切除并病理确诊的43例NSCLC石蜡标本,所有患者术前未行放、化疗,随访资料完整。其中男30例,女13例;年龄23~80岁,中位年龄59岁;腺癌23例,鳞癌20例;有吸烟史者20例,无吸烟史者23例;根据2002年美国癌症联合会制订的分期标准:T14例、T230例、T38例、T41例;N030例,N1~213例;M043例,M10例;Ⅰ期24例,Ⅱ期10例,Ⅲ期9例,Ⅳ期0例。另选取同期收治的27例肺良性病变作为对照组,其中肺结核6例,肺大疱8例,肺囊肿5例,真菌性肺炎2例,炎性假瘤2例,肺纤维化、支气管扩张、黏液腺瘤、肺脓肿各1例。
1.2主要试剂P27Kip1兔抗人单克隆抗体购自美国Cell Signaling公司,SABC免疫组化染色试剂盒及DAB显色试剂盒均购自武汉博士德生物工程有限公司。
1.3检测方法[3]采用链酶亲和素-生物素-过氧化物酶复合物技术(streptavidin biotin-peroxidase complex method,SABC)进行免疫组化染色,主要步骤如下:常规脱蜡,水化;柠檬酸热抗原修复;体积分数3% H2O2室温孵育;滴加正常山羊血清封闭液即用液;滴加临时配制稀释好的一抗;滴加二抗即用液;滴加SABC即用液;滴加DAB显色液,自来水及时终止染色;苏木素复染,中性树胶封固。用已知阳性(宫颈癌)切片作阳性对照,用PBS代替一抗作阴性对照。
1.4结果判定[4]P27Kip1蛋白阳性着色为粗细不一的棕黄色颗粒,定位于细胞核和(或)细胞质。双盲法观察结果,根据显色程度和阳性细胞百分率,分别进行评分;将2种评分相加,再除以2,即为最终评分。根据最终评分结果,将0、0.5~1.0、1.5~2.0、2.5~3.0分别定为(-)、(+)、(++)和(+++)。其中(+)、(++)和(+++)为阳性,(-)为阴性。
1.5统计学处理采用SPSS 13.0分析处理数据,P27Kip1蛋白在NSCLC和肺良性病变组织中表达情况的比较采用Fisher确切概率法;P27Kip1蛋白与NSCLC各项临床病理指标之间的关系分析应用2组间比较的秩和检验;细胞核和细胞质中P27Kip1蛋白表达的相关性分析用Spearman等级相关分析法;根据寿命表计算3 a生存率,用Kaplan-Meier法进行单因素生存分析,检验水准α=0.05。
2 结果
2.1P27Kip1蛋白在NSCLC和肺良性病变组织中表达的比较P27Kip1蛋白表达可见于NSCLC的细胞核或细胞质。细胞核表达阳性率为9.3%(4/43),显著低于肺良性病变组织的44.4%(12/27),差异有统计学意义(P=0.013);细胞质表达阳性率为48.8%(21/43),显著高于肺良性病变的7.4%(2/27),差异有统计学意义(P<0.001)。P27Kip1蛋白在NSCLC组织中表达分布结果分析显示,仅在细胞核表达9.3%(4/43),仅在细胞质表达48.8%(21/43),两者均表达0.0%(0/43),两者均不表达41.9%(18/43)。见图1。
2.2P27Kip1蛋白表达与NSCLC患者各临床病理特征的关系P27Kip1蛋白细胞核和细胞质表达与患者的性别、年龄、病理类型、肿瘤部位、肿瘤大小、淋巴结转移、TNM分期、吸烟状态等临床病理特征均未见明显关系(P>0.05)。见表1。
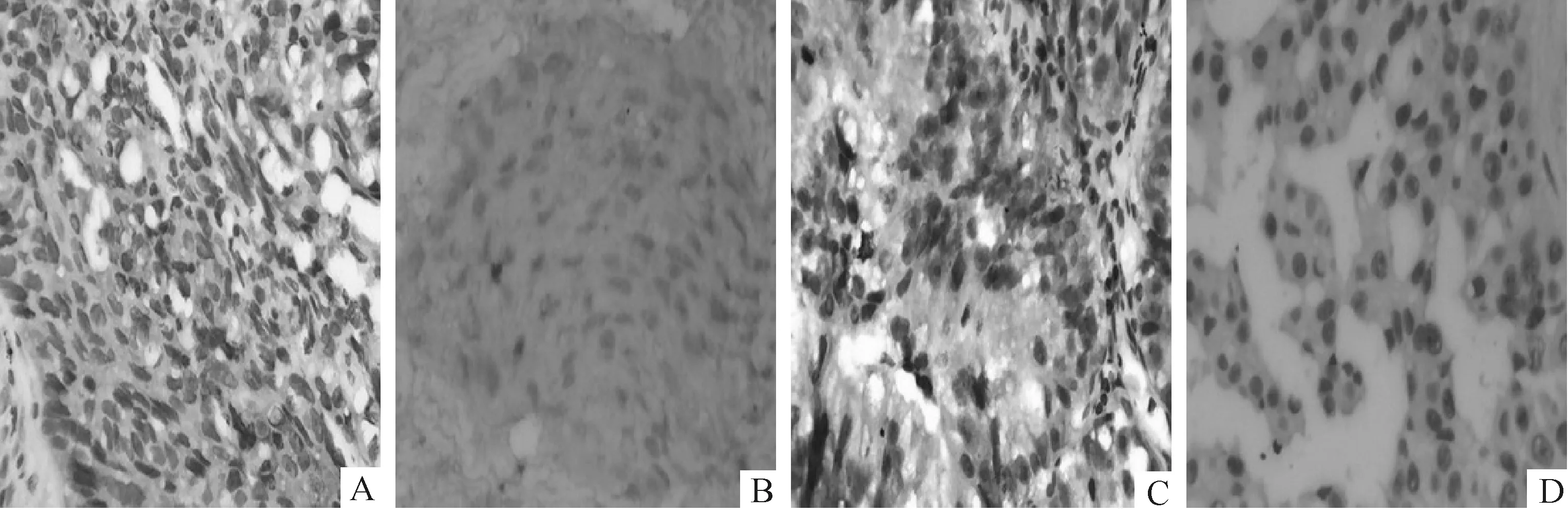
图1 P27Kip1蛋白在NSCLC组织中的表达(SABC, ×400)
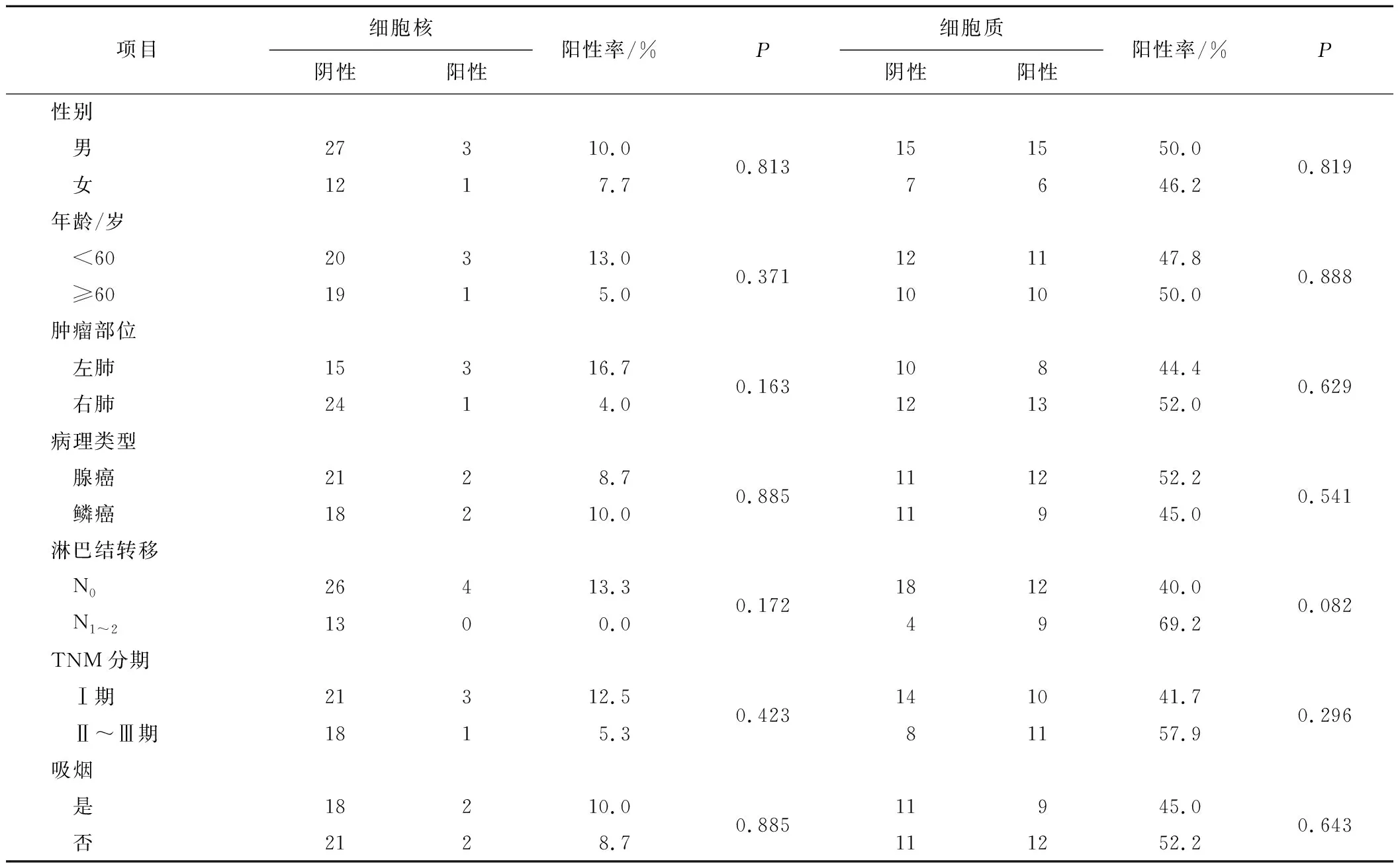
项目细胞核阴性阳性阳性率/%P细胞质阴性阳性阳性率/%P性别 男27310.00.813151550.00.819 女1217.77646.2年龄/岁 <6020313.00.371121147.80.888 ≥601915.0101050.0肿瘤部位 左肺15316.70.16310844.40.629 右肺2414.0121352.0病理类型 腺癌2128.70.885111252.20.541 鳞癌18210.011945.0淋巴结转移 N026413.30.172181240.00.082 N1~21300.04969.2TNM分期 Ⅰ期21312.50.423141041.70.296 Ⅱ~Ⅲ期1815.381157.9吸烟 是18210.00.88511945.00.643 否2128.7111252.2
2.3P27Kip1蛋白表达与NSCLC患者生存率的关系P27Kip1蛋白细胞核表达阳性和阴性NSCLC患者术后3 a生存率分别为45.0%和25.0%,差异无统计学意义(P=0.512);P27Kip1蛋白细胞质表达阳性和阴性NSCLC患者术后3 a生存率分别为33.7%和50.3%,差异无统计意义(P=0.105)。见图2、3。
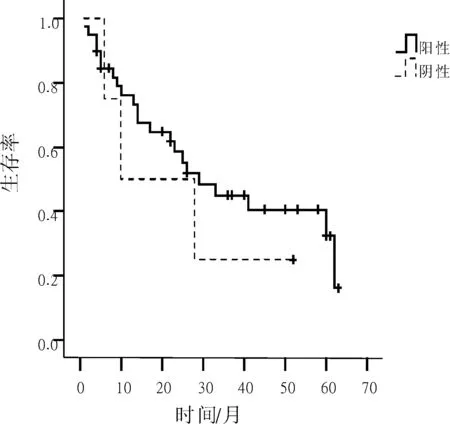
图2 不同P27Kip1蛋白细胞核表达NSCLC患者生存生存曲线
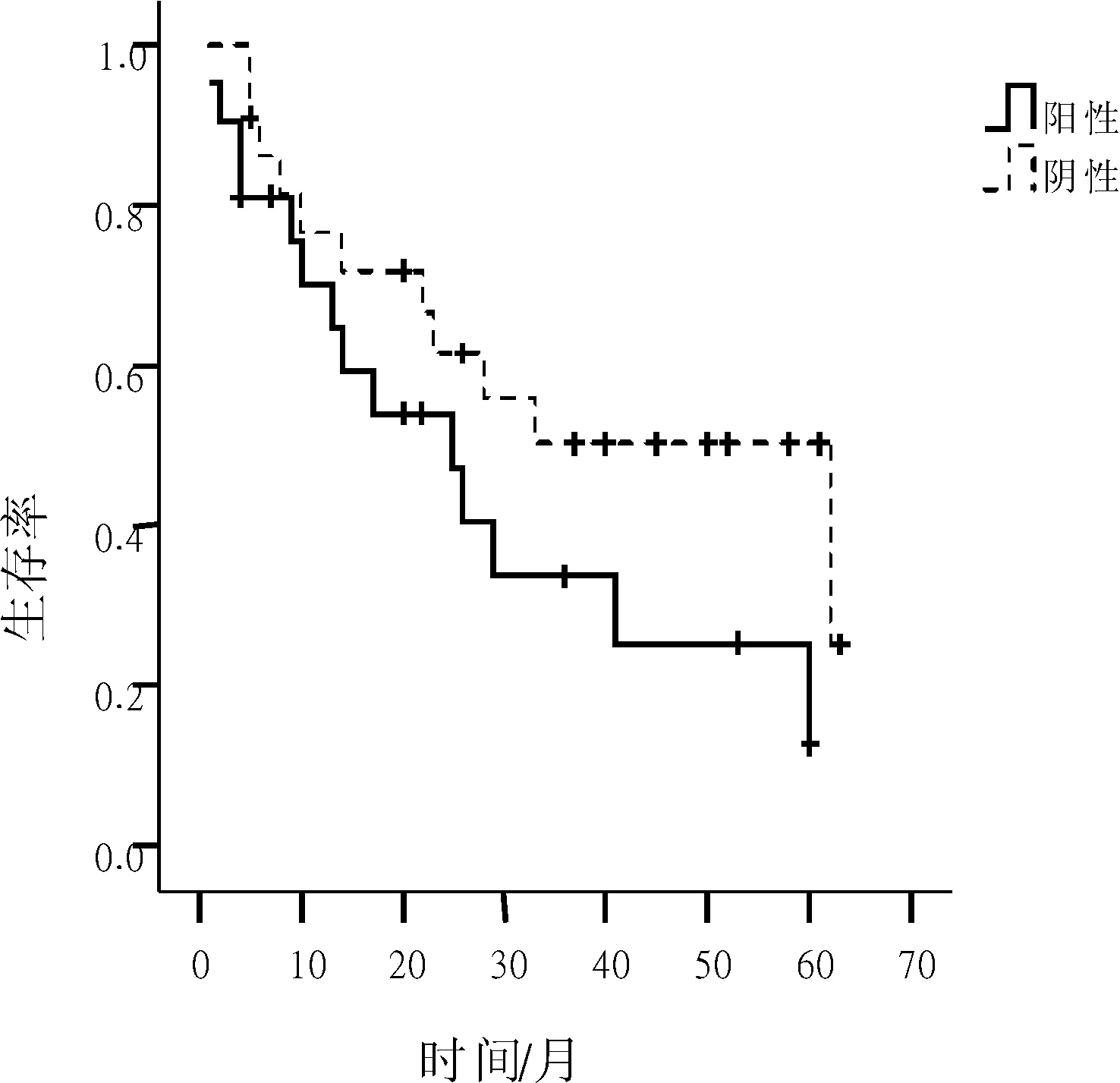
图3 不同P27Kip1蛋白细胞质表达NSCLC患者生存曲线
2.4P27Kip1蛋白细胞核和细胞质表达的相关性P27Kip1蛋白在NSCLC细胞核表达与细胞质表达呈负相关关系(r=-0.313,P=0.041)。
3 讨论
恶性肿瘤是一类细胞周期性疾病。细胞周期的正常运转取决于正负调控因子和各检查点的功能。负调控因子CKI可分为2大家族[5-6],一类是Cip/Kip家族包括P21Waf1/Cip1、P27Kip1和P57Kip2;另一类是INK4家族包括P15INK4a、P16INK4b、P18INK4c和P19INK4d。肿瘤的发生、发展与细胞周期正负调控因子失衡和各检查点失灵所致的细胞周期运转加速和凋亡减少密切相关。在多数肿瘤中可见负调控因子的表达或功能异常。其中P27Kip1在细胞周期调控中的作用及其与肿瘤的关系倍受关注。
P27Kip1是1994年Polyak等[7]在研究细胞抑制机制新发现的一种相对分子质量为27 000的细胞周期抑制蛋白。其cDNA长594 bp,含198个氨基酸编码[8]。其氨基端有2个丝氨酸磷酸化位点,介导正调控因子细胞周期依赖性激酶(cyclin-dependent kinase, CDK)活性的抑制[2]。P27Kip1蛋白是一种存在于细胞中的热稳定蛋白原,其对CDK具有广谱的负调控作用, 主要在细胞核内与Cyclin E/CDK2和Cyclin D1/CDK4复合物结合,抑制CDK2和CDK4的蛋白激酶活性,诱导细胞周期停滞在G1期,抑制进入S期,阻断细胞由静止期向增殖期过渡[2]。此外,P27Kip1还能促进细胞凋亡的发生[9]。
研究[10-16]发现,P27Kip1蛋白在多种恶性肿瘤组织中表达降低或缺失,包括食管癌、结肠癌、前列腺癌、膀胱癌、肝癌、乳腺癌以及非小细胞肺癌等。P27Kip1在肿瘤细胞中的错误定位被认为是细胞癌变的机制之一。当P27Kip1蛋白被磷酸化后,可以从细胞核转运至细胞质,细胞质中的P27Kip1蛋白通过泛素化-蛋白水解体途径水解失活[17]。此外,某些物质可与P27Kip1蛋白结合并影响其活性,如癌基因c-myc可以诱导Cyclin D表达,Cyclin D-CDK4/6数量增多,会扣留P27Kip1,使之不能与Cyclin E-CDK2结合,从而失去抑制CDK2蛋白激酶的活性[18]。
本研究中,用免疫组化方法检测了43例NSCLC组织和27例肺良性病变组织中P27Kip1蛋白的表达。发现P27Kip1蛋白在NSCLC细胞核表达阳性率为9.3%,显著低于肺良性病变的44.4%,这与文献[19]报道一致。此外,本研究还观察到P27Kip1蛋白在NSCLC细胞质表达丰富(阳性率为48.8%),明显高于肺良性病变的7.4%。本研究进一步进行P27Kip1蛋白细胞核表达与细胞质表达的相关性分析,发现两者呈负相关。这些结果表明,细胞核与细胞质中P27Kip1蛋白表达是一个动态的过程,NSCLC细胞质中增多的P27Kip1可能是从细胞核中泄漏所致;P27Kip1蛋白作为一个抑癌因子,在NSCLC中表达下降或失活。
研究[16,20]表明,P27Kip1蛋白的表达与NSCLC患者肿瘤细胞分化程度有密切关系,与性别、年龄、肿瘤大小、淋巴结转移、TNM 分期均无明显关系。本研究发现P27Kip1蛋白细胞核和细胞质表达与患者的临床病理特征未见明显关系。因本研究低分化患者病例较少,无法统计其与P27Kip1蛋白表达的关系。
P27Kip1蛋白表达与预后的关系在乳腺癌、淋巴瘤、前列腺癌以及消化道肿瘤已有报道,在NSCLC的研究中,多数学者认为,P27Kip1蛋白细胞核的低表达与复发及不良预后有关[20]。我们的研究发现P27Kip1细胞质表达阴性的患者生存率有升高的趋势,但差异无统计学意义,P27Kip1蛋白表达与NSCLC生存预后的关系还有待进一步研究。
总之,NSCLC组织中P27Kip1蛋白在细胞核中表达减少,细胞质中表达增多,其异常定位是NSCLC患者预后不良的潜在因素之一,两者的确切关系仍有待进一步研究和探索。

