慢病毒介导E型钙黏附蛋白表达抑制对胃癌SGC-7901细胞5-氟尿嘧啶作用的影响
张自森,王梦丹,刘世佳,马子涵,陈发帅,巴 楠,夏兴洲
(1.郑州大学第五附属医院肿瘤内科,河南 郑州 450052;2.郑州大学第五附属医院普通外科,河南 郑州 450052;3.郑州大学第五附属医院消化内科,河南 郑州 450052)
胃癌是我国最常见的恶性肿瘤之一,其发病率居于第2位[1]。E-钙黏附蛋白(E-cadherin)与胃癌发生发展关系密切,可通过调节多个信号传导通路影响胃癌细胞增殖[2]。本实验采用慢病毒介导方法抑制胃癌SGC-7901细胞中E-cadherin表达,观察了基因抑制效果和对5-Fu作用的影响,为进一步探讨E-cadherin为靶点的胃癌个体化精准治疗的可行性提供参考。
1 材料与方法
1.1材料与试剂人胃癌细胞株SGC-7901购自上海中国科学院典型培养物保藏委员会细胞库。Annexin V-FICT/PI双染细胞凋亡试剂盒购自上海美季生物技术公司;人E-cadherin单克隆抗体(sc-8008)、人β-actin单克隆抗体(sc-1610R)购自美国Santa Cruz公司;RNA提取试剂盒和cDNA第1链合成试剂盒购自美国Invitrogen公司;CDH1-siRNA设计合成和GV248慢病毒载体(元件顺序:hU6-MCS-Ubiquitin-EGFP-IRES-puromycin)构建由上海吉凯基因化学技术有限公司完成。
1.2实验方法
1.2.1 细胞培养 用含体积分数10%小牛血清、100 u·mL-1青霉素以及100 μg·mL-1链霉素的RPMI-1640培养基常规培养胃癌SGC-7901细胞,置于37 ℃、体积分数5% CO2、饱和湿度环境中培养。
1.2.2 CDH1-siRNA感染细胞和有效siRNA筛选 取对数期生长的待感染的胃癌SGC-7901细胞,消化细胞计数,制成细胞悬液。感染前1 d将细胞接种到6孔细胞培养板中,每孔接种5×105个细胞,放于37 ℃、体积分数5% CO2培养箱培养24 h后,细胞密度为80%~90%时,进行感染。加入培养基1 mL/孔,再分别加入稀释病毒液各100 μL(感染复数值相当于50),培养24 h后换液,继续培养72~96 h后进行后续实验。分别用RT-PCR和Western blot法检测E-cadherin mRNA和蛋白的表达,用最有效的CDH1-siRNA片段用于后续实验。
1.2.3 MTT法检测细胞抑制率 将生长状态良好的人胃癌SGC-7901细胞和CDH1-siRNA稳定感染的胃癌SGC-7901细胞以每孔5×104个细胞加入96孔板,每孔200 μL。设实验组5-Fu的浓度分别为0.25 mg·L-1、0.5 mg·L-1、1 mg·L-1、2 mg·L-1、4 mg·L-1,同时设空白对照组,每个浓度随机设置3个孔。将培养板放入培养箱中分别培养48 h,每孔再加入10 μL的5 g·L-1的噻唑兰(methylthiazolyldiphenyl-tetrazolium bromide, MTT),继续培养4 h,弃掉培养孔中的上清液,向每孔中加入100 μL二甲基亚砜,低速振荡10 min,使结晶物充分溶解,于490 nm处,在酶联免疫检测仪上测定各孔的吸光度(A)值,记录数值,计算半抑制浓度(50% inhibitory concentration ,IC50)。实验重复3次,操作过程中注意避光。抑制率(%)=(对照组A490 nm-实验组A490 nm)/对照组A490 nm×100%。
1.2.4 流式细胞术检测细胞凋亡 2组细胞药物处理完毕后,常规消化,制成细胞悬液。将约1×106个细胞移入离心管中,1 000 r·min-1,离心5 min,弃去上清后,用磷酸盐缓冲液(phosphate buffered saline,PBS)洗1次,在离心管中留约0.5 mL PBS,将细胞混匀。加入体积分数70%冰乙醇固定,4 ℃放置8 h以上。检测时,离心弃去乙醇,PBS洗1次,在离心管中留0.5 mL PBS,打散细胞团,然后加入5 μL AnnexinV-FITC,4 ℃避光孵育15 min。上机检测前5 min再加入碘化丙锭(PI)5 μL,避光孵育。流式细胞仪检测细胞凋亡。
1.2.5 RT-PCR检测目的基因mRNA的表达 Trizol法提取细胞总RNA,反转录合成cDNA。引物序列如下:E-cadherin(CDH1):上游:5’-TGGGCTGGACCGAGAGAGTT-3’,下游:5’-ATCTCCAGCCAGTTGGCAGT-3’; B细胞淋巴瘤/白血病-2(B-cell lymphoma/ leukemia-2, Bcl-2):上游:5’-GTGGAGGAGCTCTTCAGGGA-3’,下游:5’-AGGCACCCAGGGTGATGCAA-3’;Bcl-2相关X蛋白(Bcl-2 related X protein, Bax):上游:5’-GGCCCACCAGCTCTGAGCAGA-3’,下游:5’-GCCACGTGGGCGTCCCAAAGT-3’;磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase, GAPDH):上游:5’-ATCCCATCACCATCTTCCAG-3’,下游:5’-CCATCACGCCACAGTTTCC-3’。PCR反应条件:反应体系为25 μL,反应条件:94 ℃ 3 min,94 ℃ 30 s,59 ℃ 30 s,72 ℃ 20 s,循环35次,72 ℃延伸5 min,4 ℃终止反应。PCR产物用质量分数2%琼脂糖凝胶电泳。
1.2.6 Western-blot法检测E-cadherin蛋白的表达 取感染组及空白对照组的细胞裂解后提取总蛋白。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,半干转膜法将蛋白转移到聚偏氟乙烯膜,放入脱脂牛奶中封闭1 h,加入一抗,4 ℃过夜,取膜放入Tris-HCl缓冲盐溶液中洗3次,每次5 min,加入酶标的二抗,室温孵育2 h,洗膜,加ECL底物显影。

2 结果
2.1CDH1-siRNA转染胃癌SGC-7901细胞的效率观察绿色萤光蛋白(green fluorescent protein,GFP)标记的病毒对照感染胃癌SGC-7901细胞后,48 h即可见荧光表达,96 h可见强烈荧光表达,感染复数50时对胃癌SGC-7901细胞的感染效率较高,表达效率为81.99%。
2.2CDH1-siRNA对E-cadherin的抑制作用及最有效靶点的筛选RT-PCR分析的结果显示,稳定感染不同目的片段慢病毒CDH1-siRNA后,E-cadherin mRNA相对表达量均显著低于对照组(P<0.05)。4条CDH1-siRNA中,以CDH1-siRNA3对E-cadherin mRNA相对表达量的抑制最为明显。Western blot法半定量分析结果显示,各组E-cadherin蛋白相对表达量均显著低于对照组(P<0.05)。4条CDH1-siRNA中,也以CDH1-siRNA3对E-cadherin蛋白表达量的抑制最为明显。RT-PCR和Western blot结果均显示CDH1-siRNA3对胃癌SGC-7901细胞中E-cadherin的抑制效果最强,选择其进行后续研究。见表1、图1~4。
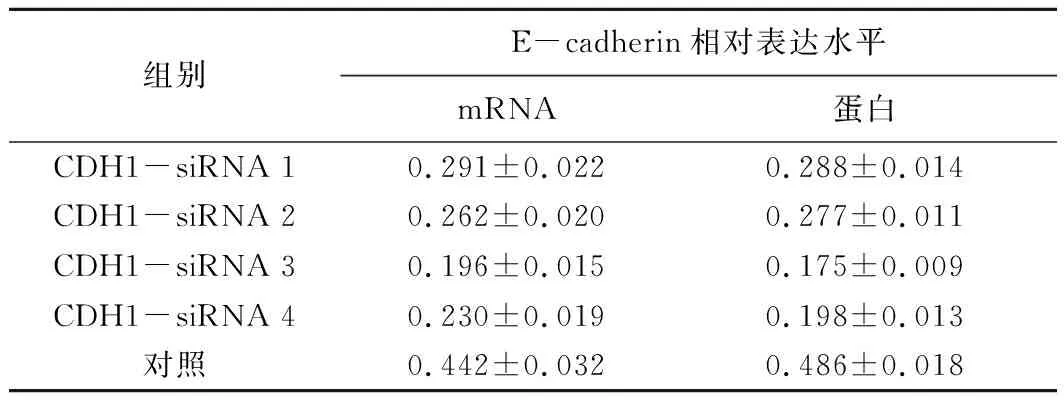
表1 CDH1-siRNA感染后胃癌SGC-7901细胞E-cadherin mRNA和蛋白的表达情况
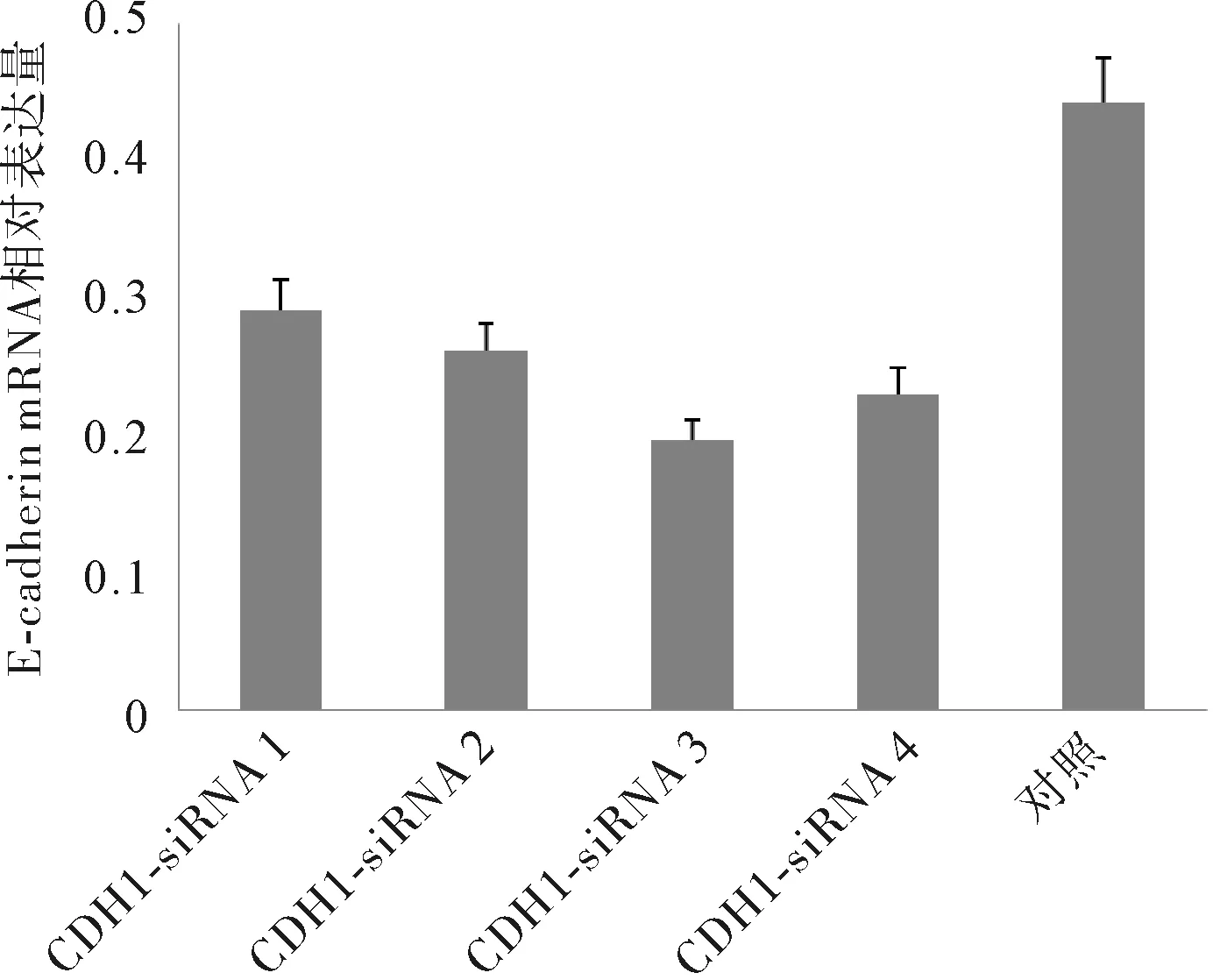
图1 CDH1-siRNA感染后胃癌SGC-7901细胞E-cadherin mRNA表达情况

图2 CDH1-siRNA感染后胃癌SGC-7901细胞E-cadherin mRNA表达电泳图
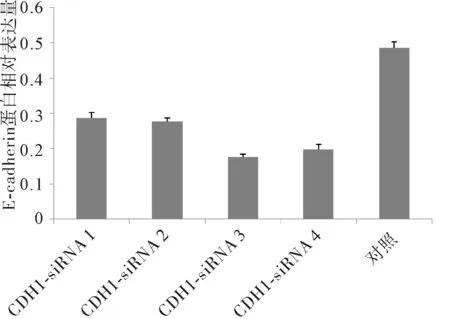
图3 CDH1-siRNA感染后胃癌SGC-7901细胞E-cadherin蛋白表达情况
图4 CDH1-siRNA感染后胃癌SGC-7901细胞E-cadherin蛋白表达情况
2.3CDH1-siRNA对胃癌SGC-7901细胞5-Fu生长抑制的影响MTT法检测5-Fu不同药物浓度0.25 mg·L-1、0.5 mg·L-1、1 mg·L-1、2 mg·L-1、4 mg·L-1对胃癌SGC-7901细胞的生长抑制率分别为(11.262±0.533)%、(26.244±0.714)%、(48.262±1.533)%、(63.631±1.108)%、(72.262±2.096)%。对CDH1-siRNA感染后胃癌SGC-7901细胞的生长抑制率分别为(8.113±0.296)%、(15.660±0.349)%、(28.262±0.872)%、(43.631±1.207)%、(64.622±1.906)%。CDH1-siRNA感染前后胃癌SGC-7901细胞对5-Fu的IC50分别为1.27 mg·L-1和2.35 mg·L-1。CDH1-siRNA感染后胃癌SGC-7901细胞对5-Fu的敏感性显著下降。见图5。
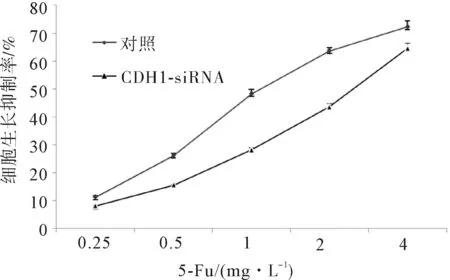
图5 MTT法检测5-Fu对CDH1-siRNA感染后胃癌SGC-7901细胞生长抑制情况
2.4CDH1-siRNA对胃癌SGC-7901细胞5-Fu诱导凋亡的影响5-Fu终浓度为2 mg·L-1作用48 h后,流式细胞术检测对照组胃癌SGC-7901细胞和CDH1-siRNA感染的胃癌SGC-7901细胞凋亡率分别为69.11%和47.11%。CDH1-siRNA显著增强了胃癌SGC-7901细胞抗5-Fu诱导凋亡的能力。见图6。
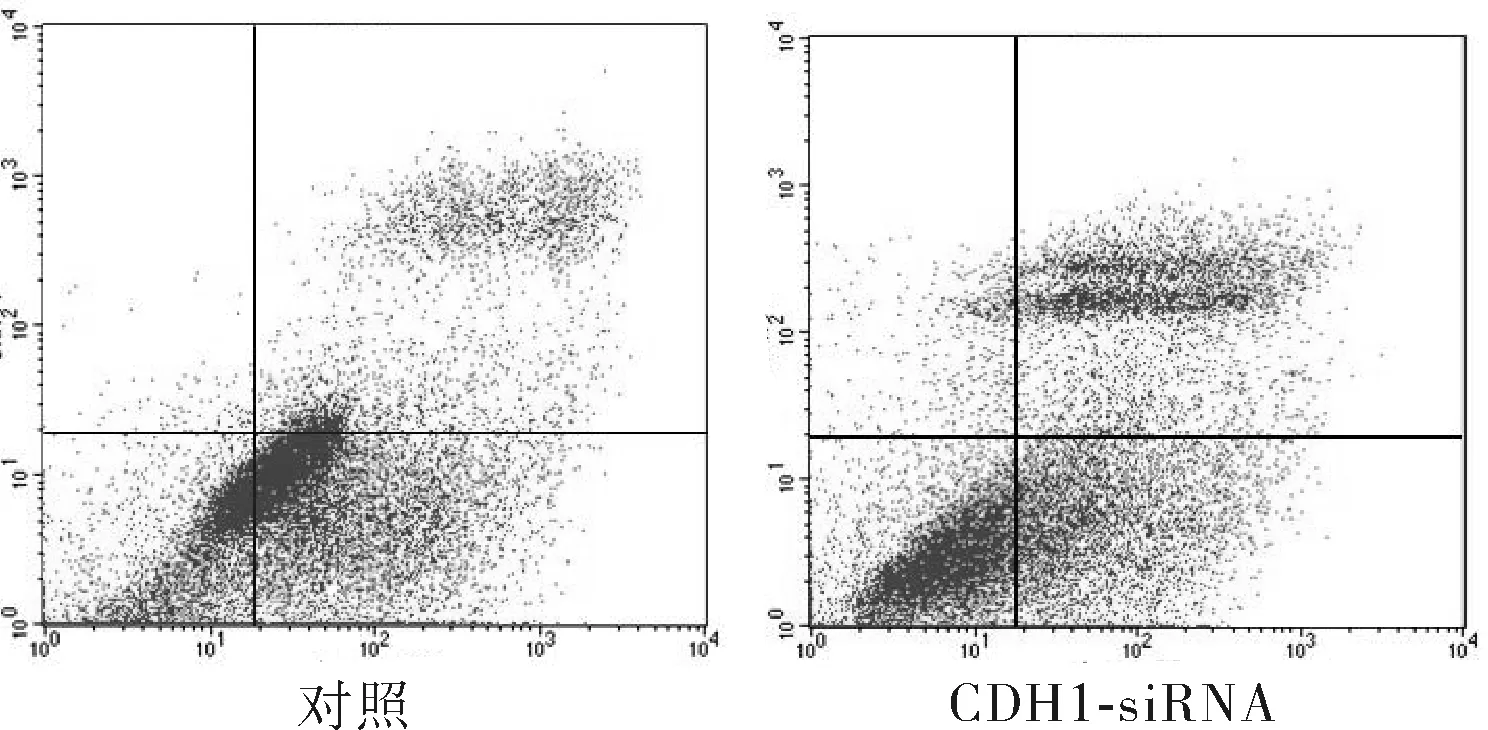
图6 流式细胞术检测CDH1-siRNA感染后胃癌SGC-7901细胞5-Fu诱导凋亡情况
2.5CDH1-siRNA对胃癌SGC-7901细胞中Bcl-2、Bax基因表达的影响RT-PCR检测凋亡相关基因Bcl-2、Bax mRNA的相对表达情况,结果显示,CDH1-siRNA对胃癌SGC-7901细胞的E-cadherin mRNA表达明显抑制时,Bcl-2 mRNA表达增高,Bax mRNA表达下降。当用5-Fu诱导细胞凋亡时,2组细胞中Bcl-2 mRNA表达增高,Bax mRNA表达下降。见表2、图7。
3 讨论
E-cadherin是细胞间的关键黏附分子之一,与肿瘤细胞的侵袭和转移密切相关。E-cadherin功能丧失在肿瘤发展过程中是一种常见现象,也是一个关键步骤,其表达缺失致细胞间接触抑制丧失,细胞侵袭能力增加,肿瘤进展[3-4]。E-cadherin也是胃癌发生、发展过程中的关键基因,能调节胃癌细胞增殖、侵袭、转移能力,是多种分子机制调节胃癌细胞增殖的共同效应靶点[5-6]。E-cadherin表达抑制可促进肿瘤细胞增殖、侵袭、凋亡和降低细胞化疗敏感性[7-8]。E-cadherin表达下调不仅影响顺铂敏感性,在多种肿瘤细胞中发现其表达抑制与细胞对5-Fu作用的敏感性下降有关[9-10]。
5-Fu是胃癌化疗方案中最基础也是最常用的药物,了解E-cadherin表达改变对胃癌细胞5-Fu作用敏感性的关系对晚期胃癌患者的个体化精准治疗方案选择具有重要意义。慢病毒介导的基因干扰可能成为临床基因治疗的新方法[11],本研究构建了4条针对E-cadherin基因的小分子RNA,通过慢病毒介导转染胃癌SGC-7901细胞,结果表明均能有效抑制E-cadherin基因和蛋白表达。进一步研究显示,E-cadherin表达下调降低了胃癌SGC-7901细胞的增殖能力,需增加5-Fu的药物浓度才能够达到对细胞的生长抑制。陈勇等[12]研究也发现,通过瞬时转染抑制胃癌SGC-7901细胞中E-cadherin的表达,可显著降低其对顺铂、5-Fu等化疗药物的敏感性。

表2 5-Fu作用前后胃癌SCG-7901细胞中Bcl-2、Bax mRNA表达情况

图7 5-Fu作用前后胃癌SCG-7901细胞中Bcl-2、Bax mRNA表达情况
凋亡是化疗药物诱导肿瘤细胞死亡的主要模式,许多凋亡相关基因和蛋白的表达变化影响了肿瘤细胞对化疗药物的敏感性。5-Fu有明显的诱导胃肿瘤细胞分化与凋亡作用[13]。本研究结果表明,E-cadherin表达抑制后降低了胃癌SGC-7901细胞对5-Fu诱导凋亡的作用,与文献报道一致。体外研究发现,Bax的表达激活与5-Fu作用敏感性关系密切,在多种类型肿瘤细胞中可增强5-Fu敏感性[14-16]。在临床研究中也发现,胃癌组织中Bax表达检测有助于化疗方案选择,其表达与FOLFOX方案化疗效果相关[17]。
本研究中发现5-Fu化疗诱导凋亡和E-cadherin表达抑制均可导致Bcl-2的表达上调,这种上调在2种因素同时作用时并未表现为叠加现象,可能与E-cadherin抑制后Bcl-2相对表达量处于低水平有关。5-Fu化疗诱导凋亡和E-cadherin表达抑制均可导致Bax的表达下调,这种下调在2种因素同时存在时缺表现为叠加。这些结果提示,E-cadherin表达抑制所导致的胃癌SGC-7901细胞凋亡机制甚为复杂,可能还存在着其他信号传导分子的共同参与。Bcl-2的表达能够使E-cadherin介导的细胞间的黏附性下降,促使细胞的恶性转化[18]。本研究中E-cadherin表达抑制时Bcl-2的表达上调,说明E-cadherin表达下调和BCL-2的表达上调共同参与了细胞表型恶性转化。
综上所述,慢病毒介导的E-cadherin基因干扰能有效抑制E-cadherin在胃癌SGC-7901细胞中的表达,并降低细胞对5-Fu作用的敏感性,为E-cadherin为靶标的临床转化研究提供了参考。

