阿维A治疗反应性穿通性胶原病二例并文献复习
雷 娜 于 腾 付洪军
1 临床资料
1.1 一般资料 病例1,男,47岁。因双下肢丘疹伴痒4个月就诊。患者4个月前无明显诱因双下肢出现数个针头大丘疹,瘙痒明显。外用红霉素软膏,并行抗过敏治疗,效果不佳。2个月前皮损累及躯干、上肢,部分丘疹出现脐凹,瘙痒剧烈,搔抓后出现破溃、结痂,少量渗出(图1a)。外院诊断为“过敏性皮炎”,给予泼尼松(40 mg/d)及抗过敏治疗,病情好转,遂泼尼松减量,减至10 mg/d时,皮损加重,泛发全身。既往史:乙肝携带30年,无其他系统疾病,家族中无类似疾病患者。体格检查:系统检查未见异常。皮肤科查体:躯干四肢密集分布米粒至黄豆大棕褐色丘疹、斑丘疹,中心有脐凹,内含角质栓,呈火山口状;左足背及右小腿内侧为重。实验室检查:血尿便常规、肝肾功能、凝血四项无异常。皮肤组织病理:局部皮肤杯状凹陷,内含角栓,真皮浅层及附属器周围大量淋巴细胞及少量嗜酸粒细胞浸润(图2a)。Masson染色:可见胶原纤维经表皮穿出(图2b)。诊断:获得性反应性穿通性胶原病。
病例2,男,30岁。因双下肢丘疹伴痒2个月就诊。患者2个月前无明显诱因双小腿出现多个针头大丘疹,正常皮色,而后逐渐扩大,直径达5~6 mm,中心有脐凹,充填角化性物质,瘙痒剧烈(图1c)。1个月前在双臀外侧、双肘外侧出现类似皮损。自行外用玉肤霜,无明显效果,来我院就诊。既往史:体健,无糖尿病病史及其他疾病史,家族中无类似疾病。体检:系统检查无异常。皮肤科查体:四肢散在粟粒大肤色角化性丘疹,中心有脐凹,小腿伸侧为重。实验室检查:血尿便常规无异常、肝肾功、血糖血脂、凝血四项、乙肝表面抗体无异常。组织病理示:表皮杯状下陷,凹陷底部表皮变薄,真皮浅深层血管及附属器周围淋巴细胞、浆细胞浸润(图2c)。Masson染色:可见胶原纤维穿通表皮(图2d)。诊断:获得性反应性穿通性胶原病。
1.2 治疗 病例1考虑患者确诊前一直应用泼尼松10 mg/d,遂继续应用,并嘱阿维A 10 mg日3次口服,泼尼松应用20天后停药,阿维A逐渐减量为10 mg日2次,10 mg日1次,2个月后,皮损完全消退,遂停止治疗。随访3月未复发。
病例2给予阿维A 10 mg,日3次口服,随皮损好转逐渐减量,用至2个月,皮疹大部分消退,停口服药物,同时加用外用药,2周后皮疹逐渐消退,随访2周,未复发,目前患者仍在继续随访中。
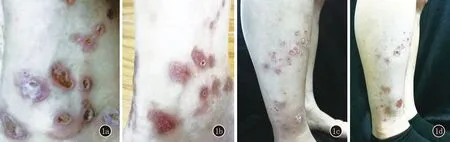
图1 a:病例1左足踝部可见数个大小不等的孤立分布的暗红色丘疹,中央凹陷,充填角化性物质,溃疡边缘呈火山口状,周围绕以红晕;b:病例1治疗2个月后皮损较前变平,皮损区遗留色素沉着;c:病例2下肢多发角化性丘疹,中央可见脐凹,内含角质栓,Kobner现象(+);d:病例2治疗2个月后角质脱落,留有暗褐色斑疹
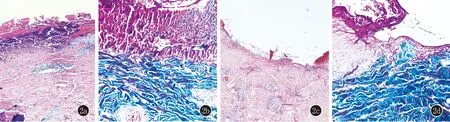
图2 a:表皮杯形下陷,内含有角化不全角质细胞碎片及嗜苏木素胶原纤维,真皮浅层血管及附属器周围多量淋巴细胞及少量嗜酸粒细胞浸润(HE,×40);b:嗜蓝染胶原纤维穿出表皮(Masson染色,×200);c:可见杯状下陷的表皮,凹陷底部表皮变薄,真皮浅深层血管及附属器周围淋巴细胞、浆细胞浸润(HE,×40);d:蓝染胶原束垂直表皮穿出(Masson染色,×200)
2 讨论
反应性穿通性胶原病(RPC)在1967年首次报道,病因不明,遗传和创伤可能是诱发因素[1],分为遗传性和获得性[2]。遗传性反应性穿通性胶原病多早年发病,Ramesh等[3]报道的最早发病年龄是9个月,大多无系统性疾病,家庭成员中有类似疾病史。获得性反应性穿通性胶原病大多成人期发病,无家族史。国外García-Malinis[4]、国内杨扬等[5]、谢红亮等[6]共报道50例获得性反应性穿通性胶原病,其报道的平均年龄分别是54岁、59岁、45.83岁。我们的2例年龄是47岁和30岁,相比偏小。成人期发病患者多合并有严重的糖尿病、慢性肾衰竭、肝病等系统性疾病,也可无任何其他疾病。Karpouzis等[7]报道100 例ARPC,62%与糖尿病及其并发症有关,Saray等[8]统计22例ARPC中3例患者无系统疾病,国内刘永霞等[9]报道35例ARPC患者,28例患者无系统性疾病,而谢洪亮等[6]报道12例ARPC患者中3例无系统性疾病,各种报道差别较大。由于发病率低,获得病例少,以及可能误诊的情况,尚不能得出ARPC与已存在的基础疾病之间存在密切关联。本次报道2例ARPC患者无基础疾病,其中病例1乙肝携带30年,但肝功正常且无肝功受损的临床症状,故认为与本病发生无直接关系。RPC典型皮损为角化性丘疹,中央有脐凹,内充填角化性物质,伴不同程度瘙痒,Koebner征阳性。病理特点:表皮呈杯状下陷,内含角栓,其中有角化上皮、角化不全细胞及变性的胶原,真皮浅层淋巴细胞等炎性细胞浸润;角栓底部的表皮变薄,局部可见垂直穿过表皮的胶原纤维。本病需要与其他穿通性胶原病进行鉴别,穿通性毛囊炎和克里尔病排出物是角蛋白,匍行性穿通性弹性纤维病排出物为弹性纤维,本病排出物为胶原纤维可鉴别。
本病病因及发病机制不清,可能与以下因素相关:①搔抓其引起的轻微创伤是发病的触发因素[8]。应用止痒药物后患者临床症状减轻可间接支持这一说法;②糖尿病可能与本病发生有关[10],长期高血糖使蛋白或其他复合物糖基化,导致真皮胶原纤维尤其是胶原I和III结构改变;③胶原代谢紊乱可能是本病发病的另一因素,皮损中(主要是恢复期皮损)可见到转化生长因子-β3(TGF-β3)、基质金属蛋白酶-1(MMP-1)和金属蛋白酶组织抑制因子-1(TIMP-1)的表达增加[11],不过这也可能与正处于皮损恢复期有关;④血清中纤维连接蛋白水平升高也可能与本病有关[12],其可参与上皮细胞间信号传导,运动和分化的过程,并与Ⅳ型胶原(基底膜中的胶原)和角质形成细胞结合,刺激上皮增生和胶原穿通表皮。结合文献研究及病理特点,推测ARPC可能是一种内外因素作用下,由炎症细胞(T细胞为主)介导,通过释放IL1、IL17等相关细胞因子,引起炎症及胶原变性穿通表皮的一种免疫性疾病。ARPC的治疗具有挑战性。如果存在基础疾病,积极治疗原发病至关重要。口服抗组胺药物及外用糖皮质激素经常用作ARPC的经验治疗。有学者报道别嘌呤醇用于ARPC的治疗,并取得良好效果[13]。其他治疗方式包括口服和外用维A酸类制剂。另外也有他卡西醇、马沙骨化醇、阿米替林、NB-UVB、光动力疗法治疗ARPC成功的报道。由于以上报告大部分都是孤立的个案报道,缺乏对照研究及应用推广,所以ARPC目前尚无标准的治疗方法及临床指南。张倩雯等[14]曾报道过3例ARPC患者口服维A酸类、抗组胺药物联合外用糖皮质激素类及NB-UVB照射治疗,治疗3~4个月之后仍有新发皮疹,未取得满意疗效。我们的2例患者,病例1确诊ARPC前,给予糖皮质激素治疗,在糖皮质激素减量时皮疹复发泛发全身,加用阿维A治疗2个月,角栓脱落,瘙痒减轻,效果佳(图1b);病例2在发病之初即予以病理活检,确诊为ARPC,给予阿维A口服,皮损得以控制(图1d)。2例ARPC患者均给予阿维A口服,2个月后,角质栓大部分脱落,皮损均明显改善。回顾治疗过程,推测阿维A在ARPC治疗中发挥了重要作用。
结合ARPC发病机制及病理特点,阿维A可能通过以下机制发挥治疗作用:①抑制T细胞向Th2、Th17分化,抑制相关炎症因子释放,抗炎调节免疫状态;②抑制增生的胶原蛋白过度表达,诱导基质金属蛋白酶1、8表达,溶解角栓[15],也能促进老化、萎缩的胶原蛋白增生[16],对胶原纤维代谢起到平衡调节作用。综上,我们推测阿维A可能通过调节免疫状态、抗炎、调节胶原代谢,多环节的阻断ARPC发生,有效治疗ARPC。
在本次报道的2例ARPC患者,应用阿维A治疗后病情均得到缓解,但遗憾的是我们并未单独应用阿维A治疗,可能其它药物也起了重要的作用,但两例均应用阿维A治疗有效,尤其是第一例加用阿维A后患者病情明显好转,我们推测阿维A治疗此病有效。但其作为一线治疗药物仍有待大样本、随机对照临床研究并长期观察以进一步证实。

