SATB1高表达通过促进上皮-间充质转化而介导鼻咽癌细胞侵袭和转移*
贾亚楠, 王可可, 王思思, 廖晓敏, 封慕茵, 袁建玲, 邵钟铭, 揭 伟, 申志华△
(广东医科大学基础医学院 1病理生理教研室, 2病理学系, 广东 湛江 524023)
肿瘤远处转移和局部复发是影响鼻咽癌(nasopharyngeal carcinoma,NPC)患者预后的关键因素。前期报道发现部分基因表达异常与NPC的细胞生物学行为有关[1-7],但目前对NPC侵袭和转移机制仍不甚清楚。因此,进一步发现和鉴定参与NPC细胞侵袭转移的重要靶基因,仍然是NPC防治研究的重要内容。特殊富含AT序列结合蛋白1(special AT-rich sequence-binding protein 1,SATB1)是一种核基质结合蛋白,1992年由Dickinson等[8]发现。SATB1可特异性地与核基质区相结合,影响DNA环的构建,参与染色体重塑、组蛋白乙酰化和甲基化等表观遗传学修饰过程,从而调节下游靶基因的转录活性[9]。SATB1 的异常表达与人类多种肿瘤临床进展关系密切[10-13]。我们前期也发现SATB1高表达可以促进NPC的临床进展[14],但确切机制仍有待阐明。上皮-间充质转化(epithelial-mesenchymal transition,EMT)是肿瘤侵袭和转移能力增强的重要机制之一[15],NPC中也存在EMT过程。我们前期证实[16],干预PI3K/Akt信号通路可通过逆转EMT减弱NPC的肺转移,提示靶向EMT在NPC治疗上具有潜在价值。本研究拟在前期基础上,进一步分析NPC中SATB1是否通过调节EMT而参与肿瘤的侵袭和转移。
材 料 和 方 法
1 细胞系及临床标本
NPC细胞系CNE1、CNE2Z及C666-1均为我室保存。76 例NPC及61例鼻咽黏膜慢性炎症(nasopharyngeal chronic inflammation,NPI)患者的石蜡包埋组织来自2011~2015年广东医科大学附属医院病理中心保存的标本。所有NPC患者均为首次就诊,未接受任何治疗,组织学类型均为非角型未分化性癌,采用pTNM系统(AJCC/UICC 2002)进行分类。76例NPC患者中,男性25例,女性51例,中位年龄45岁;61例NPI为同期标本,其中男性36例,女性25例,中位年龄46岁。临床人体标本的使用符合广东医科大学附属医院有关伦理学规定(伦理学批件编号为PJ2014028)。
2 主要试剂及仪器
兔抗人SATB1抗体(Novus);鼠抗人上皮型钙黏蛋白(E-cadherin)和波型蛋白(vimentin)抗体(Cell Signaling);鼠抗人β-actin抗体(Santa Cruz);HRP或FITC标记的 II 抗(武汉三鹰);SATB1特异性小干扰RNA(small interfering RNA,siRNA)(广州锐博);RNA抽提试剂盒、RT-PCR试剂盒和Lipofectamine 3000(Invitrogen);定量PCR试剂盒(Roche);PCR引物由上海生工公司合成;免疫组化PV9000试剂盒及DAB显色试剂盒(北京中杉金桥);DMEM培养基和胎牛血清(HyClone);蛋白酶及磷酸酶抑制剂、RIPA蛋白裂解液和BCA试剂盒(江苏碧云天);ECL发光剂及PVDF膜(Thermo Fisher Scientific)。定量PCR仪(Roche);激光共聚焦显微镜(TCS SP5 II,Leica);凝胶成像分析系统(北京天能);蛋白电泳仪(Bio-Rad)等。
3 方法
3.1免疫组化 参考既往方法[4, 14, 16]采用PV9000法检测上述临床标本中SATB1、E-cadherin及vimentin蛋白的表达。SATB1、E-cadherin和Vimentin I抗按1 ∶100稀释。SATB1表达评分标准如下,按阳性细胞数评分:无阳性细胞为0分,<10%为1分,≥10%但<50%为2分,≥50%为3分;按显色程度评分:无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。E-cadherin和vimentin表达评分标准如下,按阳性细胞数评分:无阳性细胞为0分,<25%为1分,≥25%但<50%为2分,≥50%但<75%为3分, ≥75%为4分;按显色程度评分:无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。结果判断采用免疫反应积分(immunoreactive scores, IRS)标准,IRS=染色强度评分×阳性细胞数评分,两者总分≥6分为SATB1高表达,总分≥3分为E-cadherin和vimentin高表达。
3.2细胞培养 参考既往方法[5-7]进行。高分化CNE1、低分化CNE2Z和未分化C666-1细胞用DMEM完全培养基(含10%胎牛血清、1×105U/L 青霉素和100 mg/L链霉素),置37 ℃、5% CO2、饱和湿度培养箱中培养,每2 d 换液,对数生长期细胞用于相关实验。
3.3siRNA转染 参考既往方法[14]进行。采用2对SATB1特异性siRNA组成cocktail进行细胞转染。siRNA序列如下:si-SATB1-1的正义链为5’-GGAUAGUCUUUCUGAGCUAdTdT-3’,反义链为5’-UAGCUCAGAAAGACUAUCCdTdT-3’;si-SATB1-2 的正义链为5’-GCUGAAAGAGACCGAAUAUdTdT-3’,反义链为5’-AUAUUCGGUCUCUUUCAGCdTdT-3’。采用无关序列作为阴性对照(siRNA-NC, Cat. #siB05815,广州锐博)。转染前 1 d,将CNE1、CNE2Z和C666-1细胞接种于 6/24孔板,按照转染试剂盒说明书,待细胞融合度达60~70%进行转染,siRNA浓度为50 nmol/L。转染后细胞置于37 ℃、5% CO2、饱和湿度的培养箱中继续培养,6 h后更换细胞培养液。荧光显微镜下通过观察Cy3标记的siRNA-NC组荧光来判断转染效率,于预定时点收获细胞用于相关实验。
3.4RNA提取、逆转录及real-time PCR 采用既往方法[17-18]进行RNA提取、逆转录和real-time PCR反应。SATB1的上游引物序列为5’-CTGGGCTCGTATCAACACCTAT-3’,下游引物序列为5’-TAAGGACTGCTGGGCTAAAAGT-3’;E-cadherin的上游引物序列为5’-TTGCTACTGGAACAGGGACAC-3’,下游引物序列为5’-CCCGTGTGTTAGTTCTGCTGT-3’;vimentin的上游引物序列为5’-TGCGTGAAATGGAAG AGAACT-3’,下游引物序列为5’-TCAGGTTTCAGGGAGGAAAAGT-3’;β-actin的上游引物序列为5’-TGACGTGGACATCCGCAAAG-3’,下游引物序列为5’-CTGGAAGGTGGACAGCGAGG-3’。PCR参数为:95 ℃预变性5 min; 95 ℃ 10 s, 60 ℃ 30 s, 共45个循环。采用2-ΔΔCt法判断目的基因mRNA的表达水平。
3.5Western blot实验 提取各组细胞总蛋白,BCA法定量蛋白浓度,取50 μg蛋白用于SDS-PAGE。蛋白转移至PVDF膜,经脱脂奶粉封闭后加入I抗(SATB1, 1∶500; E-cadherin, 1∶1 000; vimentin, 1∶1 000; β-actin, 1∶3 000)4 ℃过夜孵育,TBST洗涤,HRP标记的IgG (1∶3 000)室温孵育2 h,ECL发光后凝胶成像系统扫描获得目的蛋白条带。
3.6免疫荧光染色 参考既往采用的间接免疫荧光法[19-20]检测CNE1、CNE2Z及C666-1这3种细胞中SATB1蛋白的表达。SATB1抗原定位以FITC标记的IgG显示,激光共聚焦显微镜下观察并拍照。
3.7Transwell迁移实验 Transwell小室置于24孔板。siRNA转染的C666-1细胞(48 h)用含0.5%胎牛血清的DMEM重悬,取2×104个细胞接种于Transwell小室上室,体积为200 μL; Transwell小室下室中加含10%胎牛血清的DMEM培养液500 μL,细胞置于37 ℃、5% CO2、饱和湿度的培养箱中继续培养24 h,培养结束后取出小室并用10%中性甲醛固定15 min,伊红染液染色5 min,用棉签小心擦除小室上室面细胞,PBS洗涤后在显微镜物镜下观察并拍照。以穿膜的细胞数差异代表细胞运动能力的改变。每张膜选3个典型视野,计算平均细胞数,每组重复3孔。
4 统计学处理
使用GraphPad Prism 7.0软件进行统计分析。临床标本中SATB1、E-cadherin和vimentin表达计算IRS积分后采用非配对资料t检验和Pearson相关性分析;计数资料采用2检验。计量资料数据采用均数±标准差(mean±SD)表示,组间比较采用单因素方差分析或t检验。以P<0.05为差异有统计学显著性。
结 果
1 临床标本中免疫组化检测结果及相关性分析
对76例NPC和61例对照NPI组织进行SATB1、膜E-cadherin和vimentin的免疫组化检测,结果显示,NPC中SATB1、膜E-cadherin和vimentin的IRS与NPI相比显著改变(P<0.01),见图1A~C。Pearson相关分析结果显示,NPC中SATB1与膜E-cadherin表达呈负相关(r=-0.146,P=0.264),与vimentin表达呈正相关(r=0.358,P=0.009),而vimentin与膜E-cadherin表达呈负相关(r=-0.207,P=0.029),见图1D~F。
2 NPC中SATB1和EMT标志基因的表达与临床病理参数的相关性
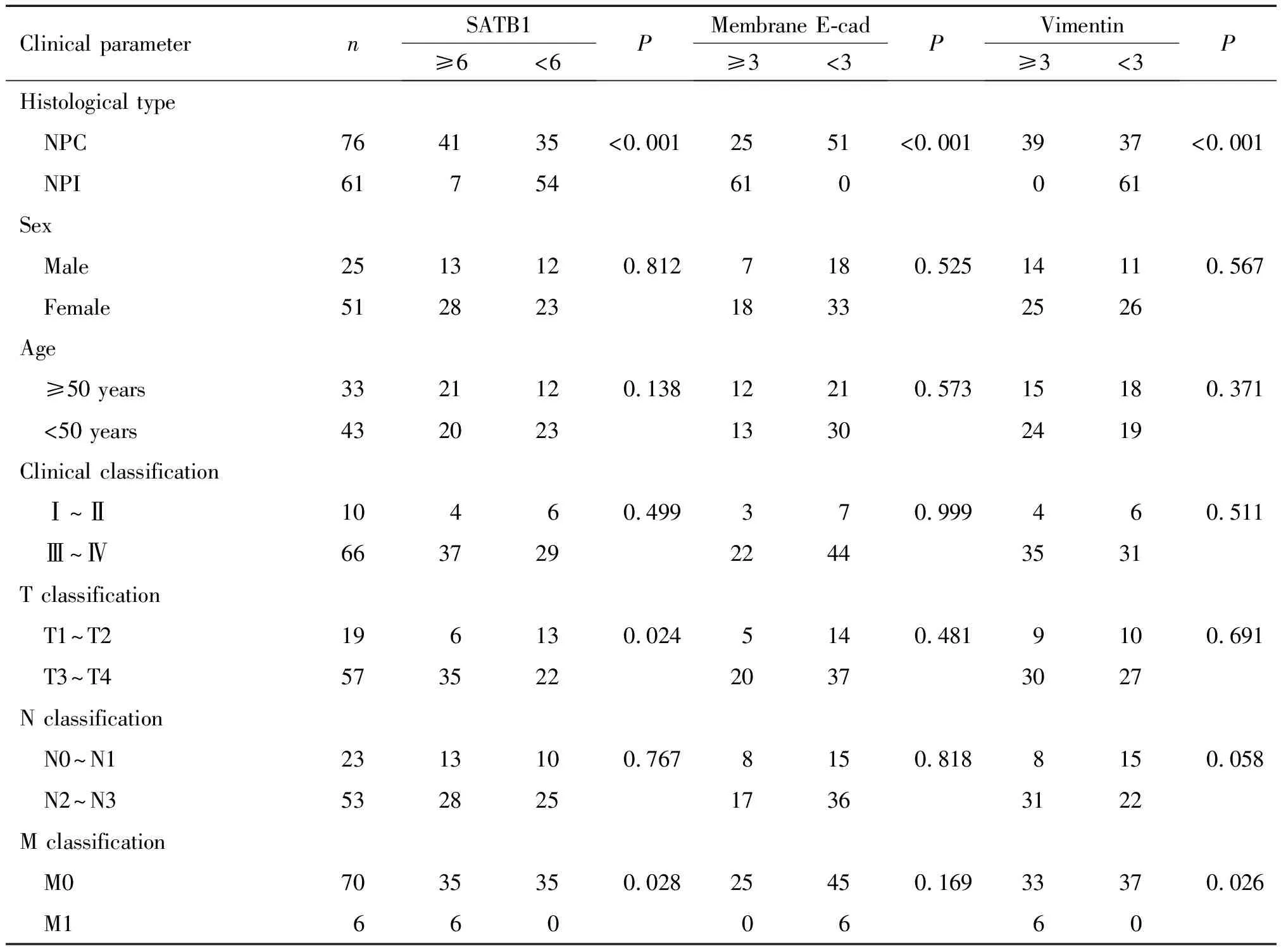
76例NPC中SATB1高表达41例(53.95%),与NPI对照组(11.48%)比较显著升高(P<0.001)。进一步分层研究显示,SATB1高表达与NPC患者的年龄、性别、临床分期和N分期无关,但与T分期和M分期均呈正相关(P<0.05)。61例NPI中均表达膜E-cadherin(100%),而NPC中膜E-cadherin表达下降(25/76,32.89%),差异有显著性(P<0.001),同时有38例NPC肿瘤细胞可见胞质E-cadherin着色。分层研究显示,膜E-cadherin表达与NPC患者年龄、性别、临床分期、T分期、N分期和M分期均无关。在NPI中上皮细胞vimentin均为阴性(0/61,0%),而间质细胞表达阳性;NPC中除间质成分外,部分肿瘤细胞胞质也表达vimentin(39/61,63.93%)。Vimentin高表达与NPC患者年龄、性别、临床分期、T分期和N分期无统计学相关性,与M分期呈正相关(P=0.026),见图2及表1。

Figure 1. The protein expression of SATB1, membrane E-cadherin and vimentin in clinical samples of nasopharyngeal carcinoma (NPC) and nasopharyngeal chronic inflammation (NPI) and the correlations. IRS of SATB1, membrane E-cadherin and vimentin in clinical samples of NPC and NPI were counted, and then unpairedttest (A~C) and Pearson correlation (D~F) were used for statistical analysis.**P<0.01vsNPI group.
图1SATB1、膜E-cadherin和vimentin在临床NPC及NPI标本中的表达及相关性分析
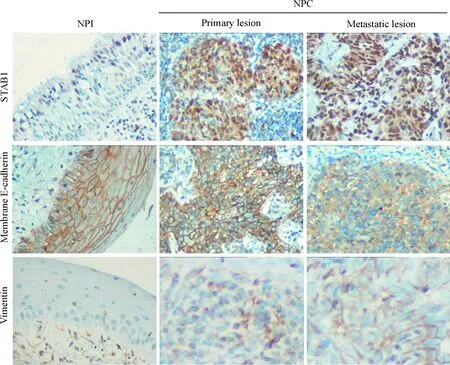
Figure 2. The representative images of SATB1, E-cadherin and vimentin protein expression in NPC and NPI samples (×200).
图2临床NPC及NPI组织中SATB1、膜E-cadherin和vimentin蛋白表达结果
表1NPC临床标本中SATB1、膜E-cadherin和vimentin蛋白的表达及与患者临床参数的相关性
Table 1. The expression of SATB1, membrane E-cadherin (E-cad) and vimentin in clinical samples and the correlations with NPC clinical parameters
Clinical parameternSATB1≥6<6PMembrane E-cad≥3<3PVimentin≥3<3PHistological type NPC764135<0.0012551<0.0013937<0.001 NPI61754610061Sex Male2513120.8127180.52514110.567 Female51282318332526Age ≥50 years3321120.13812210.57315180.371 <50 years43202313302419Clinical classification Ⅰ~Ⅱ10460.499370.999460.511 Ⅲ~Ⅳ66372922443531T classification T1~T2196130.0245140.4819100.691 T3~T457352220373027N classification N0~N12313100.7678150.8188150.058 N2~N353282517363122M classification M07035350.02825450.16933370.026 M16600660
3 不同分化状态的NPC细胞中SATB1的表达
分别对不同分化状态的NPC细胞进行SATB1表达的检测,发现无论是mRNA水平还是蛋白水平,CNE1细胞中的SATB1表达水平最低,而CNE2Z和C666-1细胞中的SATB1表达水平逐渐增加,见图3A、B。免疫荧光观察结果显示,CNE1和CNE2Z中SATB1以胞质阳性为主,而C666-1中出现明显胞核阳性,见图3C。鉴于C666-1细胞中的SATB1表达水平最高,我们后续以C666-1细胞为研究对象,进一步分析干扰SATB1后对细胞EMT和迁移能力的影响。
4 siRNA对C666-1细胞的影响
本研究采用2对siRNA组成cocktail来保证干扰的效果。结果显示,高表达SATB1的C666-1细胞经转染SATB1特异性siRNA 48 h后,SATB1的mRNA水平下降90%以上,见图4A;同时EMT相关分子E-cadherin和vimentin的mRNA及蛋白均有明显的改变,表现为E-cadherin水平增加和vimentin水平下降(P<0.01),见图4B~D。
5 SATB1干扰后细胞迁移能力的变化
采用Transwell实验分析干扰SATB1后对C666-1细胞迁移能力的影响,结果显示与对照组比较,干扰SATB1 24 h后穿过8 μm孔径PVDF膜的细胞数显著减少(P<0.01),见图5。
讨 论
SATB1高表达在较多的人类肿瘤中得以报道。2008年,Han等[21]报道在乳腺癌细胞中改变SATB1表达将导致超过1 000个下游基因表达的改变,这些表达显著改变的基因大多数涉及细胞周期、细胞黏附、细胞外基质形成及下游重要信号传导等生物学功能。由此涌现了较多有关SATB1与肿瘤关系的研究。目前已经发现SATB1高表达可促进人类消化系统肿瘤[10]、生殖系统肿瘤[12-13, 22]、泌尿系统肿瘤[23]和黑色素瘤[24]等多种恶性肿瘤的进展;也有少部分相反的报道认为SATB1丢失与肿瘤预后关联密切[25-26]。因此,这些矛盾结果的存在促使我们对NPC中SATB1的表达进行更深入的研究。

Figure 3. The expression of SATB1 in the NPC cell lines with various differential status. Highly differentiated CNE cells, poorly differentiated CNE2Z cells and undifferentiated C666-1 cells were regularly cultured, and SATB1 expression was examined by real-time PCR (A), Western blot (B) and immunofluorescence staining (C). Mean±SD.n=3.*P<0.05,**P<0.01 CNE1 group;#P<0.05,##P<0.01vsCNE2Z group.
图3SATB1在不同分化NPC细胞中的表达

Figure 4. The changes of SATB1 and EMT-related molecule expression after interfering withSATB1 in the C666-1 cells. Real-time PCR (A~C) and Western blot (D) were used to detect the changes of SATB1, E-cadherin and vimentin in the C666-1 cells transfected withSATB1 specific siRNA and control siRNA (NC). Mean±SD.n=3.**P<0.01vssiRNA-NC group.
图4干扰C666-1细胞中SATB1表达及对EMT相关分子表达的影响

Figure 5. The migration ability of C666-1 cells after interfering withSATB1 (×200). Mean±SD.n= 9.**P<0.01vssiRNA-NC group.
图5干扰SATB1表达对C666-1细胞迁移能力的影响
我们既往研究已经提示SATB1高表达与NPC的临床进展呈正相关,且SATB1高表达与EB病毒编码的潜伏膜蛋白有关[14]。本研究再次证实,在临床NPC样本中SATB1表达以胞核为主,SATB1高表达与NPC患者的T分期和M分期呈正相关,且与NPC中膜E-cadherin的表达未见统计学相关性,与vimentin表达呈正相关,初步提示NPC中SATB1高表达可能通过EMT途径参与NPC进展。随后,对不同分化状态NPC细胞系进行SATB1表达的筛查,发现随着细胞分化程度的下降,SATB1表达水平升高,尤以C666-1细胞表达明显。在表达方式上,CNE1和CNE2Z细胞中均以胞质表达为主,而C666-1细胞出现了明显的胞核表达,这提示SATB1表达方式的不同可能导致其生物学功能各异。有报道认为,口腔鳞状细胞癌细胞中SATB1表达的核/质比增加与患者的预后相关[27],尽管我们没有分析临床NPC样本中SATB1表达的核/质比,但这一结论与我们所观察到的不同分化状态NPC细胞系中SATB1的表达趋势相吻合。
SATB1最早作为细胞核基质结合蛋白而被鉴定[1],随后逐渐发现其具有调节肿瘤细胞EMT作用[28-31]。肿瘤细胞发生EMT即指上皮源性肿瘤细胞获得间叶源性细胞表型,表现为上皮细胞标志物如E-cadherin表达下降,而间叶源性细胞标志物如vimentin和N-cadherin等表达却上升,细胞同质黏附能力下降,侵袭运动及转移能力增加。2012年Tu等[31]发现肝癌细胞中SATB1过表达通过调节Snail、Slug和Twist 表达进而影响vimentin和E-cadherin表达而参与EMT过程。随后,在膀胱癌[28]、结直肠癌[29]和前列腺癌[30]等多种类型恶性肿瘤中发现具有相似的作用。本研究证实,在临床NPC样本中,SATB1高表达与E-cadherin表达呈负相关,与vimentin表达呈正相关;随后以SATB1高表达的C666-1细胞为对象,采用siRNA干扰SATB1表达后,我们观察到明显的E-cadherin表达上升和vimentin表达的下降;最后从功能上证实抑制SATB1后能显著减弱SATB1高表达细胞C666-1的迁移能力。此外,我们应用CRISPR/Cas9技术完全敲除了C666-1细胞中SATB1表达后,C666-1细胞出现明显的形态学变化和细胞骨架分布的改变,也伴随相应的迁移运动能力下降(未发表资料)。由此可见,NPC中SATB1高表达可以通过EMT机制促进肿瘤细胞的侵袭和转移。
总之,本研究发现NPC中SATB1高表达与患者的临床进展正相关,其机制可能与SATB1促进肿瘤细胞EMT有关。本研究丰富了NPC发病机制学说。后期待补充动物实验来进一步验证。

