不同分子亚型乳腺癌细胞系中RUNX3蛋白表达及定位研究*
殷倩倩, 马东慎, 魏 瑜, 刘 慧
(徐州医科大学病理学教研室, 江苏 徐州 221002)
乳腺癌已成为中国女性发病率最高的肿瘤,也是威胁女性健康的首要疾病[1],全球每年有超过40万患者死于乳腺癌[2]。随着个体化治疗和精准医疗概念的提出,特异性分子靶向治疗成为当前肿瘤研究的热点。人类Runt相关转录因子3(human Runt-related transcription factor 3,RUNX3)属于Runt家族成员,在细胞生长发育过程中起着重要作用。相关研究不断发现启动子CpG岛异常甲基化和胞浆内错误定位等均可导致RUNX3基因表达沉默和蛋白失活[3-4],从而引发多种肿瘤,如胃癌[5]、结直肠癌[6]、肝癌[7]和乳腺癌[8]等的发生。目前有研究认为雌激素受体(estrogen receptor,ER)阳性的乳腺癌中RUNX3基因启动子区域CpG岛异常甲基化可导致其转录阻遏,是RUNX3基因表达沉默的主要机制[9]。但是,RUNX3作为一种普遍存在的抑癌基因,在不同分子亚型乳腺癌的发生发展过程中是否存在胞浆错误定位导致的失活还有待进一步的研究。
本研究采用Western blot法和免疫荧光法检测不同分子亚型乳腺癌细胞中RUNX3的蛋白表达和亚细胞定位情况,以及经出核转运抑制剂来普霉素B(Leptomycin B)处理后RUNX3蛋白表达和亚细胞定位的改变情况,结果发现在不同亚型乳腺癌细胞系中均存在RUNX3在胞质中错误定位的现象,通过出核转运抑制剂逆转RUNX3的胞质定位能够抑制肿瘤细胞的活力,提示抑制RUNX3的出核过程可能成为治疗乳腺癌的一个新的方向,并为RUNX3成为乳腺癌潜在的治疗靶点提供理论依据。
材 料 和 方 法
1 材料
人乳腺癌细胞MCF-7、T47D、SKBR-3、MDA-MB-231和BT-549及正常乳腺上皮细胞MCF-10A购自中国科学院细胞所。DMEM培养基和L-15培养基购自Gibco;RPMI-1640培养基和DMEM/F12培养基购自Hyclone;胎牛血清购自杭州四季青公司;Leptomycin B、RIPA裂解液和BCA蛋白浓度测定试剂盒购自中国碧云天公司;抗RUNX3抗体(R3-5G4)和辣根过氧化物酶标记山羊抗小鼠IgG购自AbSci;EdU染色试剂盒购自南京赛泓瑞生物公司;抗GAPDH抗体和抗Histone H3抗体购自Affinity。
2 方法
2.1细胞培养 乳腺癌细胞MCF-7、T47D和SKBR-3在含10%胎牛血清的DMEM培养基中培养,乳腺癌细胞MDA-MB-231在含10% 胎牛血清的L-15培养基中培养,乳腺癌细胞BT-549在含10% 胎牛血清的RPMI-1640培养基中培养,正常乳腺上皮细胞MCF-10A在含10% 胎牛血清的DMEM/F12培养基中培养。所有细胞培养于37 ℃、5% CO2恒温培养箱中,隔日换液1次,待细胞生长至90%融合进行传代。
2.2Western blot实验 细胞传代培养过夜,细胞贴壁后更换新鲜培养基,将细胞分为溶剂对照组和Leptomycin B处理组,将溶剂(PBS)和Leptomycin B(25 nmol/L)分别加入培养基中,孵育24 h。然后吸去培养基,提取总蛋白,按试剂盒方法分离胞浆和胞核蛋白,并用BCA法进行蛋白定量。根据常规方法,使用SDS-PAGE对蛋白样品进行分离,使用PVDF膜进行转膜后,5%脱脂牛奶封闭2 h,加入 I 抗后4 ℃过夜孵育,抗体稀释比为RUNX3(1∶4 500)、GAPDH(1∶4 000)和Histone H3(1∶3 000)。次日使用TBST洗涤缓冲液洗涤3遍后,加入II抗室温孵育1 h,再洗涤3遍后用化学发光法检测目的条带,并采用Image J图像分析系统对条带进行分析。实验重复3次。
2.3免疫荧光实验 取单层生长的细胞,在传代培养时,将细胞接种到预先放置有处理过的盖玻片的培养皿中,培养细胞过夜,使细胞贴壁。更换新鲜培养基后,将细胞分为溶剂对照(control)组和Leptomycin B处理组。将溶剂(PBS)和Leptomycin B(25 nmol/L)分别加入培养基中,孵育24 h。然后取出盖玻片,PBS洗2次。用4%多聚甲醛固定15 min,PBS洗涤3次,每次5 min。滴加0.1% Triton X-100(细胞破膜)15 min,PBS洗3次,每次5 min。用10%正常羊血清封闭液对细胞进行室温封闭1 h。弃去封闭液勿洗,滴加 I 抗4 ℃过夜。PBS漂洗3次,每次5 min,滴加荧光 II 抗,室温避光孵育1 h。PBS漂洗3次,每次5 min,使用DAPI染核,室温孵育5 min。PBS漂洗3次,每次5 min。滴加封片剂 1 滴,封片,荧光显微镜观察随机取6个视野拍照。实验重复3次。
2.4细胞活力检测 取对数生长期的细胞,调整细胞浓度为3.0×106/L,按每孔100 μL接种至96孔板,每组设6个复孔,放入37 ℃、5% CO2培养箱中过夜使细胞贴壁。去除上层培养基,将细胞分为溶剂对照(control)组和Leptomycin B(25 nmol/L、50 nmol/L、75 nmol/L和100 nmol/L)处理组,按分组分别处理后,继续培养于0 h、24 h、48 h和72 h, 取出培养板,吸弃培养基,将完全培养基和CCK-8溶液按10∶1的比例预先混匀,每孔加入100 μL混合液,另设一个空白对照孔,无细胞生长孔,只加100 μL混合液,在37 ℃孵育2 h,使用酶标仪在450 nm处检测吸光度(A)值。实验重复3次。
2.5EdU染色实验 按方法2.3细胞培养和处理方法培养细胞,配制含50 μmol/L EdU培养基。弃去细胞上清,使用含EdU的培养基孵育2 h,孵育完毕后弃去培养基,并使用PBS漂洗2次,每次5 min,然后每孔加入50 μL 4%多聚甲醛固定液室温固定30 min,弃去固定液,每孔加入50 μL甘氨酸(2 g/L)洗涤5 min。PBS洗涤5 min。每孔加入100 μL 0.5% Triton X-100 透化10 min,PBS洗涤5 min。每孔加入100 μL Apollo染色反应工作液,避光孵育30 min;弃去上清,再次使用100 μL 0.5% Triton X-100 透化10 min,加入10 mg/L DAPI进行核染色,室温孵育5 min。PBS漂洗2次,每次5 min,最后在荧光显微镜下观察拍照。
3 统计学处理
采用SPSS 16.0软件进行统计处理,定量资料采用均数±标准差(mean±SD)表示。两组间均数比较采用独立样本t检验;多组均数比较采用单因素方差分析(one-way ANOVA)。以P<0.05为差异有统计学意义。
结 果
1 RUNX3在5种乳腺癌细胞系及正常乳腺上皮细胞中的表达情况
本实验首先观察5种乳腺癌细胞系(MCF-7、T47D、SKBR-3、MDA-MB-231和BT-549中RUNX3)蛋白表达及定位情况,并分析不同分子亚型乳腺癌之间的关系,其中,MCF-7和T47D为ER阳性细胞系,SKBR-3为人类表皮生长因子受体2(human epidermal growth factor receptor-2, HER-2)阳性细胞系,MDA-MB-231和BT-549为三阴性细胞系,并选择正常乳腺上皮细胞系MCF-10A作为对照。Western blot法对RUNX3在胞质和细胞核中的蛋白表达进行定量分析的结果可见,在不同亚型的乳腺癌细胞系中均能检测到RUNX3的表达,见图1A,推测在乳腺癌细胞中可能存在其它RUNX3失活机制。进一步研究发现与正常乳腺上皮细胞MCF-10A相比,5种乳腺癌细胞胞浆中的RUNX3表达量明显增多(P<0.05),提示抑癌基因RUNX3的胞浆移位表达与肿瘤细胞的恶性程度相关,见图1B。
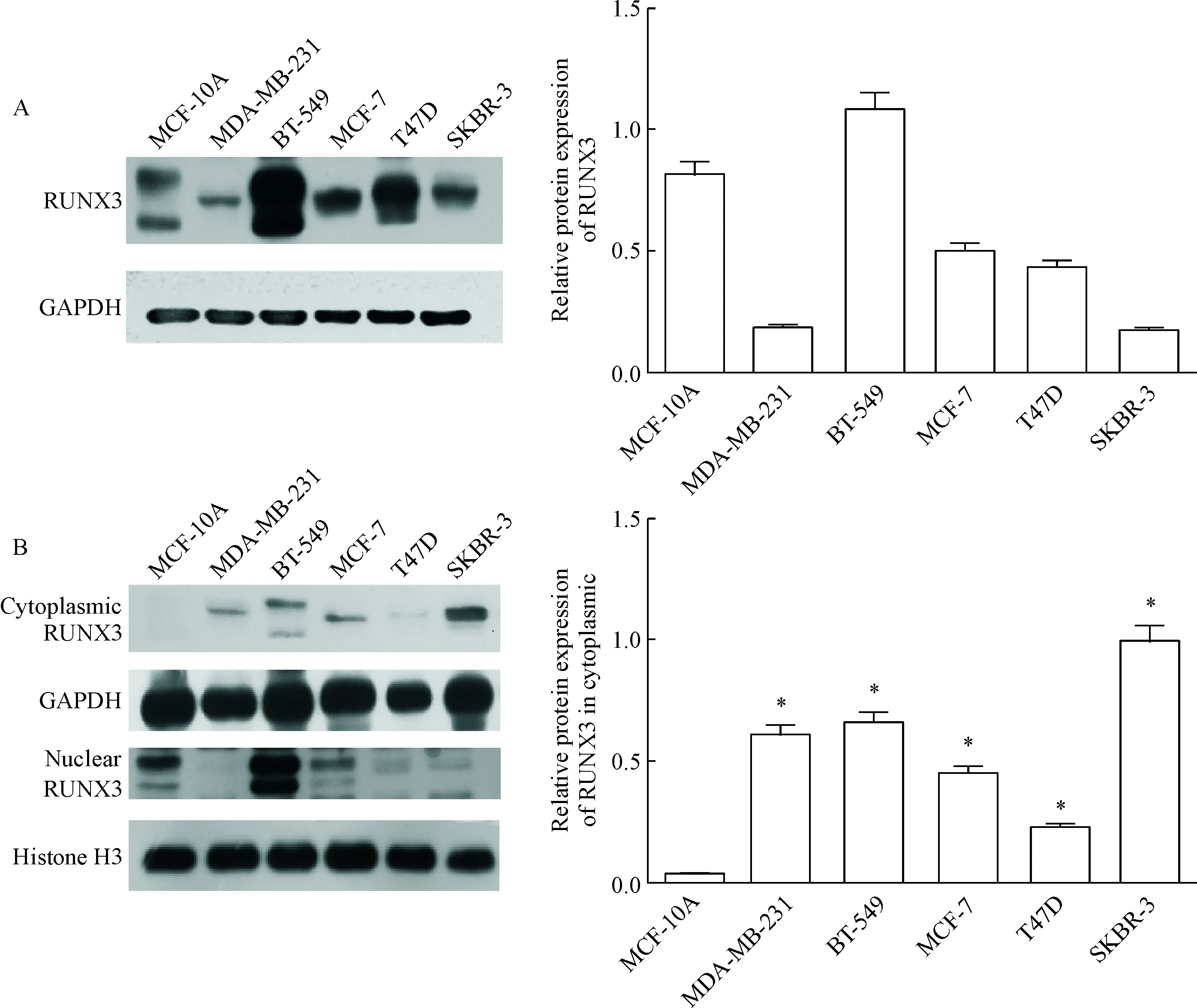
Figure 1. The protein expression of RUNX3 in 5 breast cancer cell lines and normal breast epithelial cell. A: Western blot was used to detect the total expression of RUNX3; B: Western blot was used to detect the expression of RUNX3 in the cytoplasm and in nuclei. Mean±SD.n=3.*P<0.05vsMCF-10A group.
图1RUNX3在5种乳腺癌细胞系及正常乳腺上皮细胞中的表达情况
2 RUNX3的亚细胞定位
使用免疫荧光法对RUNX3的亚细胞定位进行分析,与Western blot结果一致,与正常乳腺上皮细胞MCF-10A相比,5种乳腺癌细胞中RUNX3蛋白存在明显的胞浆移位,提示在不同分子亚型乳腺癌细胞系中的RUNX3难以发挥抑癌活性的原因可能是其在亚细胞结构上的错误定位,见图2。

Figure 2. The subcellular localization of RUNX3. Immunofluorescence was performed to analyze the subcellular localization of RUNX3 protein (red is RUNX3, blue is DAPI) in normal breast epithelial cell MCF-10A and 5 breast cancer cell lines MCF-7, T47D, SKBR-3, MDA-MB-231, BT-549. The scale bar=50 μm.
图2免疫荧光法检测RUNX3的亚细胞定位
3 Leptomycin B使肿瘤细胞活力明显减弱并且使RUNX3重新定位于胞核
使用出核抑制剂Leptomycin B(25 nmol/L)对5种乳腺癌细胞系进行处理,研究RUNX3的胞浆移位与其抑癌作用缺失间的关系。CCK-8细胞活力检测结果表明,Leptomycin B处理后,5种乳腺癌细胞的活力明显减弱(P<0.05),见图3A;EdU染色法证实,5种乳腺癌细胞经Leptomycin B处理后,其增殖能力被显著抑制,见图3B。通过免疫荧光法进一步确认RUNX3的亚细胞定位改变情况,我们发现经LeptomycinB处理后,5种乳腺癌细胞中的RUNX3均重新定位于胞核,见图4;Western blot法检测结果显示,与未处理组相比,Leptomycin B处理后,5种乳腺癌细胞胞浆中的RUNX3蛋白表达量明显降低、胞核中的RUNX3蛋白表达量明显增多(P<0.05),见图5。结合CCK-8实验结果,提示逆转RUNX3出核行为能够有效抑制不同亚型乳腺癌细胞的活力,针对性抑制RUNX3的胞浆错误定位可能成为治疗乳腺癌的新方向。
讨 论
根据分子分型,乳腺癌可分成腺腔A型、腺腔B型、HER-2过表达型、基底样型和正常乳腺样型5个亚型,其中前2种为ER阳性表型,后2种为三阴性(雌激素受体、孕激素受体和HER-2表达均为阴性)表型。ER阳性表型乳腺癌临床多以内分泌治疗为主,HER-2过表达型乳腺癌则以赫塞汀靶向治疗为主,而三阴性表型乳腺癌因其明显的异质性及无特效的靶向治疗药物成为当下的研究焦点。因此,进一步了解在不同分子亚型乳腺癌发生发展过程中的基因调控机制,进而开发特异性治疗靶点是目前乳腺癌研究中尤为重要的内容。
抑癌基因RUNX3是来自RUNT结构域的转录因子,该家族成员由RUNX1、RUNX2和RUNX3组成,其中RUNX1和RUNX2主要参与血细胞的生成和骨的生成,而RUNX3主要影响胃肠道和神经的发生以及胸腺产生T淋巴细胞等,三者均可作为肿瘤抑制因子[10]。RUNX3基因位于人染色体的1p36.1,编码RUNX3蛋白。人类RUNX3蛋白是α、β 2个亚单位构成的异二聚体,α亚单位含有一个 RD(Runt domain)保守域,位于RUNX3蛋白的氨基酸末端,由128个氨基酸组成,介导RUNX3蛋白与DNA结合以及蛋白质之间的相互作用[11]。核蛋白RUNX3抑癌作用的实现与多种信号通路有关。已有文献证实RUNX3蛋白是转化生长因子-β (transforming growth factor-β, TGF-β)信号通路下游的1个转录因子,RUNX蛋白与Smad2和Smad3形成复合物传递TGF-β/activin信号进而激活p21启动子,使p21基因表达明显升高,最终抑制细胞周期进程[12-13]。Lin等[14]在胃癌中发现过表达的RUNX3可以降低Akt1的活性进而使FoxO3a的磷酸化减少、活性增加,FoxO3a诱导的Bim基因表达增多,最终发挥抑癌作用。

Figure 3. The changes in the viability (A) and proliferation (B) of breast cancer cell lines after treatment with Leptomycin B (LMB). The scale bar=50 μm. Mean±SD.n=3.*P<0.05vsLMB(-) group.
图3CCK-8法和EdU染色实验检测LeptomycinB处理后细胞活力和增殖能力的变化
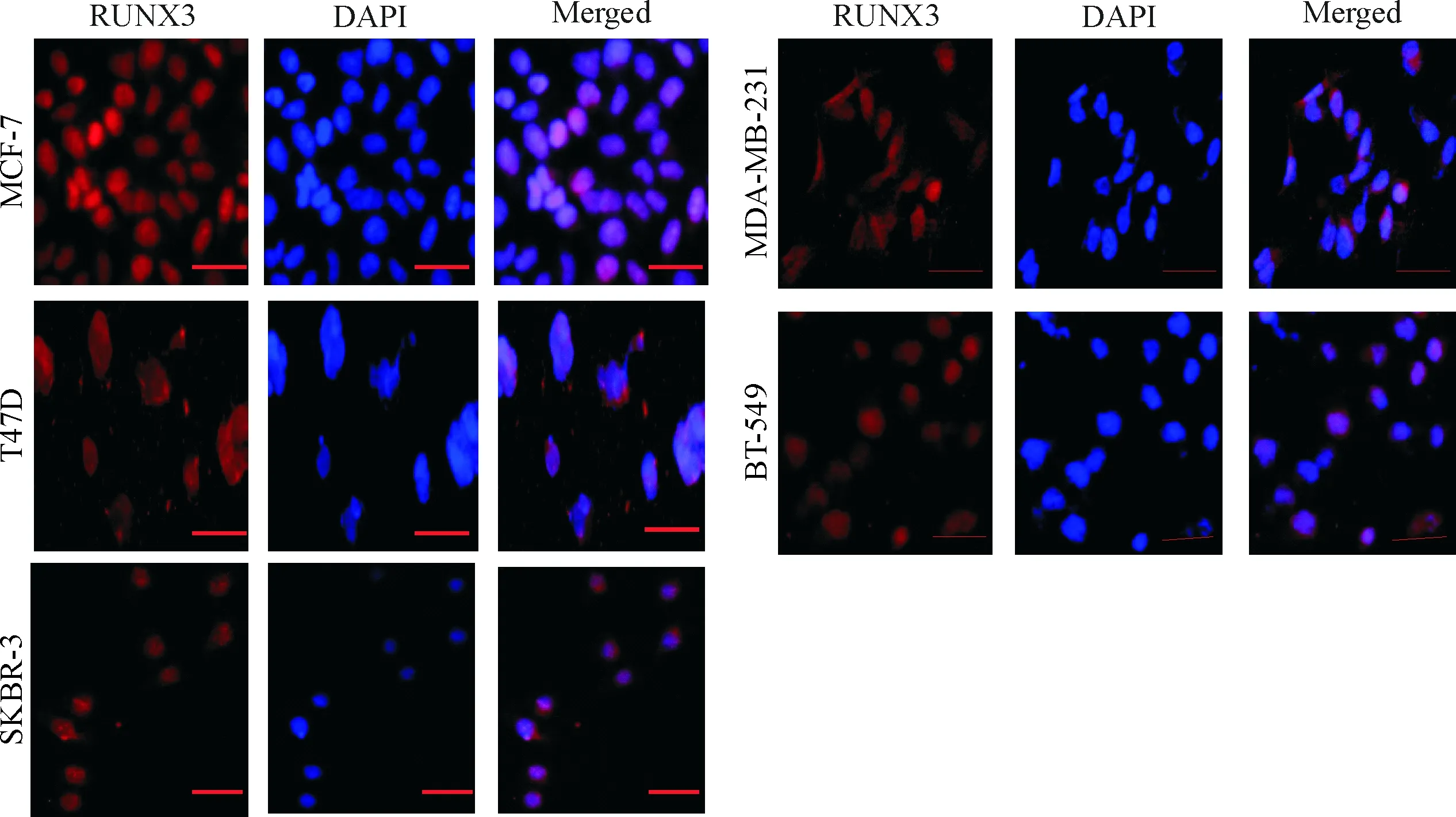
Figure 4. The subcellular localization of RUNX3 after Leptomycin B treatment. Immunofluorescence was used to detect the subcellular localization of RUNX3 in 5 breast cancer cell lines MCF-7, T47D, SKBR-3, MDA-MB-231 and BT-549 exposed in Leptomycin B at 25 nmol/L for 24 h. The cytoplasmic RUNX3 was significantly reduced and the nuclear RUNX3 was significantly increased. The scale bar=50 μm.
图4免疫荧光法检测LeptomycinB处理后RUNX3亚细胞定位的变化
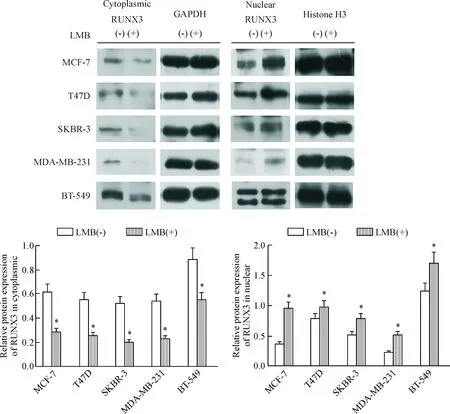
Figure 5. The expression of RUNX3 in 5 breast cancer cell lines after treated with Leptomycin B (LBM). Mean±SD.n=3.*P<0.05vsLMB(-) group.
图5Westernblot法检测LeptomycinB处理后RUNX3蛋白表达量的变化
RUNX3蛋白在正常乳腺导管及组织内浸润淋巴细胞呈胞核阳性,而在肿瘤细胞内呈胞质阳性或者胞质和胞核阳性[15]。而启动子CpG岛异常甲基化和/或胞浆内定位等均可以导致RUNX3基因表达沉默和蛋白失活,并且RUNX3基因启动子区域CpG 岛异常甲基化是ER阳性乳腺癌中RUNX3表达沉默的主要机制。因此,我们推测在不同分子亚型乳腺癌中可能还存在着其它引起RUNX3失活的机制如胞浆移位失活等。
首先,我们探讨了不同分子亚型乳腺癌细胞中RUNX3的蛋白表达及亚细胞定位情况。我们采用Western blot法检测RUNX3在不同分子亚型乳腺癌细胞系和正常乳腺上皮细胞中的表达情况,发现5种乳腺癌细胞胞浆中的RUNX3表达量明显高于正常乳腺上皮细胞;免疫荧光检测结果与Western blot结果一致,即5种乳腺癌细胞胞浆中RUNX3的表达较正常乳腺上皮明显增多。这些结果提示,在不同分子亚型乳腺癌中可能均存在着RUNX3的胞浆移位。
为进一步验证RUNX3的胞浆移位与其抑癌作用的缺失有关,我们使用了出核转运抑制剂——Leptomycin B。Leptomycin B是一种链霉菌的次级代谢产物,可以直接和染色体区域稳定蛋白(chromosome region maintenance 1,CRM1)结合,从而抑制CRM1和带有出核信号的蛋白结合,最终导致由CRM1介导的出核转运的抑制[16]。CRM1是一种参与核转运的蛋白[17],已有文献证实了RUNX3蛋白进入细胞浆的机制主要是通过CRM1介导的核输出[18]。因此,我们将5种乳腺癌细胞用混有不同浓度的Leptomycin B的完全培养基培养不同时间,CCK-8细胞活力检测结果显示Leptomycin B工作浓度为25 nmol/L即可见明显的效果,最佳作用时间可为24 h和48 h。故而,我们决定将5种乳腺癌细胞经Leptomycin B(25 nmol/L,24 h)处理后,通过Western blot法及免疫荧光法检测RUNX3蛋白表达及亚细胞定位的改变情况。2种实验方法的结果均显示RUNX3细胞浆中表达量明显减少、细胞核中表达量明显增加,同时CCK-8检测结果也显示了5种癌细胞的活力明显减弱,EdU染色实验证明Leptomycin B处理后细胞增殖能力显著下降。
综上所述,在不同分子亚型乳腺癌中均存在着不同程度的RUNX3蛋白的胞浆移位失活,有效逆转RUNX3的核转位能够抑制乳腺癌细胞的增殖,该机制可能成为治疗乳腺癌的新靶点。

