乳腺癌粗针穿刺与术后活检标本病理分级及免疫组化比较
魏颖
医学中所指的恶性肿瘤常被人们称之为癌症,临床实践中,乳腺癌的发病率和致死率较高,是最为常见的也是对女性健康和生命威胁最大的恶性肿瘤之一[1]。最近几年,我国女性乳腺癌患者数量极速增加,据权威机构统计,年平均增长速度高达27.6%[2]。乳腺癌有着比较明显的特点,如病患人群一般在42周岁以上;发病初期症状不易被觉察,大部分病患被确诊时已接近晚期;不宜采取外科手术方法治疗,多采用介入手段,如放化疗等[3]。临床实践中,化疗方法能够有效延缓病患生存时间,提升病患生存质量,是比较有效的治疗手段。但是,因化疗使用细胞毒药物,会给病患带来严重的副作用和并发症,面对副作用和并发症带来的巨大痛苦,相当一部分病患不能坚持进行化疗,延误了治疗时机[4]。这两年随着医学技术逐渐发展,一些疾病的治疗技术不断在更新,乳腺癌的治疗手段也在发展,乳腺粗针穿刺活检逐渐应用于临床乳腺癌的诊断,并且临床数据显示其诊断效果较好,在逐渐取代细针穿刺细胞学,优点比较明显[5]。临床上采取化疗方法后雌激素受体(ER)、孕激素受体(PR)、人表皮生长因子受体2(HER2)状态有误差不宜采取。针对这种问题,本文选取2014年1月-2016年1月本院收治的未经化疗的乳腺浸润性导管癌根治术患者120例,探讨乳腺癌粗针穿刺与术后活检标本病理分级及免疫组化的差异。现报道如下。
1 资料与方法
1.1 一般资料 选取2014年1月-2016年1月本院收治的未经化疗的乳腺浸润性导管癌根治术患者120例,年龄29~73岁,平均(47.5±1.2)岁。纳入标准:经过西医和传统中医诊断,并均已通过病理切片和影像检查手段确诊;年龄≥25岁;对本文治疗无相关禁忌;卡氏功能状态评分(KPS)>70分;预计生存期>3个月。排除标准:心脏等脏器严重受损或者患有出血性相关病症的患者;已经采取过手术和放疗手段治疗过的乳腺癌患者;在本研究过程中出现感染,并且没有得到控制的患者;药物性过敏体质的患者。患者均知情同意本研究,并经过医院伦理委员会批准。
1.2 方法
1.2.1 病理检查和分级工作 (1)检测方法:手术前对患者进行粗针穿刺,获得病灶组织,将获得的组织放入甲醛溶液中,常规石蜡包埋,制备4 μm切片,对制备好的切片进行HE染色。(2)分级:乳腺癌患者诊断分级采取WH02012乳腺癌分级标准来进行,分级主要从以下三方面进行评估:腺管形成的程度、细胞核的多形性、核分裂计数[6]。
1.2.2 免疫组织化学 (1)检测方法:采用免疫组织化学法测定ER、PR、HER2、Ki67表达水平。取手术过程中的病灶组织,向不同组织中加入蒸馏水与浓度为30.0%的H2O2,常温下加入内源性酶并进行10 min灭活,PBS连续进行3次洗涤。将最终获得的切片放置在0.01 M枸橼酸盐缓冲液中,加入生理盐水控制溶液pH最终为6。电炉加热直到煮沸,间隔5 min后再次进行煮沸,常温下冷却,采用PBS完成2次洗涤,洗涤5 min/次,最后加入5%BSA封闭液并加入ER、PR、HER2、Ki67蛋白(稀释浓度为1∶100)一抗一滴。滴加完毕后进行3次PBS洗涤;在1 mL底物中加入ER、PR、HER2、Ki67蛋白二抗一滴,充分混合后常温下显色,苏木素复染后封片,倒置显微镜下观察细胞数量,每份标本测定三次,取平均值。(2)判断方法。参考奥尔雷德评分标准分别从细胞的阳性数量(1~4分)、染色强度(0~12分)完成免疫组化染色评分,总分16分,总分越高阳性率越高。
1.3 观察指标及判定标准 (1)粗针穿刺标本与手术切除标本病理分级。记录粗针穿刺标本与手术切除标本病理分级情况,分级标本参考WH02012乳腺癌分级标准进行[6]。(2)ER、PR、HER2、Ki67阳性率表达。记录粗针穿刺标本与手术切除标本ER、PR及HER2的阳性表达率。(3)Ki67蛋白表达。记录并统计粗针穿刺标本与手术切除标本Ki67表达情况,由于Ki67在乳腺癌组织中表达水平较低,研究中以20.0%为限进行分析,对于阳性率>20.0%者视为异常。
1.4 统计学处理 使用SPSS 18.0软件对所得数据进行统计分析,计数资料以率(%)表示,比较采用χ2检验;一致性采用Kappa检验,0~0.20极低的一致性、0.21~0.40一般的一致性、0.41~0.60中等的一致性、0.61~0.80高度的一致性和0.81~1.00几乎完全一致。以P<0.05为差异有统计学意义。
2 结果
2.1 粗针穿刺标本与手术切除标本病理分级比较 粗针穿刺标本检测病理分级与手术切除标本比较,一致性一般,差异无统计学意义(Kappa=0.38,P=0.04)。见表 1。
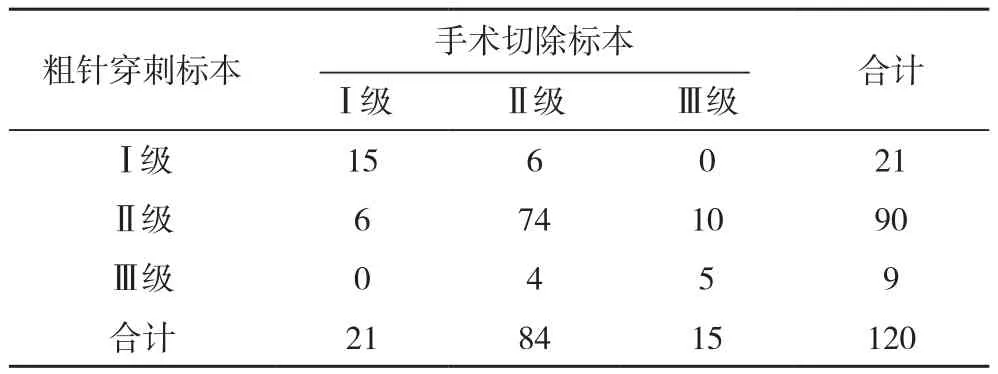
表1 粗针穿刺与手术切除标本病理分级的一致性分析 例
2.2 粗针穿刺与手术切除标本ER、PR及HER2的阳性表达率比较 粗针穿刺标本ER、PR及HER2蛋白阳性率与手术切除标本比较差异均无统计学意义(P>0.05),一致性均较高(Kappa=0.89、0.70、0.69,P=0.00、0.01、0.01)。见表 2。
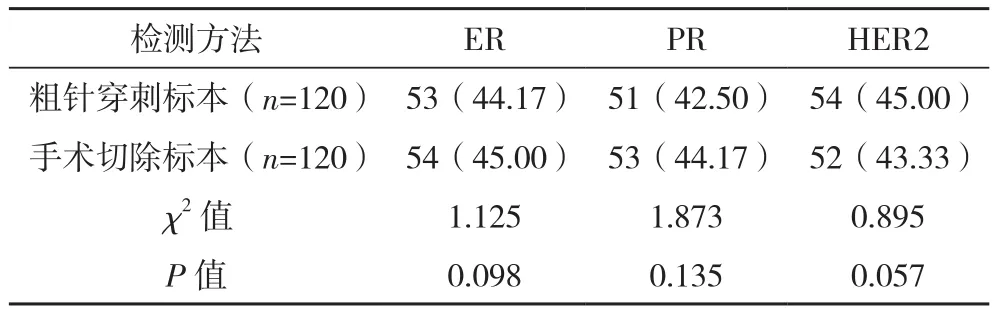
表2 粗针穿刺与手术切除标本ER、PR及HER2的阳性表达情况比较 例(%)
2.3 粗针穿刺标本与手术切除标本Ki67表达分析比较 120例乳腺癌患者中88例免疫组化检测呈阳性,阳性率为73.33%;两种检测方法的Ki67表达比较差异无统计学意义,一致性中等(Kappa=0.49,P=0.03)。见表 3。

表3 粗针穿刺标本与手术切除标本Ki67表达分析比较 例
3 讨论
随着医疗技术的逐渐发展,临床上对于癌症的治疗方法不断在更新,传统治疗癌症方法为化疗加放疗或者采用手术治疗方法,但这些治疗手段副作用大且治疗效果并不理想[8]。近几年,辅助性全身疗法逐渐应用于临床治疗癌症。特别对于乳腺癌患者,这种方法可以大大降低乳腺癌的复发率与死亡率,临床效果较好。一般乳腺癌患者为ER、PR均阳性患者,最佳治疗方法是调节内分泌,选择内分泌疗法[9]。但是对于HER2阳性患者,内分泌疗法并不适合,最佳治疗方法为曲妥单抗。还有一些ER阴性及HER2阳性患者,最好是采用传统治疗方法[10]。粗针穿刺活检临床诊断时精度相对较高,但是该诊断方法所需时间较长、可重复性较差,并且检查具有较高的风险性、创伤性,导致临床诊断依从性较差[11]。
对于恶性肿瘤的治疗一般是通过以下几个方面,一是能够有效控制肿瘤的产生和增长,进而致使癌细胞死亡[12];二是能够有效控制癌细胞转移,迟滞肿瘤生成,以此实现阻碍肿瘤生成和扩散的目的;三是提高人体免疫功能,全面提升病患免疫能力;四是减轻化疗副作用,特别对人体造成的骨髓抑制作用,增强细胞功能,提升病患白细胞数量[13];五是明显改善病患消化道功能,增强胃壁厚度,以此降低病患等不良反应[14-15]。
随着分子生物学的发展,目前对于癌症的治疗已经从原来的细胞水平逐渐发展到分子水平[16]。所以对乳腺癌患者的肿瘤进行分子水平分析是非常必要的,研究患者肿瘤的生物学特性可以作为临床指标进行检验。因为粗针穿刺活检越来越流行成为乳腺癌的首选诊断方法,进而其准确性逐渐在临床上倍加重视。从理论上说,粗针穿刺活检标本和手术标本肿瘤指标的不一致率应该较低。乳腺癌有明显的病理现象,例如泥沙样钙化,这种比例现象一般在X线下即可观察到,但是泥沙样钙化也存在良性肿瘤中[17]。一般情况下,泥沙样钙化具有一定特殊的形态,并且可以应用于诊断。一般的形态有圆圈状、原点状、条状以及片状,这样的形态清晰,一般都是良性肿瘤。而形态不清晰的混合性的肿瘤,就像出现条状、叉状同时具备的患者,几乎可以确诊为恶性肿瘤即乳腺癌[18]。
本文进行粗针穿刺标本与手术病理标本的病理分级及免疫组化分析,结果显示,粗针穿刺标本检测病理分级与手术切除标本比较差异无统计学意义(Kappa=0.38,P=0.04);粗针穿刺标本ER、PR及HER2蛋白阳性率与手术切除标本比较差异无统计学意义,一致性均较高(Kappa=0.89、0.70、0.69,P=0.00、0.01、0.01);120例乳腺癌患者中88例免疫组化检测呈阳性,阳性率为73.33%;两种检测方法的Ki67表达比较差异无统计学意义,一致性中等(Kappa=0.49,P=0.03)。该结果与文献[19]相符,而且医学研究显示,肿瘤特别是恶性肿瘤的产生、转移和人体免疫功能特别是细胞的免疫功能联系密切,在人体的诸多细胞中,淋巴系统细胞有着十分重要的作用[20],是人体的效应细胞和免疫监控的重要参与者。
综上所述,乳腺癌粗针穿刺与术后活检标本ER、PR、HER2检测的一致性均较高,但是乳腺癌粗针穿刺与术后活检标本病理分级和Ki67表达一致性相对较差,均需要进一步研究与探讨,临床应结合实际选择合适的方法。

