低盐发酵香肠用优良菌株的分离筛选及鉴定
张一凡,李昌辉,李平兰,张金兰,胡锦蓉,张 莹*
(中国农业大学食品科学与营养工程学院,北京食品营养与人类健康高精尖创新中心,北京 100083)
发酵香肠是指将绞碎的肉(常指猪肉或牛肉)和动物脂肪同糖、盐、发酵剂和香辛料等混合后灌进肠衣,经过微生物发酵而制成的具有稳定微生物特性和典型发酵香味,并且具有较长保质期的发酵肉制品[1]。肉制品发酵剂在发酵香肠生产过程中具有理想的代谢活性[2],能够产生有助于风味和产品发酵成熟所需的特殊酶系[3],有利于人体消化[4],且能够抑制腐败微生物的生长,延长产品货架期[5]。肉制品发酵剂的研究始于20世纪初,最早发现乳酸杆菌和过氧化氢酶阳性球菌混合发酵香肠的效果较好[6]。乳酸菌可以产生特殊酶系,有助于香肠风味的产生和发酵肉制品的成熟[7],降低香肠pH值,抑制腐败微生物的生长[8];而葡萄球菌属具有分解脂肪、蛋白质以及产生过氧化氢酶的活性[9],能够丰富发酵香肠的风味。因此,乳酸菌和非致病性葡萄球菌混合菌种发酵剂的研究和应用获得了快速发展。
近年来,肉制品发酵剂研究热点主要集中在两方面。一是对发酵肉制品成熟过程中风味物质形成有利的呈香菌的研究,如筛选肉制品中的优良产香葡萄球菌、戊糖片球菌等[10]。Yan Cheng等[11]研究自然风干过程中腐生葡萄球菌S25发酵的香肠与天然发酵(对照)四川香肠的脂肪和蛋白质含量变化,发现腐生葡萄球菌S25可以加速四川香肠中的蛋白质水解和脂肪分解;张晓琼等[12]从国内外发酵肉样品中分离筛选得到10 株性能优良的葡萄球菌菌株,并对其蛋白酶、脂肪酶、硝酸还原酶和过氧化氢酶活性以及其在高盐和亚硝酸盐环境中的生长情况进行测定。而另一个研究热点是能够提高发酵香肠卫生安全性的菌株,如产细菌素能力强、可抑制病原菌生长、提高发酵肉制品安全性的乳酸菌[13]。Kantachote等[14]以戊糖片球菌HN8和Lactobacillus namurensis NH2混合发酵剂制作泰国发酵猪肉香肠,结果表明,混合发酵剂可降低香肠中生物胺和胆固醇的含量;Ba等[15]利用从天然发酵肉中筛选出的植物乳杆菌制作发酵香肠,结果表明,接种植物乳杆菌的香肠腐败细菌数量和脂肪氧化水平显著降低。
食盐(NaCl)在传统西式香肠制品的加工中发挥着重要作用,决定着发酵香肠制品的感官质量和生物安全性[16]。食盐不但能够促进肌原纤维蛋白的溶解,增加蛋白质的结合特性,改善香肠质地,而且还能提高发酵香肠的微生物安全性[17]。但是传统西式香肠制品的盐分含量很高,约为8%[18],高于大部分肉制品,长期食用可能会对人体健康造成不利影响。近年来,随着消费者保健意识的增强,开发低盐西式发酵香肠将更为符合消费者的需求。但盐量的降低可能会对发酵香肠的质量安全和感官品质产生不利影响,因此需要定向筛选适用于低盐发酵香肠的优良菌种。
本研究旨在从我国传统自然发酵食品中分离出适用于低盐发酵香肠的优良葡萄球菌与乳酸菌菌株,并通过测定葡萄球菌菌株的溶血、耐硝耐酸、硝酸盐还原性和48 h产酸等发酵特性指标,以及产氨、蛋白酶、脂肪酶、产乙偶姻等风味指标,筛选出具有产香功能、可改善低盐对风味产生的不良影响的优良葡萄球菌菌株;通过测定对乳酸菌菌株的产接触酶、耐硝、48 h产酸等发酵特性指标,以及抑菌指标和产氨、产蛋白酶等风味指标,筛选出产酸快、抑菌能力强、可以在低盐的基础上保障香肠安全性的优良乳酸菌菌株。对筛选得到的优良葡萄球菌和乳酸菌菌株进行拮抗性实验,得到无拮抗作用的菌株组合,作为潜在开发肉制品发酵剂的出发菌株。最终筛选出的混合发酵剂可在保障安全性的同时改善低盐发酵香肠的风味,不但有利于低盐发酵香肠产品的开发,而且能够为我国自主产权发酵剂的研发提供理论依据。
1 材料与方法
1.1 材料与试剂
农家烟熏老腊肉、川味土猪腊肠 四川省阆中市蜀香坊特产腊味店;郭三酸菜 沈阳市成懿酱腌菜厂;欧力波兰萨拉米 北京利康德利肉食品有限公司;川味腊肉衡东县乡间农家腌腊制品食品有限公司;广味挂肠 北京家乐福中关村店;紫光园自制酸乳 北京紫光园饭店(西直门店);秦烹小院自制酸乳 北京秦烹小院;渔芙南湘菜馆自制酸乳 北京渔芙南湘菜馆;自制乳酸菌饮料 一口酸牛奶(北京鼓楼东大街店)。
MRS培养基、营养肉汤(NB)培养基、蛋白胨、牛肉膏、酵母浸膏 北京奥博星生物技术有限责任公司;MSA培养基 青岛高科技工业园海博生物技术有限公司;氯化钠、亚硝酸钠、硝酸钾、柠檬酸二铵、乙酸钠、碳酸钙(均为分析纯) 西陇化工股份有限公司;细菌基因组DNA提取试剂盒、2×Taq PCR MasterMix 天根生化科技有限公司。
1.2 仪器与设备
SE602F电子天平 奥豪斯仪器(上海)有限公司;YXQ-LS-SⅡ全自动立式电热压力蒸汽灭菌器 上海博迅医疗生物仪器股份有限公司;MQD-S3R恒温振荡箱上海旻泉仪器有限公司;DK-8B电热恒温水槽 上海精宏实验设备有限公司;SCL-1300垂直流洁净工作台 北京赛伯乐实验仪器有限公司;MINIB-100恒温金属浴杭州米欧仪器有限公司。
1.3 方法
1.3.1 菌株分离与纯化
无菌操作下称取10 g绞碎的样品,转移至100 mL无菌生理盐水中,振荡(200 r/m,30 min)混匀;静置数分钟,再取1 mL加入到9 mL无菌生理盐水中,即成10-2稀释度,根据需要再依次稀释;选取合适稀释度的样品溶液,倒入相应的固体培养基中,混匀后37 ℃静置培养24~48 h;挑取单菌落反复划线,直至获得纯的菌株。其中,乳酸菌的分离采用含有3% CaCO3的MRS固体培养基,挑取具有溶钙圈[19]的菌株;葡萄球菌的分离采用MSA固体培养基。
1.3.2 菌株的初步筛选
对纯化后的菌株进行革兰氏染色、菌体形态观察,选择革兰氏阳性菌种保存。对所分离的革兰氏阳性菌分别进行如下筛选:
接触酶实验[20]:将37 ℃培养过夜后的菌液用接种环涂抹于已滴有5% H2O2的玻片上,立即观察结果,3 min内出现气泡者为阳性反应,反之为阴性。
耐硝性实验[21]:以1%的接种量将菌种分别接种于不同亚硝酸钠添加量(0、50、100、150 mg/kg)的液体培养基中,37 ℃培养48 h,于600 nm波长处测定吸光度。
产酸能力测定[21]:以1%接种量将菌株接种于液体培养基中,37 ℃培养24 、48 h后测定发酵液的pH值。
对于所分离的阳性球菌菌株,分别进行如下额外指标的筛选:
耐酸性实验[21]:以1%的接种量将菌种分别接种于NB液体培养基(pH值调至5.0)中,37 ℃培养48 h,于600 nm波长处测定吸光度。
溶血实验[22]:用接种针取37 ℃培养过夜后的菌液,在血平板上划线,37 ℃培养24、48、72 h后观察结果,有溶血圈出现的菌株为阳性,以金黄色葡萄球菌作为阳性对照。
硝酸盐还原酶活力测定[23]:检查37 ℃培养过夜后菌液的硝酸盐还原情况,在白色搪瓷比色盘中加入1 滴菌液,然后加入硝酸还原试剂A、B液各1 滴,观察菌落周围出现的红圈大小和清晰度,显色反应后,挑出红圈直径>1.2 cm的菌株。
1.3.3 菌株的复筛
对初步筛选所得到的葡萄球菌及乳酸菌菌株进行进一步的筛选:
蛋白酶活性检测[21]:将37 ℃培养过夜后的新鲜菌液分别点接种在脱脂牛乳平板培养基(SM)上,培养5 d。观察菌落周围透明圈的大小。
氨基酸脱羧酶实验[24]:将37 ℃培养过夜后的菌液倾注到氨基酸脱羧酶检测培养基(分别含有0.5%酪氨酸、0.25%组氨酸、赖氨酸及精氨酸,以不添加氨基酸作为空白对照)中,37 ℃培养,变色则为阳性。
精氨酸双水解酶实验[25]:将37 ℃培养过夜后的菌液倾注到精氨酸双水解酶检测培养基(含有1% L-精氨酸盐)中,37 ℃培养,培养基转化为红色者为阳性。
对于初步筛选得到的葡萄球菌菌株,分别进行如下额外指标的筛选:
脂肪酶活性检测[21]:将37 ℃培养过夜后的新鲜菌液分别点接种在三丁酸甘油酯培养基(TB)上,培养5 d,观察菌落周围透明圈。
乙偶姻产生实验[25]:接种葡萄球菌菌株于乙偶姻检测培养基,取培养液和40% NaOH等量混合。加少许肌酸,如果培养液10 min出现红色即为阳性反应。
对于所分离的乳酸菌菌株,进行抑菌实验[26]作为额外的筛选指标:将乳酸菌菌株培养至约为108CFU/mL,点接种于已含有106CFU/mL的敏感指示菌(大肠杆菌、金黄色葡萄球菌、单增李斯特菌以及蜡样芽孢杆菌)的固体平板上,37 ℃培养12 h,观察菌落周围是否存在抑菌圈。
1.3.4 菌株的分类学鉴定
形态学观察:将菌株平板划线于固体培养基上,观察菌落形态,挑取对数生长期的菌体进行革兰氏染色后显微镜下观察菌体细胞形态。
生理生化实验:参照《乳酸细菌现代研究实验技术》[20]及《常见细菌系统鉴定手册》[25]对筛选菌株的生理生化特性进行检测,包括精氨酸双水解酶实验、糖醇发酵实验等。
16S rDNA分子生物学鉴定:细菌基因组DNA按照试剂盒说明书步骤进行提取。以提取基因组作为PCR扩增的模板,利用通用引物Lpw57(5’-AGT TTG ATC CTG GCT CAG-3’)及Lpw205(5’-CTT GTT ACG ACT TCA CCC-3’)进行PCR扩增[27]。PCR反应体系(25 μL)为:10×Buffer 2.5 μL、模板DNA 1 μL、引物各2.5 μL、dNTP 2 μL、Taq DNA聚合酶0.25 μL、dd H2O 14.25 μL,混匀5 min。PCR反应条件:94 ℃预变性5 min,94 ℃ 1 min、43 ℃ 30 s、72 ℃ 90 s,进行30 个循环,最后72 ℃延伸10 min[28]。PCR产物经琼脂糖电泳分析后由北京诺赛基因组研究中心测序。
系统发育树的构建:所得菌株序列根据NCBI网站(https://www.ncbi.nlm.nih.gov/)的BLAST程序在GenBank数据库中进行比对鉴定,根据鉴定结果及相似性较高的几株菌的16S rRNA,利用MEGA软件进行菌株系统发育树的构建。
1.3.5 菌株的生长特性及产酸能力测定
将菌株接种于相应的液体培养基,37 ℃培养(葡萄球菌接种在NB液体培养基中200 r/min振荡培养,乳酸菌接种在MRS液体培养基中静置培养),以液体培养基为空白对照,每2 h用紫外分光光度计于600 nm波长处测定吸光度,用酸度计测定菌液的pH值。
1.3.6 菌株间拮抗性测试
用含乳酸菌的接种环,在低盐模拟肉汤固体培养基[29](NaCl质量分数2%)上划一直线接菌。37 ℃条件下培养48 h,待形成菌落后,沿菌落边缘(不接触)用接种环从垂直方向接种葡萄球菌;37 ℃条件下培养24 h,观察乳酸菌对于葡萄球菌的抑制效果。
1.4 数据处理
所有实验均重复进行3 次,使用SPSS 17.0软件对数据进行统计和方差分析,使用Excel软件对数据进行分析及作图。
2 结果与分析
2.1 优良葡萄球菌菌株初筛结果
从5 种自然发酵食品中分离出平板培养形态不同的疑似菌株共56 株,其中6 株来自川味腊肉,4 株来自欧力波兰萨拉米,1 株来自广味挂肠,15 株来自农家烟熏老腊肉,30 株来自川味土猪腊肠。从疑似菌株中筛选出革兰氏阳性球菌、接触酶阳性菌39 株,初步判定为葡萄球菌。
对所得的39 株菌株的安全性进行溶血实验,结果表明,39 株菌均为溶血实验阴性,说明分离的球菌均具有安全性。39 株菌株中,所有菌株均可耐受50、100 mg/kg NaNO2,仅2 株球菌对150 mg/kg NaNO2不耐受;其中34 株菌具有硝酸盐还原酶,且其中的23 株可耐受pH 5.0的酸度,经过初筛,得到发酵特性良好的优良葡萄球菌23 株,作为下一步复筛的出发菌株。其中菌株L1、L2、L3来自川味腊肉,R1、R2、R3来自欧力波兰萨拉米,Z7、Z9、Z10、Z12来自农家烟熏老腊肉,C6、C7、C8、C10、C11、C16、C17、C23、C24、C25、C26、C29、C30来自川味土猪腊肠。
2.2 优良葡萄球菌菌株复筛结果

表1 葡萄球菌菌株复筛结果Table 1 Secondary screening of Staphylocooccccuuss s t raaiinnss
对初筛所得的23 株葡萄球菌进行复筛,由表1可知,其中有17 株菌既不产氨基酸脱羧酶,也不产精氨酸双水解酶,这17 株菌中有15 株菌具有脂肪酶活性,14 株菌具有蛋白酶活性,而既产蛋白酶又产脂肪酶的菌株有12 株,其中有3 株产乙偶姻。因此,最终筛选出3 株具有优良风味特性的葡萄球菌,它们分别为筛选自川味腊肉的L2、筛选自欧力波兰萨拉米的R2以及筛选自农家烟熏老腊肉的Z9。
2.3 优良乳酸菌菌株初筛结果
从6 种自然发酵食品中分离出的平板培养形态不同的疑似菌共52 株,其中25 株来自郭三酸菜,7 株来自欧力波兰萨拉米,5 株来自北京紫光园自制酸乳,4 株来自秦烹小院自制酸乳,7 株来自渔夫南湘菜馆自制酸乳,3 株来自一口酸牛奶(鼓楼东大街店)的自制乳酸菌饮料。从疑似菌株中筛选出具溶钙圈的革兰氏阳性、接触酶阴性乳酸菌30 株。
所得30 株乳酸菌菌株中,所有菌株均可耐受50、100 mg/kg NaNO2,其中有28 株菌可耐受150 mg/kg亚硝酸盐。不同菌株的产酸情况差异较大,部分产酸较快菌株在MRS培养基中培养24 h,pH值可达3.67,其中21 株菌的pH值可在24 h内降至3.70~3.90,产酸效果较好。经过初筛,得到发酵特性良好的优良乳酸菌21 株,作为下一步复筛的出发菌株。其中菌株P1、P2、P4、P5、P6、P8、P9、P12、P15、P19、P20、P21来自于郭三酸菜,S1来自于欧力波兰萨拉米,SN1-1、SN1-2、SN1-3、SN1-5来自于北京紫光园自制酸乳,SN2-6、SN2-7、SN2-8来自于秦烹小院自制酸乳,X来自于一口酸牛奶自制乳酸菌饮料。
2.4 优良乳酸菌菌株复筛结果
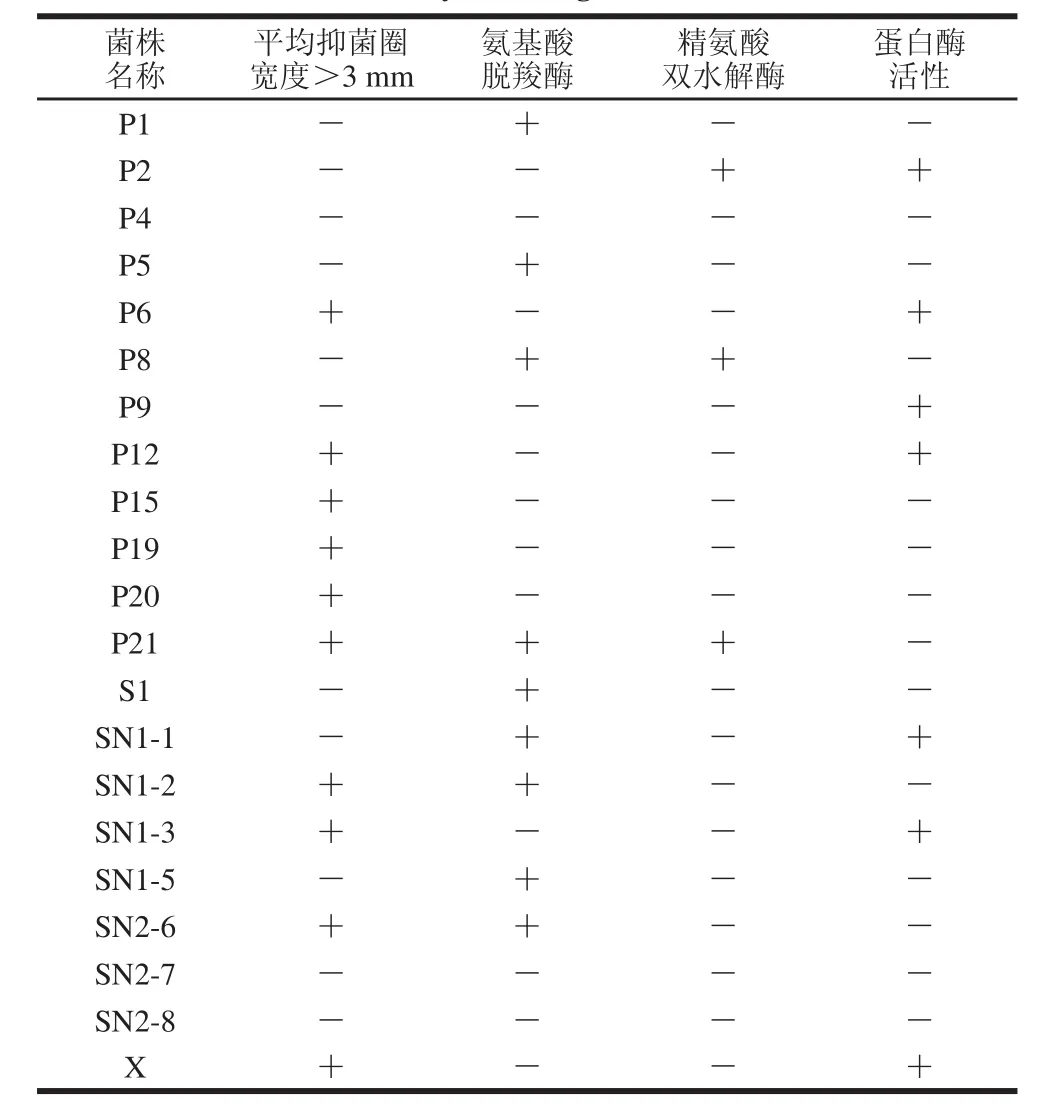
表2 乳酸菌菌株复筛结果Table 2 Secondary screening of lactic acid bacteria
对初筛所得的21 株乳酸菌进行复筛,经过抑菌实验,所有菌株均对大肠埃希氏菌、金黄色葡萄球菌、单增李斯特菌、蜡样芽胞杆菌有抑制作用。由表2可知,根据抑菌圈的大小,其中10 株乳酸菌的抑菌作用最强(抑菌圈平均宽度大于3 mm)。在进行复筛的21 株菌中,氨基酸脱羧酶阴性的菌株有12 株,精氨酸双水解酶阴性的菌株有18 株,具有蛋白酶活性有7 株。因此,最终筛选出4 株兼具多种优良特性的乳酸菌菌株,分别为筛选自郭三酸菜的P6与P12、筛选自北京紫光园自制酸乳的SN1-3以及筛选自一口酸牛奶自制乳酸菌饮料的X。
2.5 菌株的分类学鉴定结果
2.5.1 菌株形态学鉴定结果

图1 葡萄球菌菌落形态特征Fig. 1 Colony characteristics of Staphylococcus
由图1可知,葡萄球菌菌株L2、R2及Z9在NB固体培养基上37 ℃培养24 h,菌落直径约1~2 mm,菌落形态均呈白色圆形,不透明,形状规则,其中L2、R2菌落光滑、湿润、呈凸起状,Z9菌落边缘粗糙,质地干燥且菌落比较扁平。

图2 葡萄球菌菌体形态学特征(×1 000)Fig. 2 Morphological characteristics of Staphylococcus (×1 000)
由图2可知,经革兰氏染色后在显微镜下观察,葡萄球菌菌株L2、R2及Z9的菌体细胞均为圆球形,革兰氏阳性,其中菌株L2部分成对生长,菌株R2单个生长,菌株Z9呈不规则堆状排列。


图3 乳酸菌菌落形态特征Fig. 3 Colony characteristics of lactic acid bacteria
由图3可知,乳酸菌菌株P6、P12、SN1-3及X在MRS固体培养基上37 ℃培养24 h,菌落直径约1~2 mm,菌落形态均为白色圆形,菌落表面光滑,湿润凸起,边缘规则,其中X菌落呈半透明状,P6、P12、SN1-3菌落均不透明。
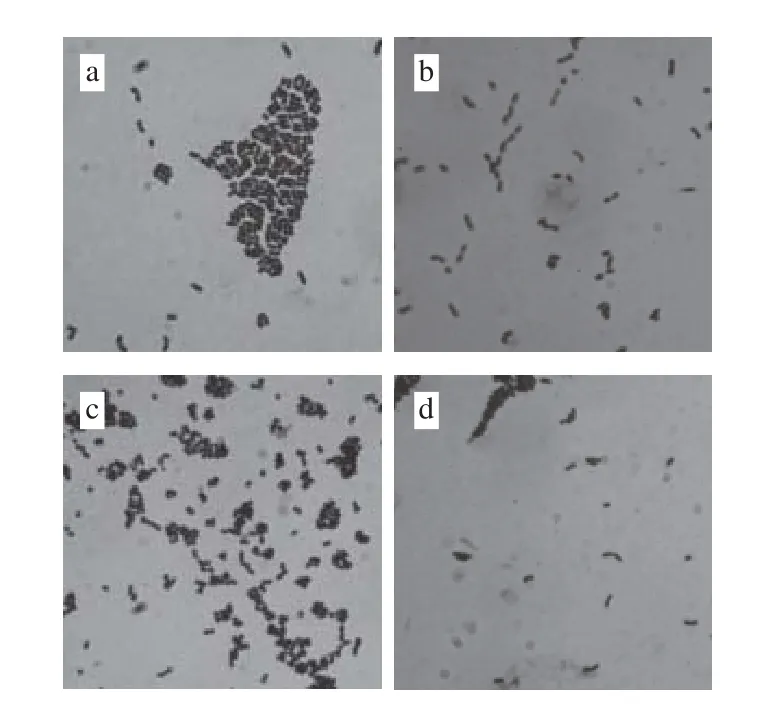
图4 乳酸菌菌体形态学特征(×1 000)Fig. 4 Morphological characteristics of lactic acid bacteria (×1 000)
由图4可知,经革兰氏染色后在显微镜下观察,乳酸菌菌株P6细胞成对或成短链,革兰氏阳性,粗短杆状;菌株P12成对或成短链,为革兰氏阳性短杆菌;菌株SN1-3细胞部分以直二个方向形成四联排列,为革兰氏阳性球菌;菌株X成对或成短链,为革兰氏阳性杆菌。
2.5.2 菌株生理生化实验鉴定结果

表3 葡萄球?菌菌株生理生化实验结果Table 3 Physiological and biochemical characteristics of Staphylocooccccuuss
由表3可知,参考《常见细菌系统鉴定手册》[25],根据葡萄球菌生理生化鉴定结果,初步推断葡萄球菌菌株L2、Z9为腐生葡萄球菌,R2为肉葡萄球菌。

表4 乳酸菌菌株生理生化实验结果Table 4 Physiological and biochemical characteristics of lactic acid bacteria
由表4可知,参考《常见细菌系统鉴定手册》[25]和《乳酸细菌现代研究实验技术》[20],根据乳酸菌菌株的生理生化鉴定结果,初步推断乳酸菌菌株P6、P12为植物乳杆菌或鼠李糖乳杆菌、X为干酪乳杆菌、SN1-3为戊糖片球菌。
2.5.3 菌株的16S rDNA分子生物学鉴定结果

图5 菌株16S rDNA的PCR扩增产物电泳图Fig. 5 Electrophoresis of PCR products 16S rDNA gene from strains
由图5可知,对菌株的16S rDNA序列采用通用引物进行扩增后,在1 000~2 000 bp之间可见到清晰明亮的条带,大小约为1 500 bp。
利用NCBI网站的BLAST程序对菌株16S rDNA测序结果在GenBank已知序列数据库中进行对比分析。结果表明:葡萄球菌菌株L2、Z9与腐生葡萄球菌(Staphylococcus saprophyticus)具有最高同源性,葡萄球菌菌株R2与肉葡萄球菌(Staphylococcus carnosus)具有最高同源性;乳酸菌菌株P6、P12与植物乳杆菌(Lactobacillus plantarum)具有最高同源性,乳酸菌菌株X与干酪乳杆菌(Lactobacillus casei)具有最高同源性,乳酸菌菌株SN1-3与戊糖片球菌(Pediococcus pentosaceus)具有最高同源性。选取与GenBank中相似性较高菌株的序列,利用MEGA 6.0软件进行系统发育树的构建,结果如图6~8所示。
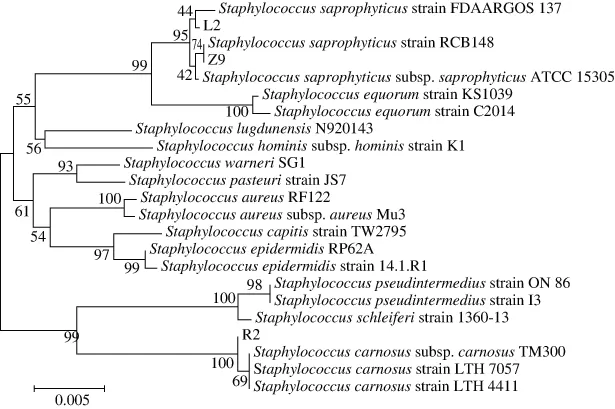
图6 葡萄球菌菌株L2、R2、Z9的系统发育树Fig. 6 Neighbour-joining tree of Staphylococcus L2, R2 and Z9


图8 乳酸菌菌株SN1-3的系统发育树Fig. 8 Neighbour-joining tree of Lactobacillus SN1-3
综合生理生化及分子生物学鉴定,结果表明,葡萄球菌菌株L2、Z9为腐生葡萄球菌,葡萄球菌菌株R2为肉葡萄球菌;乳酸菌菌株P6、P12为植物乳杆菌,菌株X为干酪乳杆菌,SN1-3为戊糖片球菌。
2.6 菌株的生长特性及产酸能力
本研究测定了筛选出的3 株葡萄球菌及4株乳酸菌的在培养过程中的生长情况及培养基的pH值变化,并绘制曲线。

图9 不同葡萄球菌的生长曲线及产酸能力( =3)Fig. 9 Growth curve and acid production of Staphylococcus (n = 3)
由图9可知,葡萄球菌L2、Z9和R2均能在NB液体培养基中生长且长势良好,这3 株菌的生长速率和生长曲线的趋势非常相似,生长调整期均较短,12 h后进入生长稳定期,菌数达到最大值。此外,这3 株菌的pH值变化也非常相似,均随培养时间的增加呈上升趋势,在24 h后趋势均逐渐平缓,与生长曲线趋势大体一致。
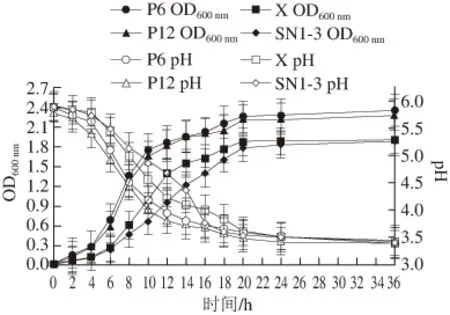
图10 不同乳酸菌的生长曲线及产酸能力(n==44)Fig. 10 Growth curve and acid production of lactic acid bacteria (n = 4)
由图10可知,乳酸菌P6、P12、X及SN1-3均能在MRS液体培养基中生长且长势良好,但生长速率存在差异。乳酸菌P6、P12的生长速率较快,生长调整期较短,约为0~2 h,16 h后进入生长稳定期,菌数达到最大值。而菌株X与SN1-3生长速率较慢,生长调整期略长,约为0~4 h,20 h后才达到生长稳定期。此外,这4 株菌产酸较快,0~12 h内pH值下降迅速,36 h后均达到3.5以下,产酸能力较强。但4 株菌的产酸速率存在差异,菌株P6、P12产酸最快,而菌株SN1-3相对较慢。
2.7 菌株间的拮抗作用

表5 菌株间拮抗性测试结果Table 5 Compatibility test among antagonistic strains
由表5可知,戊糖片球菌SN1-3对于3 种葡萄球菌的拮抗作用最微弱,对肉葡萄球菌R2无明显拮抗作用;而植物乳杆菌P6、P12对于3 种葡萄球菌的拮抗作用最强,对腐生葡萄球菌Z9具有非常强的抑制作用,若复配使用非常不利于葡萄球菌的生长。因此,经菌株间拮抗实验的结果,选择戊糖片球菌SN1-3与肉葡萄球菌R2作为最终制作低盐发酵香肠的复配菌株。
3 结 论
国内肉类科技界在产品加工过程中在质量与特性变化、加工用发酵剂菌种选育、配制等方面开展了大量工作,但是关于低盐发酵香肠的工艺研究和菌株选育方面的研究较少。因此,定向从我国自然发酵制品中筛选利于低盐西式发酵香肠制品生产与开发的适应性优良菌种,不但可以利用我国丰富的菌种资源,还能够为我国低盐发酵香肠产品的研发提供重要的理论依据。
本研究从腊肉、四川香肠、萨拉米等5 种自然发酵制品中分离、纯化得到56 株过氧化氢酶阳性球菌菌株。通过菌株耐受性、发酵特性、风味特性等指标对所分离的56 株过氧化氢酶阳性菌株进行筛选,最后筛选得到腐生葡萄球菌L2、肉葡萄球菌R2以及腐生葡萄球菌Z9为适用于低盐发酵香肠、具有优良产香特性的葡萄球菌菌株。其中L2来自川味腊肉,R2来自萨拉米,Z9来自农家烟熏老腊肉,它们均可以耐受150 mg/kg的NaNO2和较低的酸度,并且具有硝酸盐还原能力。菌株均不产生氨基酸脱羧酶和精氨酸双水解酶,具有一定的蛋白酶和脂肪酶活性,还可以产生风味物质乙偶姻,具有优良的产香特性。
本研究还通过菌株耐受性、发酵特性、抑菌特性、风味特性等指标对分离自泡菜、自酿酸乳、乳酸菌饮料等6 种自然发酵制品中的52 株乳酸菌菌株进行筛选,最终筛选得到植物乳杆菌P6、植物乳杆菌P12、干酪乳杆菌X以及戊糖片球菌SN1-3 4 株适用于低盐发酵香肠的优良乳酸菌菌株。其中,菌株P6、P12来自酸菜,SN1-3来自酸乳,X来自乳酸菌饮料。4 株菌均可耐受150 mg/kg的NaNO2,具有很好的发酵特性,产酸速度快,产酸能力强,不含有氨基酸脱羧酶和精氨酸双水解酶,可以抑制金黄色葡萄球菌、大肠杆菌、单增李斯特菌、蜡样芽胞杆菌等食源性致病菌,并且具有较好的蛋白酶活性,有利于保障低盐发酵香肠的安全性及风味。
葡萄球菌与乳酸菌复配作为香肠发酵剂,可以在产香的同时保证低盐发酵香肠的安全性,但是乳酸菌产生的细菌素以及乳酸会对葡萄球菌的生长造成不利影响,因此混合发酵剂的筛选必须考虑到菌株间的拮抗作用。本研究经过葡萄球菌与乳酸菌的拮抗实验,发现戊糖片球菌SN1-3和肉葡萄球菌R2之间无明显的拮抗作用,可以用于香肠混合发酵剂的开发。因此,后续实验也将进一步利用SN1-3+R2复配组合制作低盐发酵香肠,考察其混合发酵的效果,为我国自主产权低盐发酵香肠混合发酵剂的研究和开发提供参考。

