题变万千 理源课本
——含铬化合物的考题分析
朱怀义
(江苏省睢宁高级中学北校 221200)
高考对化学反应原理和元素及其化合物都及其重视,考题年年姿态万千,但解题道理都源自课本.应试时,许多考生无从落笔的原因,是对教材基本原理没有理解清楚,下面以对含铬化合物的考题分析为例,做简单阐释.
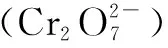

元素和化合物知识是基本概念、基本理论、基本方法、基本能力的考查载体.虽然教材并没有浓墨重彩地介绍元素铬及其化合物,但对其考查却日渐凸显.下面围绕考题加以简单分析.
一、氧化还原反应原理的考查
考题1 (2016·北京10) K2Cr2O7溶液中存在平衡:
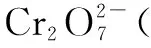
用K2Cr2O7溶液进行下列实验:

结合实验,下列说法不正确的是( ).
A.①中溶液橙色加深,③中溶液变黄

C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色

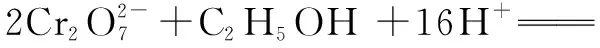
4Cr3++2CO2↑ +11H2O
当然,C2H5OH被氧化的产物也可能是CH3CHO或CH3COOH,CO2是其彻底、完全氧化的产物.在近年高考命题中,也常通过酸性KMnO4溶液与H2C2O4、KHC2O4、K2C2O4反应对氧化还原反应原理进行考查;需要提醒的是,化学反应实质一样,但离子方程式系数相应有变化.答案D.
二、电解原理的考查

考题2 (2012·浙江10)以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意如图.下列说法不正确的是( ).
A.在阴极室,发生的电极反应为:

B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡
向右移动
C.该制备过程总反应的化学方程式为:

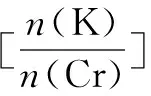

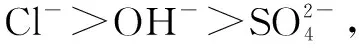
三、化学平衡移动与平衡规律的考查
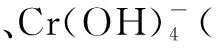
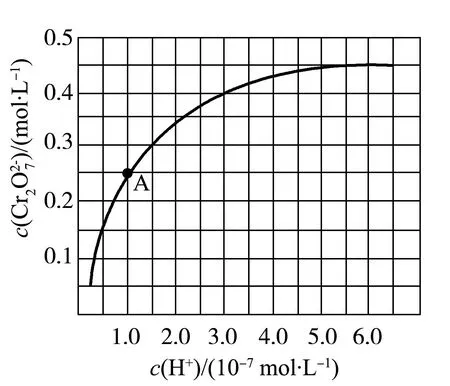
(1) Cr3+与Al3+的化学性质相似.在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是____.
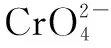
①用离子方程式表示Na2CrO4溶液中的转化反应____.

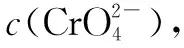

四、难溶性物质溶解平衡的计算
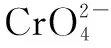


已知测定过程中发生的反应如下:

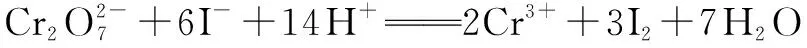


1 6
0.015×20×10-3÷6 0.015×20×10-3=0.05×10-3
高考非常倚重通过“滴定操作”考查学生的基本实验和计算能力.滴定通常有三种情形:一是非氧化还原型的酸碱中和滴定,二是氧化还原型如考题5,三是沉淀滴定型如考题4.除通过关系式,计算相关物质微粒浓度外,对终点指示剂的选择及滴定终点现象的表述也常被考到,考题4、5对此做了很好的诠释.

