“溶液中的粒子浓度关系”大扫描
张新中
(江苏省邗江中学 225009)
溶液中的粒子浓度关系是高考的热点内容,也是必考内容.在传统考查方式的基础上,近年来又出现了一些新的考查方式,应引起我们的重视.归纳起来,溶液中的粒子浓度关系主要有以下几种考查方式:
一、不同电解质溶液中的同一粒子浓度关系
例1 下列比较中正确的是( ).

B.相同pH的溶液:①NaClO溶液、②NaHCO3溶液、③CH3COONa溶液中,c(Na+):③>②>①
C.同浓度、同体积的溶液:①CH3COONa溶液、②C6H5ONa溶液、③NaNO3溶液中,离子总数:②>①>③
D.相同浓度的溶液:①氨水、②NaOH溶液、③Ba(OH)2溶液,c(H+):③>②>①

B项,相同温度、相同浓度的三种酸的强弱顺序:CH3COOH>H2CO3>HClO,根据盐类水解规律,相同温度、相同浓度的三种盐溶液的碱性:NaClO>NaHCO3>CH3COONa,所以,相同pH的溶液中Na+浓度大小顺序为③>②>①,正确.
D项,氨水是弱碱溶液,NaOH是一元强碱,Ba(OH)2是二元强碱,故相同浓度的溶液,碱性即c(OH-):③>②>①,故c(H+):①>②>③,错误.
答案:B
点拨(1)盐对应的酸应为盐中的阴离子加上1个H+所得部分,故其可能是酸也可能是酸式酸根离子.(2)在比较不同溶液中同种易水解的离子时,应先根据物质中所含的该离子数目进行分类,然后根据另一种离子对该离子水解的影响进行判断.
二、同一电解质溶液中的不同粒子浓度关系
例2 常温下,下列溶液中的微粒浓度关系正确的是( ).

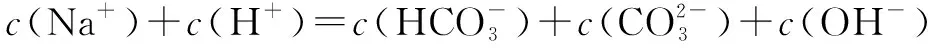
C.在NH4Cl溶液中一定有:c(H+)=c(NH3·H2O)+c(OH-)
D.在CH3COONa溶液中一定有:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
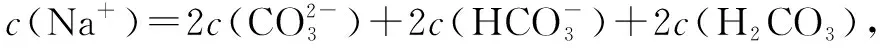
C项,氯化铵溶液中存在质子守恒,故有:c(H+)=c(NH3·H2O)+c(OH-),正确.
D项,在CH3COONa溶液中醋酸根离子水解溶液显碱性,故有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),错误.
答案:C
点拨判断同一电解质溶液中不同粒子的浓度关系时,首先要弄清溶液中存在哪些电离或水解,最后根据电离或水解情况以及守恒规律理解各种离子之间的关系.电解质溶液中微粒浓度大小比较要抓住两个平衡:电离平衡和盐类的水解平衡;抓两个微弱:弱电解质的电离和盐类的水解是微弱的,正确判断溶液的酸碱性,进行比较.
三、不存在反应的混合溶液中的粒子浓度关系
例3 用物质的量都是0.1 mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中c(CH3COO-)>c(Na+),对该混合溶液的下列判断正确的是( ).
A.c(H+)>c(OH-)
B.c(CH3COOH)+c(CH3COO-)=0.2 mol·L-1
C.c(CH3COOH)>c(CH3COO-)
D.c(CH3COO-)+c(OH-)=0.2 mol·L-1
解析A项,根据电荷守恒c(CH3COO-)+c(OH-)=c(H+)+c(Na+)可知,当c(CH3COO-)>c(Na+),则c(H+)>c(OH-),正确.
B项,由题给数据可知,c(CH3COOH)+c(CH3COO-)=(0.1 mol+0.1 mol)/1 L=0.2 mol·L-1,正确.
C项,CH3COOH电离呈酸性,CH3COO-水解呈碱性,而由A可知,c(H+)>c(OH-),说明CH3COOH的电离程度大于CH3COO-的水解程度,故c(CH3COOH) D项,c(OH-) 答案:A、B 点拨不存在反应的混合溶液中通常既存在弱酸或弱碱的电离,也存在这些弱酸或弱碱对应的盐的离子的水解,此时应根据题给信息,运用电荷守恒或其它知识确定电离程度与水解程度的大小,再根据物料守恒等知识进行逐项判断. 例4 25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( ). A.pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) B.0.1 mol·L-1CH3COONa溶液与0.1 mol·L-1CH3COOH溶液等体积混合(pH=4.75):c(CH3COO-)+c(CH3COOH)=c(Na+) C.0.1 mol·L-1CH3COONa溶液与0.1 mol·L-1HCl溶液混合至pH=7:c(Na+)>c(Cl-)=c(CH3COOH)>c(CH3COO-) 解析A项,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合,醋酸剩余,溶液显示酸性,c(H+)>c(OH-),错误. B项,溶液中存在物料守恒:c(CH3COO-)+c(CH3COOH)=2c(Na+),错误. C项,由电荷守恒得:c(Na+)+c(H+)=c(OH-)+c(Cl-)+c(CH3COO-),由于pH=7,则有c(H+)=c(OH-),故c(Na+)=c(Cl-)+c(CH3COO-),则c(Na+)>c(Cl-),由物料守恒得:c(Na+)=c(CH3COOH)+c(CH3COO-),故c(Cl-)=c(CH3COOH),此时的溶液中生成的醋酸的电离程度与剩余醋酸钠的水解程度一样,即c(Na+)=c(CH3COO-),错误. 答案:D 点拨对于存在反应的混合溶液,要巧抓“四点”,突破“粒子”浓度关系:(1)抓反应“一半”点,判断是什么溶质的等量混合;(2)抓“恰好”反应点,生成什么溶质,溶液的酸碱性,是什么因素造成的;(3)抓溶液“中性”点,生成什么溶质,哪种反应物过量或不足;(4)抓反应“过量”点,溶质是什么,判断谁多、谁少还是等量. 例5 在常温下,0.1000mol·L-1Na2CO3溶液25 mL用0.1000 mol·L-1盐酸滴定,滴定曲线如图.对滴定过程中所得溶液中相关离子浓度间的关系,下列说法正确的是( ). 答案:BD 点拨在解答此类题时,首先应弄清图像中横坐标与纵坐标的意义,其次应明确曲线的变化趋势,分析判断各区间段的溶质,最后根据水解规律和三大守恒确定粒子之间的关系. 答案:B 点拨溶液中组成微粒相同时,电荷守恒一定相同,物料守恒应根据反应物的量进行判断;选项中若有等式或几种微粒之和时,则需考虑电荷守恒、物料守恒、质子守恒. 例7 室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如见下表. 实验编号起始浓度/(mol·L-1)c(HA)c(KOH)反应后溶液的pH①0.10.19②x0.27 下列判断不正确的是( ). A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+) C.实验②反应后的溶液中:c(A-)+c(HA)>0.1mol·L-1 D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+) 解析A项,表中①的数据说明HA为弱酸,由此说明表中②的x>0.2;实验①反应后恰好生成KA,少量A-发生水解,则该溶液中c(K+)>c(A-)>c(OH-)>c(H+),正确. B项,据电荷守恒得c(K+)+c(H+)=c(A-)+c(OH-),则c(OH-)=c(K+)-c(A-)+c(H+),错误. C项,由于x>0.2,当一元酸HA的溶液和KOH溶液等体积混合,据物料守恒得c(A-)+c(HA)>0.1mol·L-1,正确. D项,实验②反应后的溶液中除了有KA,还有过量的HA,再据电荷守恒得:c(K+)=c(A-)>c(OH-)=c(H+),正确. 答案:B 点拨本题中根据题给数据确定HA的酸性强弱未是解题的关键. 例8 向1L含0.01mol NaAlO2和0.02mol NaOH的溶液中缓慢通入二氧化碳,随n(CO2)增大,先后发生三个不同的反应,当0.01mol 下列对应关系正确的是( ). 选项n(CO2)/mol溶液中离子的物质的量浓度A0c(Na+)>c(AlO-2)+c(OH-)B0.01c(Na+)>c(AlO-2)>c(OH-)>c(CO2-3)C0.015c(Na+)>c(HCO-3)>c(CO2-3)>c(OH-)D0.03c(Na+)>c(HCO-3)>c(OH-)>c(H+) 解析向1 L含0.01 mol NaAlO2和0.02 mol NaOH的溶液中缓慢通入二氧化碳,首先进行的反应为氢氧化钠和二氧化碳反应生成碳酸钠和水,0.02 mol氢氧化钠消耗0.01 mol二氧化碳,生成0.01 mol碳酸钠;然后偏铝酸钠和二氧化碳反应生成氢氧化铝和碳酸钠,0.01 mol偏铝酸钠消耗0.005 mol二氧化碳,生成0.005 mol碳酸钠;再通入二氧化碳,二氧化碳和碳酸钠反应生成碳酸氢钠,消耗0.015 mol二氧化碳,生成0.03 mol碳酸氢钠. 答案:D 点拨本题将元素化合物知识与电解质溶液中离子浓度大小比较综合在一起考查,熟练掌握相关元素化合物知识、理清反应过程,结合相关物质的用量正确判断相关选项中溶液的成分是解题的关键.四、存在简单反应的混合溶液中的粒子浓度关系
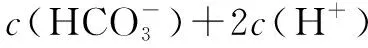

五、中和滴定图像中的粒子浓度关系

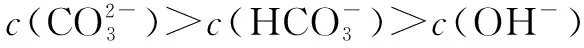
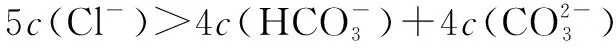
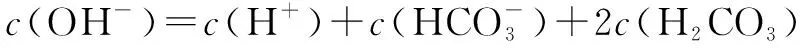
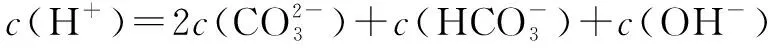

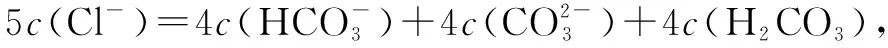
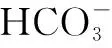

六、组成微粒相同溶液中的粒子浓度关系
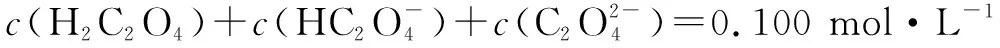
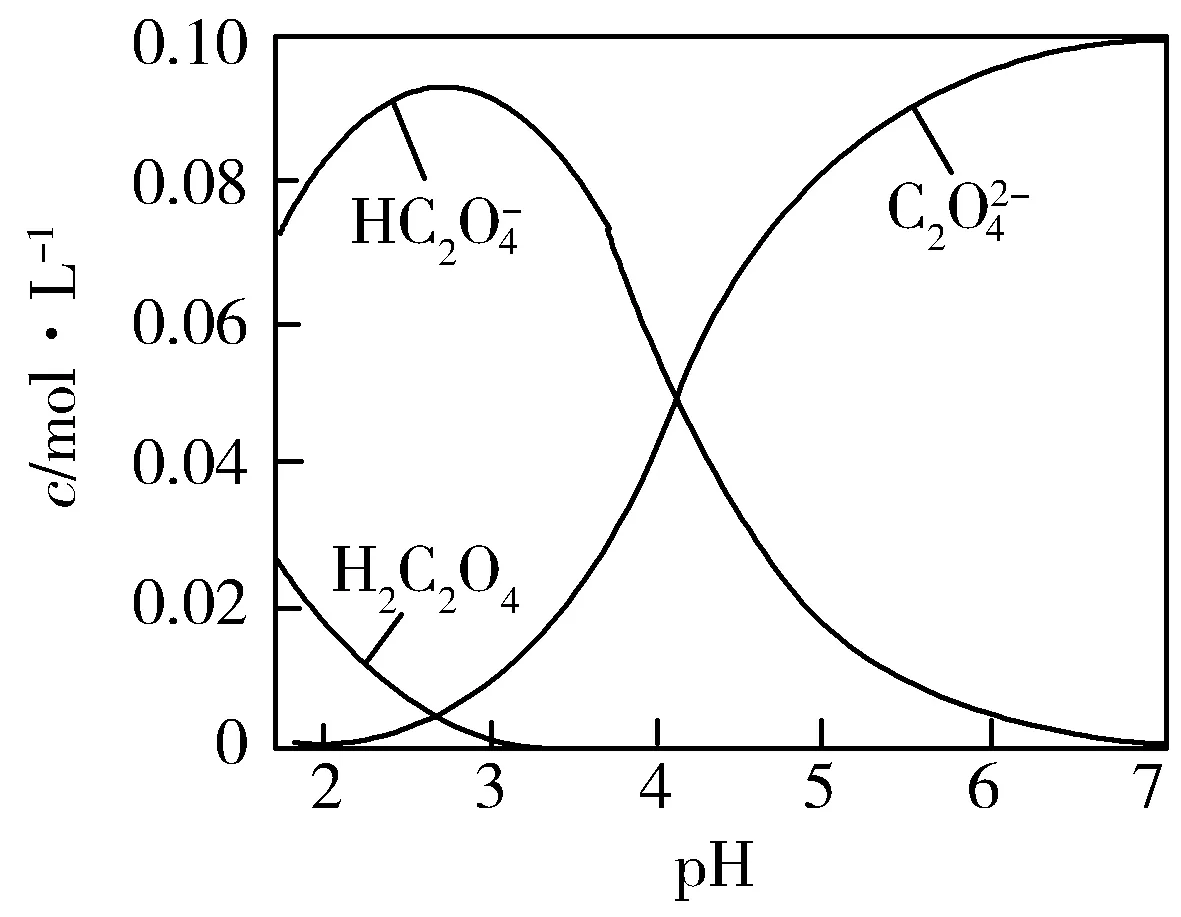
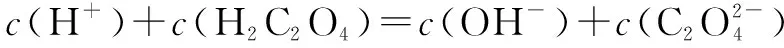
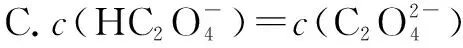

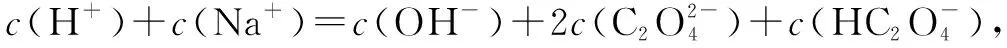
七、酸或碱的强弱未知情况下的粒子浓度关系

八、存在连续反应的溶液中的粒子浓度关系