沉淀溶解平衡考点剖析
穆玉鹏
(山东省博兴县第一中学 256500)
一、沉淀溶解平衡的基本概念
例1 下列对沉淀溶解平衡的描述正确的是( ).
A.反应开始时,溶液中各离子浓度相等
B.沉淀溶解达到平衡时,沉淀的速率与溶解的速率相等
C.沉淀溶解达到平衡时,溶液中离子的浓度相等且保持不变
D.沉淀溶解达到平衡时,如果再加入该沉淀物,将促进溶解
解析难溶电解质达到平衡时,沉淀与溶解的速率相等,各离子的浓度不变,但不一定相等.
答案:B
例2 牙齿表面由一层硬的、组成为Ca5(PO4)3OH的物质保护着,它在唾液中存在下列平衡:
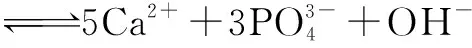
进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是 .已知Ca5(PO4)3F(固)的溶解度比上面的矿化产物更小,质地更坚固.用离子方程式表示,当牙膏中配有氟化物添加剂后能防止龋齿的原因: .
根据以上原理,请你提出一种其它促进矿化的方法: .
解析本题重点考查沉淀溶解平衡的移动知识,减小右边离子的浓度,沉淀溶解平衡向右移动,增大右边离子的浓度,沉淀溶解平衡向左移动,由此可知答案.


二、沉淀溶解平衡中溶质浓度的计算
例3 已知:某温度时,Ksp(AgCl)=[Ag+][Cl-] =1.8×10-10
求:(1)此温度下AgCl饱和溶液和Ag2CrO4饱和溶液的物质的量浓度,并比较两者的大小.
(2)此温度下,在0.010 mol·L-1的AgNO3溶液中,AgCl与Ag2CrO4分别能达到的最大物质的量浓度,并比较两者的大小.

=1.3×10-5mol·L-1

2xx
(2x)2·x=Ksp
故c(AgCl) (2)在0.010 mol·L-1AgNO3溶液中,c(Ag+)=0.010 mol·L-1 溶解平衡时: 0.010+xx (0.010+x)·x=1.8×10-10 由于x很小,因此0.010+x≈0.010 x=1.8×10-8mol·L-1 c(AgCl)=1.8×10-8mol·L-1 溶解平衡时: 0.010+2xx (0.010+2x)2·x=1.1×10-12 由于x很小,因此0.010+2x≈0.010 x=1.1×10-8mol·L-1 即c(Ag2CrO4)=1.1×10-8mol·L-1 故c(AgCl)>c(Ag2CrO4) 当难溶物溶解于水后,溶液中浓度积与溶度积有如下规则:Qi>Ksp时,溶液为过饱和溶液,沉淀析出.Qi=Ksp时,溶液为饱和溶液,处于平衡状态 .Qi 例4 将等体积的4×10-3mol·L-1的AgNO3和4×10-3mol·L-1K2CrO4混合,有无Ag2CrO4沉淀产生? 已知Ksp(Ag2CrO4)=1.12×10-12. 解析等体积混合后,浓度为原来的一半. =2×10-3mol ·L-1 所以有沉淀析出. 例5 已知室温下BaSO4在纯水中的溶解度为1.07×10-5mol·L-1,BaSO4在0.010 mol·L-1Na2SO4溶液中的溶解度是在纯水中溶解度的多少倍?已知Ksp(BaSO4)=1.07×10-10. 解析设BaSO4在0.010 mol·L-1Na2SO4溶液中的溶解度为xmol·L-1,则溶解平衡时: 平衡时浓度/mol·L-1x0.010+x =1.07×10-10 因为溶解度x很小,所以 0.010+x≈0.010 0.010x=1.07×10-10 所以x=1.07×10-8mol·L-1 计算结果与BaSO4在纯水中的溶解度相比较,溶解度为原来的1.07×10-8/1.07×10-5,即约为0.0010倍. 例6 在1.0 mol ·L-1Co2+溶液中,含有少量Fe3+杂质.问应如何控制pH,才能达到除去Fe3+杂质的目的?Ksp[Co(OH)2]=1.09×10-15,Ksp[Fe(OH)3]=2.64×10-39. 解析①使Fe3+定量沉淀完全时的pH: =1.38×10-11 Ksp[Fe(OH)3]=c(Fe3+)·c3(OH-) pH=14-(-log1.38×10-11)=3.14 ②使Co2+不生成Co(OH)2沉淀的pH: Ksp[Co(OH)2]=c(Co2+)·c2(OH-) 不生成Co(OH)2沉淀的条件是 c(Co2+)c2(OH-) =3.30×10-8 pH=14-(-log3.30×10-8)=6.50 所以应将pH控制在3.14~6.5之间才能保证除去Fe3+,而 Co2+留在溶液中. 例7 向少量的氢氧化镁悬浊液中加入饱和的氯化铵溶液,固体会溶解.对此,甲、乙同学分别作了如下解释: (1)你认为____同学的解释正确. (2)为了证明你的结论正确,可向氢氧化镁悬浊液中加入____(填序号:①硝酸铵溶液;②醋酸铵溶液;③盐酸;④醋酸钠溶液;⑤氨水),若出现____现象,则证明____同学的解释正确. 答案:(1)乙; (2)②;沉淀溶解;乙(或沉淀不溶解;甲)三、沉淀溶解平衡中的溶度积
四、沉淀溶解平衡中的同离子效应
五、沉淀溶解平衡中的除杂和提纯


六、沉淀溶解平衡中沉淀的转化