年龄相关听力损失DBA/2J小鼠耳蜗毛细胞马达蛋白-prestin表达下调与耳聋的关系
李胜利 武坤毅 任晓勇
1西安交通大学第二附属医院科研中心实验室(西安710004)
2西安交通大学第二附属医院耳鼻咽喉头颈外科(西安710004)
老年性聋亦称年龄相关性听力损失(age-related hearing loss AHL),是以听觉器官退行性改变为主要表现,老年性聋的显著特点是渐进性和高频听力损失。遗传和环境因素是导致老年性聋发生的主要原因[1,2]。随着老龄社会的到来,老年性耳聋问题逐渐突出,成为一个重要的社会问题[2,3],不仅给老年人的生活和社交活动造成很大的困难,而且可严重影响老年人的生活质量,给个人、家庭和社会带来沉重的负担[3,4]。目前,老年性聋的发病机制尚不完全清楚,预防和治疗方面的策略更是严重缺乏[1,5-8]。
哺乳类耳蜗外毛细胞(outer hair cell,OHC)呈长圆柱形,在声机械刺激下沿其长轴具有伸长和缩短的劲度改变响应。1985年Brownell等[9]报告了耳蜗OHC受到电刺激时,细胞膜电位的变化会引起胞体的伸缩运动,且运动反应具有频率依赖性,称之为耳蜗OHC电运动。Zheng等(2000)[10]成功克隆了第一个OHC运动蛋白基因,命名为prestin[10,11],它是OHC电致运动和耳蜗放大所必需的[12]。Prestin(SLC26A5)是一种膜蛋白,它独特的分布和表达在内耳的OHCs上。它定位在OHC细胞膜的侧膜上,被认为是一种担负着OHC电致运动和提高听觉敏感性及频率选择性的物质基础[10,11,13,14]。然而,Prestin在不同的环境情况下均具有敏感的改变,诸如在耳毒性药物的使用、噪声暴露及特殊的生物分子反应[15-19]。噪声暴露后有显著的prestin基因表达上调,使耳蜗对声音的放大效应消失[20],同样噪声暴露可以使耳蜗prestin mRNA表达上调[21]。而水杨酸长期应用使耳蜗Prestin表达上调[22-24]。有研究已证明氨基糖甙类抗生素使prestin mRNA表达下调发生在毛细胞凋亡之前[25]。
但在老年性聋方面,在耳蜗OHC的prestin表达方面有一些研究,但分歧较大,Rüttiger等[26]在F344小鼠和gerbils鼠发现耳蜗毛细胞在老年性聋时prestin蛋白表达没有改变;Chen等(2009)[27]研究报道老年性聋Fischer 344/NHsd小鼠的毛细胞prestin表达下降;Chiemi(2010)[28]同样用 F344/NHsd小鼠,免疫组化显示耳蜗prestin表达增强。我们反复研究观察显示老年性聋小鼠耳蜗外毛细胞prestin的表达是下降的,说明prestin参与老年性聋的过程,可能是早期老年性聋的分子机制之一。
1 材料与方法
1.1 实验动物
实验动物DBA/2J近交系小鼠来源于南京模式动物研究所,品系编号;J000671,动物选用4周(W)、8周(W)、16周(W)和32周(W)小鼠,每组12只,共使用48只小鼠。
1.2 听功能测定方法
动物用0.75%戊巴比妥钠(0.1mg/kg)麻醉后,用美国Inteligent Hearing Smart听觉诱发电位仪测定听觉诱发点位(ABR)。用针电极插入颅顶为记录电极,两侧耳垂皮下为参考电极,鼻尖为接地电极。Click声刺激,刺激率19.1/ms,高通300,低通3000,平均叠加512次,具体方法参照我们以前的方法(Li等,2008)[29]。
1.3 耳蜗铺片及观察方法
各组动物测定ABR后,在麻醉状态下,快速断头,迅速取出听泡,分离出耳蜗,在解剖显微镜下(OLYMPUS,TOKYO,297261),用纤细钢针在耳蜗尖顶钻一小孔,将前庭膜挑破,再挑破圆窗膜和卵圆窗膜,并在耳蜗底回骨隆起出,钻一小孔,看到外淋巴液溢出。马上用细的滴管吸取0.5%的硝酸银溶液,从蜗尖的小孔和两窗反复灌入。用双蒸馏水洗涤数次,再灌入10%的福尔马林固定液。在日光下曝光2-4小时。在解剖显微镜下分离铺片。逐回将基底膜按次序放置在载玻片的甘油中,辨识正反面无误后,加盖盖玻片,供光镜观察和进行毛细胞计数。
1.4 耳蜗毛细胞计数
在光镜下(Nikon DS-fi1),耳蜗放大40倍,从耳蜗顶回开始逐个视野连续计数内外毛细胞存在和消失的数目,外毛细胞分排记录。存在毛细胞的主要标志是毛细胞静纤毛完整,内毛细胞呈眉形,外毛细胞呈“V”字形,深染或淡染,但“V”字形完整的均视为正常存活的毛细胞;消失的毛细胞处“V”字形或眉字形消失,由支持细胞上皮填充,连续多个毛细胞消失处,由上排或下排存在的毛细胞估算出其消失数。计数完后,将三排外毛细胞的存在数与消失数由耳蜗顶部到基底部逐个视野相加,计算出毛细胞损害的百分数。将同一组的多个耳蜗在同部位的数字统计,制做出耳蜗全基底膜的毛细胞损害的耳蜗图。
1.5 全耳蜗铺片prestin抗体染色
动物麻醉后,快速断头,分离出小鼠耳蜗,在体视显微镜下用纤细钢针在耳蜗顶回钻一小孔,沿基底膜挑破前庭膜,同时挑破圆窗膜和卵圆窗膜,将4%多聚甲醛滴注入耳蜗内。将标本浸入在4%多聚甲醛中4℃固定4h,将耳蜗置入装有PBS缓冲液的培养皿中,在解剖显微镜下分离出耳蜗基底膜。将分离出的耳蜗基底膜在PBS溶液中漂洗3次(5min/次)。0.5%Triton 1h,将清洗后的基底膜标本加入10%正常羊血清Blocker封闭30min,再用PBS溶液漂洗3次(5min/次)。将清洗后的基底膜标本加入配好的一抗anti-prestin(1:500,3%羊血清溶液稀释)放入37℃温箱中过夜,次日取出标本用PBS溶液漂洗3次(5min/次)。将清洗后的基底膜标本加入二抗(1:200,PBS溶液稀释)标记Alexa Fluor-488山羊抗兔抗体(1:100,PBS溶液稀释),室温下1h;然后在PBS溶液漂洗3次(5min/次)。滴有DAPI核染液30min后的最后将标本平铺载玻片上,用激光共聚焦显微镜观察(Leica TCS SP8),用Image J软件分析荧光强度。
1.6 耳蜗基底膜全蛋白提取和蛋白印迹实验(Western blotting)
过量0.75%戊巴比妥钠麻醉小鼠,迅速断头取出骨迷路,在干冰预冷的0.1 mol/LPBS中剥离耳蜗,取出基底膜组织,并在裂解液RIPA中粉碎,冰浴中多次剧烈振荡使组织充分裂解,离心后收集上清液。按照BCA试剂盒说明,用酶标仪测量蛋白溶液浓度,以每孔20 μg的上样量行SDS-PAGE凝胶电泳,用湿转法将蛋白电转移至规格为0.45 μm孔径的PVDF膜。经5%脱脂奶粉的TBST溶液封闭1h后,用适当稀释的抗鼠β-actin抗体、羊抗小鼠SPAG6抗体或兔抗小鼠prestin抗体在3%奶粉TBST溶液中过夜孵育(4℃,≥8 h)。用PBS洗涤PVDF膜3×10 min/次,用相应辣根过氧化物酶偶联的二抗室温下水平缓慢摇动孵育1~2 h,用PBS洗涤3×10 min/次,加入发光底物,在暗室内进行医用胶片的曝光并采集胶片图像。
1.7 统计分析
采用GraphPad Prism软件,比较组与组之间单个点的差别采用t检验或Mann-Whitney检验,比较两个实验组在一个或一个以上变量下多个点(不同时间)之间的差别使用ANOVA。各实验均重复3次或以上,非变量数据使用Mann-Whitney检验分析,多变量使用方差(ANOVA)分析,应用Graph-Pad Prism软件进行统计分析。以P<0.05为差异有统计学意义。
2 结果
2.1 ABR反应阈值的改变
4W与8W龄DBA/2J小鼠的ABR反应阈值基本在30到40dBSPL之间,只是8W龄DBA/2J小鼠的ABR反应阈值均值较4W龄DBA/2J小鼠的ABR反应阈值高,达到58至60dBSPL;到8W龄DBA/2J小鼠的ABR反应阈值明显提高,达到60到70 dBSPL之间;到16W龄DBA/2J小鼠的ABR反应阈值明显提高,达到70到80 dBSPL之间;而到32W时ABR反应阈值均值在80到100dBSPL以上。而且频率越高,ABR阈值升高更显著。各周龄DBA/2J小鼠的ABR反应阈值平均值比较见图1A,随年龄增长,各组动物的ABR各波的潜伏期延长(见图1B)。失,中回有80%的消失,顶回有30%的消失;DBA/2J老化小鼠到32W时,基底回OHCs已全部消失,中回也基本消失殆尽达99.5%,顶回的OHCs有80%左右消失。证明DBA/2J老化小鼠的耳蜗毛细胞从基底回到顶回快速的消失。各周龄耳蜗外毛细胞消失在耳蜗部位分布见图2。
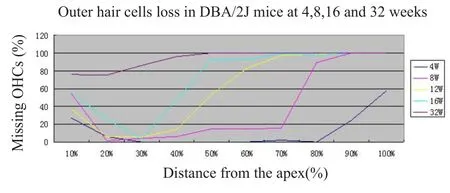
图2 4W,8W,16W和32WDBA/2J小鼠耳蜗毛细胞从顶回到基底回消失计数。随周龄增加,小鼠耳蜗毛细胞损害消失快速增加,毛细胞损害从基底回开始,快速向顶回发展,到32周龄时,仅顶回有少量毛细胞存在,其余各回毛细胞已基本消失。Fig.2 Mean cochleograms obtained from the cochleae for 4,8,16 and 32 weeks age old of DBA/2J mice.The DBA/2J mice agr was increased that the OHCs missing was raising from base to apex of the cochlea.The OHCs losses were greater at base of 32 week mice and increased toward the apex,there was severer missing of the OHCs.

图1 A.DBA/2J小鼠各周龄的ABR阈值分布,随周龄增加,听力阈值明显升高。Fig.1 A Representative ABRs threshold of DBA/2J at 4,8,16 and 32 weeks mice,the results shown are elevated by following age-related increse.

图1 B.各周龄DBA/2J小鼠脑干听觉诱发点位ABR各波潜伏期各组之间具有显著差异(P<0.05)。Fig.1 B The ABR latency was long at 8,16 and 32 weeks age of DBA/2J mice.There was significant difference was found between 16 and 32 weeks age old mice(P<0.05).
2.2 耳蜗毛细胞的消失
耳蜗铺片光镜下行全耳蜗毛细胞记数,可见4周龄DBA/2J小鼠的耳蜗基底回有56.35%外毛细胞(OHC)消失,中回仅有个别消失,顶回有11.07%的OHC消失,外毛细胞消失是从耳蜗基底部的80%处开始;到8W时,DBA/2J小鼠的耳蜗基底回有97.85%OHC消失,中回12.7%OHC消失,顶回近20%的OHC消失,外毛细胞消失是从耳蜗基底部的0%处开始;而12W和16W的DBA/2J小鼠耳蜗毛细胞消失均从50%的耳蜗处开始,说明近乎一半的外毛细胞消失;16周龄时基底回OHCs完全消
2.3 prestin在耳蜗表达的改变
在4W时OHC prestin马达蛋白的表达从基底回到顶回均有强列的表达,基本上是OHC特异染色,而IHC染色较淡;正常OHC prestin免疫组化标记细胞膜为亮绿色,呈圆环状,OHC损害早期表现为prestin标记的圆环状变形或不规则形状,OHC消失后prestin无标记(图3a,b,c);到8W时耳蜗OHC prestin的表达整体下降,与4W时相比表达下降十分显著(P≤0.01);到16W时,耳蜗OHC prestin的表达下降更明显(图3B),图象分析对荧光进行光密度测量,可见随增龄改变其耳蜗外毛细胞的prestin马达蛋白的表达下降(图3d)。与其相对应的是ABR反应阈值随增龄显著升高。
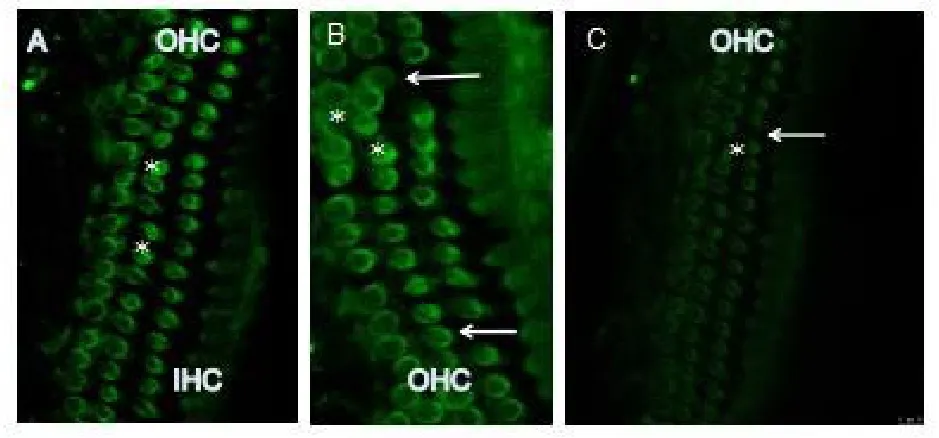
图3a正常OHC prestin免疫组化标记细胞膜为亮绿色,呈园环状,OHC损害早期表现为prestin标记的圆环状变形或不规则形状(星号),OHC消失后prestin无标记(箭头)(图3A,B,C);Fig.3a Immunofluorescent staining of DBA/2J mice OHCs for prestin in situ whole-mount preparation,three rows of OHCs consequently disappeared.A typical image of prestin immunoreactivity in the cochlear OHCs of 4 week old mice.The circular immunolabeling in the three rows of OHCs,indicated by the arrows is clearly visible.Green colors represent prestin labeling,respect.Prestin staining shows a ring-labeling pattern only in the OHCs area.In the 8 week age-old mice cochlea of OHCs shown have a few loss in apex turn,middle and basal turn there is a larger OHCs loss as arrow indicate,the surreal OHCs prestin expression was decrease at baes turn(B,C)(arrowheads).
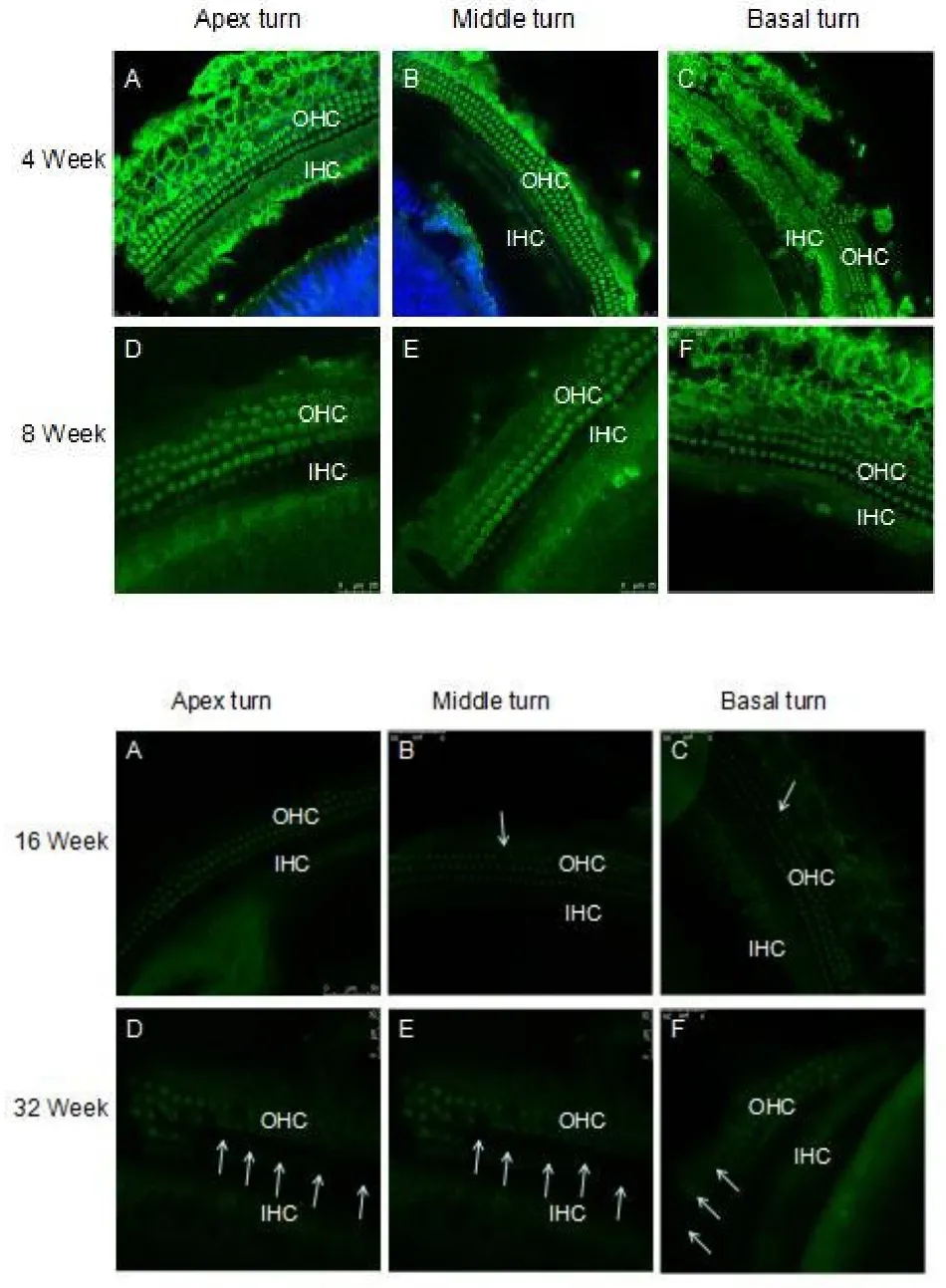
图3b各周龄DBA/2J小鼠耳蜗毛细胞prestin表达情况。4周龄(week)(A-C)较 8周龄(week)(D-F)耳蜗外毛细胞(OHC)的prestin表达在耳蜗各回明显强。Fig.3b Immunofluorescent staining of DBA/2J mice OHCs for prestin in situ whole-mount preparation,three rows of OHCs consequently disappeared.A typical image of prestin immunoreactivity in the cochlear OHCs of 4 week old mice.The circular immunolabeling in the three rows of OHCs,indicated by the arrows is clearly visible.OHC1,OHC2 and OHC3 indicate the first,second and third rows of OHCs.Green colors represent prestin labeling,respect.Prestin staining shows a ring-labeling pattern only in the OHCs area.An optical transversal section of confocal image of immunofluorescent staining of the cochlea was shown the 4 week age-old that three rows of OHCs is all present,not OHCs missing and the prestin staining strong from apex to basal turn(A-C).In the 8 week age-old mice cochlea of OHCs shown have a few loss in apex turn,middle and basal turn there is a larger OHCs loss as arrow indicate,the surreal OHCs prestin expression was decrease then 4 week age-old mice(D-F).
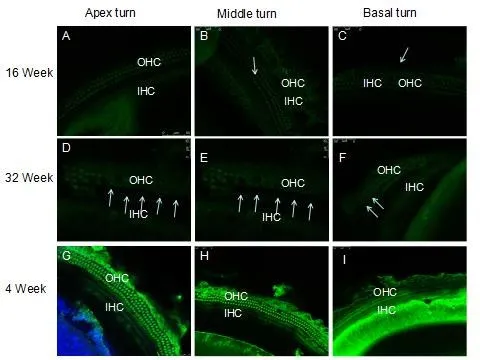
图 3c 16周(Week)与32周(week)耳蜗毛细胞prestin免疫组化标记显示OHC表达强度明显减弱(A-F)。32周龄小鼠耳蜗OHC消失明显增多(箭头),OHC prestin表达明显减弱(D-F)。4周龄的对照组OHC prestin表达较强(G-I).Fig.3c 16 and 32 weeks DBA/2J mice cochlea of OHCs prestin staining compare showned that 16 week age-old OHCs strong staining of prestin(A-B)then 32 week age-old,their OHCs prestin staining was more weeks(D-F)from apex to basal turn,32 week age-old mice of OHCs loss were more larger compared to 8 week-old mice.The control of 4 week group OHC shown the prestin expression more strong then 16 and 32 weeks mice(G-I).

图3d Western blotting测定耳蜗基底膜prestin蛋白光密度值。Prestin表达的蛋白印迹在80KDa,参照物为β-actin(箭头),各周龄组DBA/2J小鼠耳蜗prestin蛋白表达印迹的光密度随增龄而明显下降(A)。定量分析各组动物的耳蜗基底膜的prestin蛋白光密度值,可见随增龄耳蜗外毛细胞prestin表达蛋白量逐渐下降,各组间具有显著性差异(P<0.05)(星号)(B)。Fig.3d The intensity of the cochlea for prestin was measured the protein dense by Western blotting.The arrowhead inducate monormer and dimer blot of prestin(80KDa,),the blot intensity was decresed form 4 weeks to 32 weeks age-old mice samplea(A).Quantitative analysis of prestin Western blots in 4,8,16 and 32 weeks groups,the blot intensity was decresed that there is a significantly different from 4 week mice(asterisk,P<0.01).
3 讨论
感音神经性聋,包括噪声、耳中毒性和老年性聋导致的耳蜗毛细胞及其神经细胞损害的病理基础主要是毛细胞凋亡[30-31],而检测细胞凋亡的分子技术方法包括TUNEL,Caspasis系列等主要观察到毛细胞最终死亡的结果,对于耳聋的预防和治疗研究而言,这些指标显而易见是错过了最佳时机。首先选择一种或数种在耳蜗毛细胞凋亡前尚有可逆性恢复的检测指标,这种指标最理想的是首先是耳蜗毛细胞所特有的,不仅在耳蜗能检测到,而且在外周体液中亦能检测得到;其次是听功能改变和这些指标是密切关联的。我们根据目前的研究现状认为Prestin可能具有这些特点。Parham(2015)[32]推测prestin可以作为感音神经性聋早期检测的生化标志。Kourosh和Jonas(2016)[33]研究证明噪声暴露后prestin血清浓度水平较对照组明显下降。这些推测和初步实验支持我们的假设。有研究显示prestin可能在早期就参与了氨基糖甙类抗生素诱导的外毛细胞凋亡过程[17],卡那霉素下调prestin诱导毛细胞凋亡[25]。有实验表明,在外毛细胞的形态出现病变之前,prestin的mRNA水平已经出现了显著的下降,说明卡那霉素诱导的Prestin表达变化出现在毛细胞形态改变之前。虽然赵宁等观察到庆大霉素是诱导耳蜗毛细胞Prestin表达的上调[18]。尽管具体的机制还不清楚,从上述研究看prestin似乎传导了凋亡启动信号,而这个过程很可能是由细胞间的刺激因素所引发的,比如氨基糖甙类抗生素的耳毒性、噪声或其它因素。这表明prestin具有重要的听觉生理功能的同时也可能具有参与致病过程中的多重特性。因此人们猜测,prestin表达的下调似乎发挥了两种重要的功能:第一可能是预防或减少外毛细胞的凋亡;第二则可能类似于预警作用,提示外部环境具有毒性而激发听力通路上那些敏感的部分尽早做出防御性的变化。一些研究表明prestin表达变化和耳蜗出现毛细胞形态学改变之间存在一定的时间间隔,这或许提示了对于氨基糖甙类药物致聋的病人而言,可能存在一个适于进行有效治疗的时间范围[18]。而我们把此种猜测提升为把prestin作为对耳聋早期诊断和预防治疗的关键的生化指标。
在老年性聋方面,耳蜗外毛细胞prestin表达的改变有几个研究,但分歧较大,Ruttiger(2007)在F344小鼠和gerbils鼠发现耳蜗毛细胞在老年性聋时prestin蛋白表达没有改变[26],其研究缺乏蛋白定量分析;Chen等(2009)[27]研究报道老年性聋Fischer 344/NHsd大鼠的耳蜗毛细胞prestin表达下降,但方法不够全面;Chiemi(2010)[28]同样用F344/NHsd大鼠,免疫组化显示prestin表达增强。这些研究没有定量指标,况且并不是专门进行老年性聋的耳蜗毛细胞prestin表达的研究。我们的研究包括耳蜗形态免疫组化和蛋白定量Western Blot的方法,实验结果均显示老年性聋小鼠耳蜗外毛细胞prestin的表达是下降的(图b,c,d),所使用的技术方法全面,观察的动物鼠龄分布广,动物数量多。研究结果充分说明prestin参与老年性聋的病理过程,可能是早期老年性聋的分子机制之一。与上述Fischer 344/NHsd老年大鼠耳蜗prestin表达的差异可能与其研究方法及动物种系的遗传背景有关。而与噪声性聋和耳毒性药物致聋的结果截然相反,可能是老年性聋属于自然衰老,听觉器官退变导致的耳蜗prestin表达下调,这种下调是一种生理性的改变,并非是噪声性聋和耳毒性药物致聋的损害应激反应而导致的耳蜗prestin表达上调,来补偿耳蜗组织损伤造成的听力损害。这也提示我们在同样为感音神经耳聋的噪声性聋、药物中毒和老年性聋中,耳蜗prestin表达的差异,可能反映出治疗方法是应该区别对待,不可一概而论。
从早期的研究观察可以发现prestin的改变是在毛细胞或神经细胞凋亡前出现,此时的细胞基本结构存在,并且尚具有一定的功能。我们认为此时的干预治疗是一个最佳时间窗口,但这需要进行系列的研究方能确定。而选择快速老化的老年性聋动物模型是比较合适的。目前广泛应用的纯种系小鼠作为人类老年性聋或年龄相关听力损失(Age-related Hearing Loss,AHL)的重要模型的有C57BL/6J(B6),DBA/2J(D2)和 BALB/cJ(C)。DBA/2J小鼠显示非常早发和快速的渐进性感音神经性聋(Zheng 等,1999)[34]。Johnson等(2015)[35]已经证明DBA/2J小鼠老年性聋基因定位在染色体18(ahl8)并显示一个Fscn2基因的错义突变,12W DBA/2J小鼠有80dBSPL的ABR反应阈值,虽然DBA/2J(D2)和C57BL/6J(B6)种系均有AHL-易感的Cdh23 等位基因 (Noben-Trauth 等,2003)[36],而DBA/2J较C57BL/6J小鼠显示更早和更快速的听力损失(Zheng等,1999)[34]。扫描电镜分析显示DBA/2J小鼠毛细胞静纤毛异常和蜕变可能是造成快速听力损失 (Perrin等,2013;Shin等,2010)[37,38]。而Fscn2基因错义突变在DBA/2J小鼠是独特的,是在ahl8-相关听力损失的基础上的(Shin等,2010)[38],。与之相比,Fischer 344/NHs大鼠的遗传背景尚不清楚[39],而且高频听力损失到9-12个月才出现,耳蜗毛细胞损害主要是顶回及基底回的下部分,并且没有内毛细胞的损害消失(Bielefeld等,2008)[40]。我们的实验观察证明DBA/2J小鼠在一月龄时出现听力损失,耳蜗毛细胞从基底部开始出现损害消失,同时顶回亦有毛细胞消失(图2),这点和Fischer344/NHs大鼠一致,但不同的是耳蜗内毛细胞与外毛细胞同时损害消失。而存留的外毛细胞Prestin表达较强,随增龄发展,耳蜗毛细胞损害逐步增多,同时Prestin在存留毛细胞上的表达亦逐渐下降(图3a,b,c)。听力学测定亦同样证明DBA/2J小鼠的ABR反应阈值亦逐步升高,与耳蜗病理形态的改变是一致的(图1A,B)。这些特点表明DBA/2J小鼠是观察prestin表达改变理想的动物模型。
我们采用DBA/2J小鼠为老年性聋动物模型,发现4周龄(W)小鼠开始出现轻度听力下降和少量毛细胞损失;到8周龄时已经达到中度听力损失;到16周龄时已经达到重度听力损失,耳蜗毛细胞有一半损害消失;32周龄时听力已基本丧失殆尽(图1),并且外毛细胞的损害是从耳蜗基底回开始,随增龄逐渐向耳蜗中回和顶回发展。利用这种快速老化听力下降的特点,我们进行耳蜗毛细胞prestin马达蛋白表达观察,实验发现4周龄时DBA/2J小鼠耳蜗各回的prestin表达较强,仅少量毛细胞消失;而到8周龄时prestin表达强度较4周龄时下降;到16和32周龄时prestin表达强度较前更低,同时毛细胞消失也更多见(图3,b,c)。在观察prestin表达与毛细胞核存在的关系上,本实验也发现在细胞核存在时的毛细胞同时亦表达prestin。说明prestin在存活的毛细胞上表达,并且此时的听功能状态与prestin在毛细胞的表达及表达强度的存在是一致的。老年性聋耳蜗prestin表达下降的机制可能是:⑴老化导致的细胞代谢紊乱(Wu等,2004)[41],自由基蓄积、氧化应激和线粒体的损伤,Someya等(2009)报告年龄相关听力损失(AHL)的主要机制是氧化应激反应归因于Bak依赖的线粒体凋亡[42]。使毛细胞膜上的prestin蛋白合成障碍,从而导致毛细胞放大功能降低而影响听力;⑵老年性聋的耳蜗和中枢神经均有病理改变,耳蜗的血管纹、螺旋神经以及内耳的离子平衡均有改变,这些组织细胞中的信号途径异常导致prestin蛋白的表达失活,从而导致prestin在毛细胞中的表达下降;(3)老年性聋相关基因突变、缺失导致毛细胞损害凋亡,破坏了毛细胞膜的完整性,使prestin表达下降,从而导致听力丧失。这些研究说明Prestin可以作为耳蜗早期病理改变的指标。这对老年性聋的预防和治疗可能具有重要的意义。进一步的研究要明确毛细胞prestin的表达量变化与毛细胞存活或消失的直接关系,以及毛细胞prestin的表达量改变的何种指标可以达到使毛细胞损害可以逆转,进一步探讨人为操纵prestin表达上调是否可以治疗老年性耳聋,可为耳聋的预防及治疗提供更可靠的依据。

