内耳不完全分隔III型(IP-III)畸形病例分析
卢宇涵 李佳楠 孙丽 冀飞 杨仕明
1中国人民解放军总医院耳鼻喉头颈外科,聋病教育部重点实验室,聋病防治北京市重点实验室(北京100853)
2英国南安普顿大学听力学系(南安普顿SO16 1BJ)
听力障碍是困扰人们日常生活的疾病之一,先天性发病会严重影响婴幼儿的言语发育、认知和社会功能,每年因为听障人群形成的低弱劳动力对国家造成巨大的经济损失[1]。听力损失在病因学上可分为先天性和获得性,其中先天性原因导致的听力损失常常出现在出生时,可能是由于妊娠期或分娩期时特定的并发症或遗传/非遗传因素所引起[1]。由内耳畸形引起的感音神经性听力下降其病因从形态学上可分为膜性畸形(membranous malformations)和骨性畸形(bony malformations),其中骨性畸形通常可通过影像学技术如高分辨率电脑断层扫描(HRCT)和 核磁共振成像(MRI)来进行诊断[2]。不完全分隔 III型(incomplete partition type III,IP-III)作为耳蜗骨性不完全分隔畸形之一[2],1971年首次由Nance等[3]发现并将其描述为一种X染色体连锁遗传性混合型听力损失,特征为镫骨底板固定和镫骨撼动手术时井喷;Phelps等[4]在1991年首次利用影像学手段描述了其耳蜗底转与异常膨大的内听道间骨质间隔的部分缺失,确定了内耳的畸形特征。由于该畸形的结构特殊性,Sennaroglu等[5]于2006年首次将该畸形归入耳蜗不完全分隔畸形类别。因该畸形在临床上较罕见,针对IP-III的干预手段未得到广泛认可[3,5],而且在手术过程中,复杂的术中情况易造成严重的并发症甚至危及生命。因此,本文将我科自2007年至2016年间收治的11例不完全分隔III型耳蜗畸形患者的手术情况和术后效果进行回顾性分析。
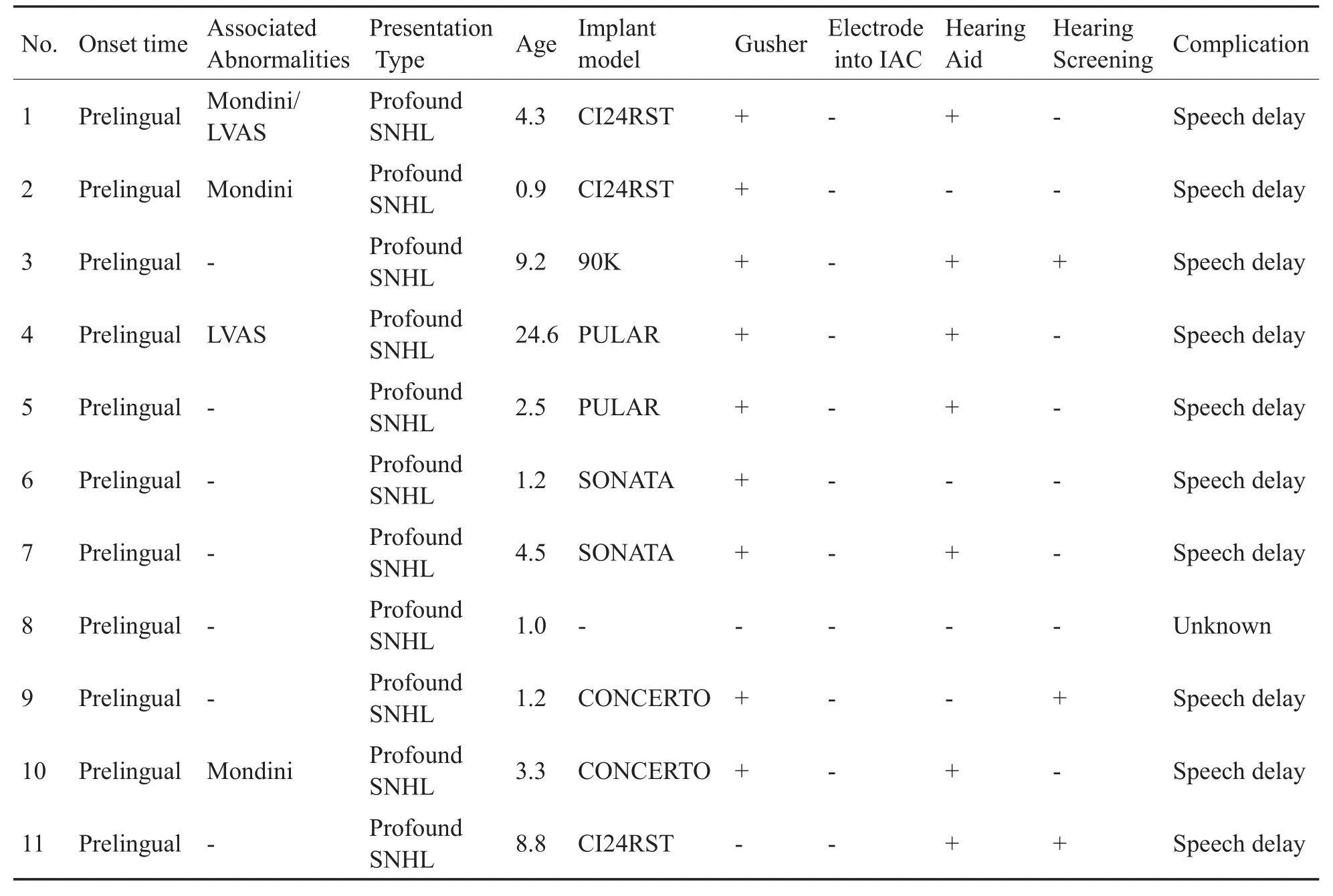
表1 纳入患者术前信息记录表Table 1 Preoperative information of included patients
1 资料与方法
1.1 一般资料
耳蜗底转与内听道间骨质间隔部分缺失为影像学特征的患者11例,均为男性,畸形均累及双侧,行人工耳蜗植入术年龄为0.9-24.6岁,平均年龄5.6±7.0岁。术前收集病史并进行术前评估,病史包括出生史、家族史、耳毒性药物用药史、助听器佩戴史等(表1)。其中出生后听力筛查未通过8例、家长发现听力反应迟钝3例;语言未发育或含糊不清、仅能发音少许单词10例,另1例未告知;患者术前有助听器佩戴史共7例。
纳入标准包括:(1)影像学示内耳IP-III畸形;(2)双耳听力纯音平均听阈为极重度听力损失和/或开放项言语识别率小于50%;(3)术前全身情况符合全麻手术标准;(4)患者监护人对人工耳蜗植入拥有合理的期望值,并签署知情同意书;(5)患者于我院首诊首治,病史及病例较完整。
排除标准:(1)患有绝对禁忌症的患者;(2)患有癫痫且频繁发作者,或患有认知障碍或其他疾病而无法配合检查和康复者;(3)患有脑白质病变、听神经病、中耳炎等特殊情况患者未签署知情同意书者。
1.2 方法
纳入患者均于术前做相关检查,包括听力学检查、影像学检查、各项术前检查、各心理智力评估、家长咨询与期望值评估。由于听力学和影像学表现是IP-III畸形的主要特征,本研究主要对纳入患者的听力学和影像学表现进行归纳评估。其中听力学仪器设备均按照国际电工委员会IEC 60645标准进行校准,隔声室本底噪声<=35dB(A)。所有听力学和影像学检查均各由一位专业无偏倚的听力学和影像学技师完成。
1.2.1 听力学检查
1.2.1.1 听力测试
采用丹麦国际听力AD222型听力计,测试在标准隔声室内进行。气导听阈测试为0.25kHz、0.5kHz、1kHz、2kHz、4kHz、8kHz倍频程的6个频率点;骨导听阈测试为0.5kHz、1kHz、2kHz、4kHz倍频程的4个频率点。若患者年龄大于5岁,且能配合听力师指令,则纯音测听测试,否则进行行为测试。行为测试的气骨导测试0.5kHz、1kHz、2kHz、4kHz共4个频率点,年龄在2.5岁-5岁间,进行游戏测听;年龄在7个月-2.5岁间,进行视觉强化测试。各项听力测试严格按照英国听力学会指南进行[6-8]。
1.2.1.2 听性脑干诱发电位
采用丹麦MADSEN ICS Chartr EP仪器。记录电极置于前额发际,鼻根部接地,左右耳乳突放置参考电极,电阻<5kΩ。采用短声(click)刺激,刺激速率21.1次/s,带通滤波100-3000Hz,开窗时间20 ms,叠加次数1024次。刺激强度依据行为学检查阈值阈上20dB开始刺激,以10 dB nHL级依次递减或递加,以能引出可重复记录到波V的最小声强作为ABR阈值。
1.2.1.3 40Hz相关电位
仪器、耳机、皮肤处理及记录电极位置与ABR测试相同。刺激声为500Hz短纯音,持续时间为100ms,刺激间隔为25ms,刺激速率为39.1次/秒,带通滤波为5Hz-40Hz,扫描时间为100ms,叠加512次,刺激强度从70 dB nHL开始,以10 dB nHL级依次递减或递加,以能引出可重复记录到波V的最小声强作为40Hz相关电位的阈值。
1.2.1.4 听觉稳态诱发电位
仪器、耳机、皮肤处理及记录电极位置与ABR测试相同。刺激声为调幅调制声,刺激声信号的载波频率为500、1000、2000、4000 Hz,放大增益100倍,调幅调制正弦频率在左、右耳分别为90Hz、82Hz、98Hz、94Hz和 88Hz、80Hz、96Hz、92 Hz。在个频率的检测均有仪器自动运行。
1.2.1.5 畸变产物耳声发射
采用丹麦MADSEN Capella耳声发射仪,测试环境为标准隔声室内,本底噪声≤30 dB(A)。用于所有患者的检测,测试频率范围0.75kHz、1kHz、1.5kHz、2kHz、3kHz、4kHz、6kHz、8kHz,参数设置为:测试音频率f2/f1=1.22,刺激声强 L1=65 dB SPL,L2=55 dB SPL。DPOAE通过标准为:(1)信噪比(SNR)大于6 dB;(2)反应幅值大于3 dB;(3)大于等于5个频率点引出记为通过。
1.2.2 影像学检查
颞骨高分辨率CT扫描仪为GE Light Speed 16,采用横断面螺旋扫描,然后进行冠状面多平面重组。扫描层厚:0.5~1.0mm,进床速度1 mm/s,螺距1mm;图像处理:用1 800内插法重建,矩阵512×512,窗宽3500~4 000 HU,窗位600~ 700HU,骨算法重建。使用SIGNAT win speed1.5T(GE)MRI扫描仪并通过相关工作台对原始数据进行三维重建。
1.2.3 统计学处理
该研究听力学检查结果保留入档,以均数±标准差()表示。
2 结果
2.1 听力学检查
11例患者均被诊断为双耳极重度感音神经性聋,检出有残余听力10例,未检出残余听力1例。其中纯音测听或小儿行为测听示气导平均听阈为104.9±20.1dB HL。Click ABR测试平均阈值为97.5±15.6dB nHL;潜伏期只引出V波3例共5耳,只引出III、V波1例共1耳,五波均引出1例共2耳,其左、右耳I-V波间期分别为4.27ms和4.25ms,V波耳间差为0.03ms。40Hz相关电位测试示平均阈值为113.5±16.7dB nHL。ASSR测试示平均阈值为103.9±14.7dB HL。DPOAE测试示双耳均未引出。(见表2)
2.2 影像学检查
11例患者颞骨CT平扫均提示双侧耳蜗底转与内听道底的骨质间隔部分缺失,蜗轴缺失,内听道扩大(图1a,1b.),内听道水成像示蜗后神经发育良好(图2c,2d.)。其中单纯IP-III型耳蜗畸形7例,占63.6%(7/11),合并大前庭水管综合征(large vestibular aqueduct syndrome,LVAS)1例(图 3f.),占9.1%(1/11);合并IP-II型(Mondini)耳蜗畸形2例(图3e.),占18.2%(2/11);合并IP-II型耳蜗畸形、大前庭水管综合征1例,占9.1%(1/11)
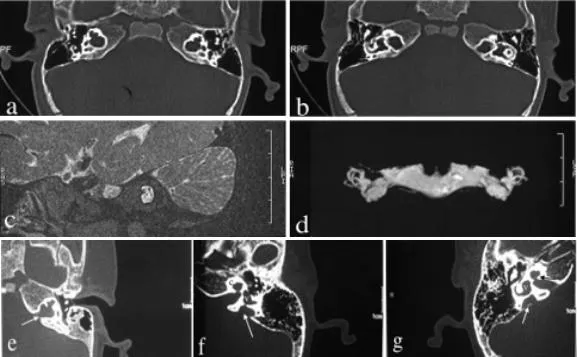
图1 a/b:颞骨CT轴位,示双侧耳蜗底转与内听道底的骨质间隔部分缺失,蜗轴缺失;内听道底异常膨大,与耳蜗底转融为一大腔。c/d:内听道水成像示前庭上神经、前庭下神经、蜗神经、听神经发育良好 e:双侧IP-III型耳蜗畸形伴Mondini畸形,男,10个月,双侧极重度感音神经性聋,耳蜗底圈与膨大的内听道底相通(白色箭头),中回与顶回融合,未见正常蜗轴。f:双侧IP-III型耳蜗畸形伴前庭导水管扩大,男,4岁2个月,双侧极重度感音神经性聋,耳蜗底转与内听道相通,蜗轴缺失,前庭导水管扩大(白色箭头),前庭异常膨大。g:双侧IP-III型耳蜗畸形伴Mondini畸形、LVAS,男,4岁3个月,双侧极重度感音神经性聋,耳蜗底转与内听道间骨板部分缺失(黑色箭头),顶回与中回融合合并蜗轴缺失,前庭导水管扩大(白色箭头)。Fig.1 a/b:CT showed a partial absence of the bony interval between the cochlear and the internal auditory canal;the modiolus was absent;the internal auditory canal was abnormally enlarged,transforming into a large cavity at the bottom of the cochlear.Figure 2 c/d:imaging showed a good development of the vestibular nerve,the cochlear nerve,and the auditory nerve.Figure 3e:Bilateral IP-III malformation with Mondini malformation;Male patient,aged of 10 months,bilateral severe to profound sensorineural hearing loss.CT showed the bottom of the cochlear directly linked the enlarged internal auditory canal(white arrow).Classical characteristics of Mondini had existed with the absence of the modiolus.f:Bilateral IP-III malformation with LVAS.Male patient,aged of 4 years and 2 months.Bilateral profound sensorineural hearing loss.cochlear gyrus and internal auditory canal fused into an enlarged cavity with an absence of the modiolus(white arrow).the vestibule was abnor
2.3 手术情况
患者均行全麻手术,患者仰卧,头偏对侧耳,以1%碘酒和75%酒精消毒植入耳及耳周头部皮肤,铺手术巾。显微镜下观察鼓膜完整,沿耳后弧形小切口进入,用电钻切除乳突气房,暴露鼓窦入口和砧骨短脚,并以此为标志确定面隐窝位置,打开面神经隐窝并确定圆窗龛,暴露鼓阶后常有大量无色清亮液体涌出,考虑为脑脊液,本研究中出现“井喷”共9例(9/11,81.8%)。将人工耳蜗作用电极自面神经隐窝放入至鼓阶后,取数块肌肉填塞放入电极的鼓阶入口以固定电极并封闭脑脊液漏,确定无脑脊液漏后取小块肌肉填塞面神经隐窝。在必要情况下用术中CT观察植入电极位置,确认其全部植入而未进入内听道(本研究中共两例采用术中CT检测;图2h.);用计算机检测各植入电极阻抗和神经反应遥测,无异常后缝合皮下组织、封闭切口,结束手术。清醒后拔管,安返病房。术后检查有无面瘫。术后均无脑膜炎并发,行X射线检查后可见作用电极均植入于耳蜗鼓阶中。

表2 纳入患者术前听力学检查结果Table 2 Preoperative audiological results of included patients
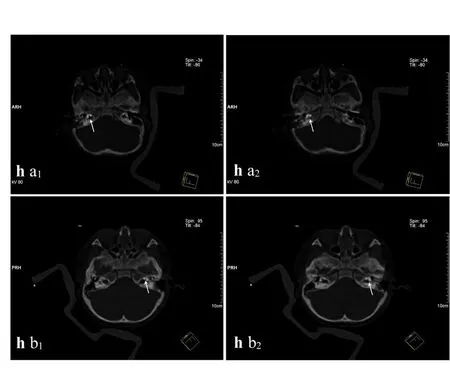
图2 两例术中CT检测人工耳蜗电极植入位置Fig.2 CT resources of the cochlear electrode position in the intraoperation in two cases
3 讨论
内耳畸形是先天性感音神经性耳聋的致病因素之一,严重危害语前聋患者的言语发育,进而导致认知功能的异常。耳蜗不完全分隔畸形III型是POU3F4(DFNX2)基因突变导致的X连锁遗传性耳聋,临床上常表现为男性发病,女性携带,与本研究患者性别相符。尽管该畸形常见于男性,但有报道女性携带者会表现出比男性畸形较轻微的畸形,且表现轻微的听力下降[2]。有研究表明,POU3F4突变导致蜗轴的缺失和菲薄的耳蜗骨性包囊,其原因可能是来自中耳黏膜上皮的血管供应的异常[9]。
IP-III畸形作为罕见的内耳畸形,具有特征性的解剖结构。在本研究中纳入病例的影像学资料可以分辨出其典型特征,表现为耳蜗底转和内听道底的骨板缺失、内听道呈异常的“壶状”膨大;耳蜗蜗轴缺失,但形态与正常耳蜗类似;由MRI可见听神经、蜗神经、前庭神经形态较好。这些形态特征与IP-III的国内外文献报道相一致。Phelps等[4]在1991年首次表述了该畸形的三种特征:(1)内听道底呈“球根状”膨大;(2)内听道与耳蜗的不完全分隔;(3)颞骨内面神经的第一段和第二段连接处角度更偏于锐角。此后,有相关报道表明除上述特征外,IP-III畸形还表现为耳蜗蜗轴完全缺失但蜗内前庭阶、中阶和鼓阶间的隔膜完好。此外,该畸形的耳蜗整体位于内听道的前外侧,其形态、外部尺寸与正常耳蜗类似[5,10-11];在HRCT下可见包裹着耳蜗的骨性包囊比正常耳蜗的更菲薄,沿着膜迷路的轮廓似乎是由增厚的骨内膜层形成[2]。相比较正常的三层膜性包囊,IP-III的包囊可能只有增厚内骨膜层,而第二层软骨膜和第三层外骨膜可能不存在或过于菲薄,这可能也与面神经畸形有关[9]。除耳蜗的部分结构异常外,Talbot和Wilson等[12]报道了部分IP-III畸形前庭导水管的内侧起源呈不同程度的扩大;而且神经的迷路段位于耳蜗上方,并非如正常面神经缓和地折行于耳蜗底回,但IP-III畸形面神经的鼓部段和乳突段走行正常[2];虽然内听道底膨大,但MRI示听神经、前庭神经和蜗神经均正常。本研究纳入患者影像学结果与综上特征对比,均符合IP-III畸形特点,主要以蜗轴缺失、膨大的内听道底与耳蜗低回的骨板缺失为主要特征。本研究患者中仅有两名患者合并前庭导水管扩大(2/11,18%),相关临床研究曾报道了LVAS合并POU3F4突变耳蜗畸形病例,例如Talbot和Wilson等[12]报道的IP-III和LVAS合并内耳畸形4例。然而这种相关性因为在研究中样本量太少可能无法被证实,研究结果存在偏倚,故而这种假设应当在后续的临床大样本数据下验证。
IP-III畸形患者的听力损失常表现为重度-极重度感音神经性或混合型聋。本研究纳入病例经过术前行为学和电生理测试得到患者听力水平均为双耳极重度感音神经性听力损失,均无传导性聋成分。虽然Nance等[3]将IP-III畸形定义为遗传性混合型听力损失,其骨导听力损失成分被后续报道证实存在,其原因可能是因为菲薄的耳蜗骨性包囊和镫骨底板固定[2];Tang和Parnes[13]的研究与此类似,他们认为是由于颅内压传递至外淋巴液导致压力增高,施加在耳蜗导水管和镫骨底板上的压力增高,因而导致了混合型聋。但是Snik[14]等认为这种混合性聋与第三窗效应有关,因为听觉前庭系统可能因为畸形而更加敏感,增加了骨导的传导效应,因此他们认为IP-III患者的听力学结果符合单纯性的感音神经性听力损失,其听力图中的气骨导差没有传导性听力损失的意义。有学者报道了为解决骨导成分的听力损失,对患者行镫骨底板造孔术(stapedotomy)的病例,但发现术中出现严重的井喷难以控制,后续随访中患者的听力损失加重,因此对于IP-III畸形的患者,镫骨底板造孔术不应实施[2-4]。另外一种IP-III患者的听力损失类型为感音神经性,其中极重度听力损失最为常见[15],本研究纳入的11名患者均表现为极重度感音神经性听力损失。其中,ABR结果显示I-V的波间潜伏期和耳间V波潜伏期差均正常,这提示蜗后通路的完整性,与MRI神经成像结果相符。同时,其他听力学检查均提示听力损失在各个频率段上的严重程度,虽然客观听力学测试如40Hz相关电位、ASSR、ABR等的结果可以作为听力损失程度的参考,但仍存在一定的校准值,且该校准值在不同的研究中存在差异,因此,耳鼻喉医生和听力学家应当将可靠的纯音测听等主观行为测试结果作为听力损失的金标准。
对于不同听力损失程度的IP-III患者,其干预手段不同。目前对于IP-III畸形患者在人工耳蜗植入或是佩戴助听器的选择上仍存在分歧[16-18],有研究表明不同听力程度下人工耳蜗植入术后补偿效果可能不如助听器[18]。对于中度-重度感音神经性或混合性听力损失患者,需对其年龄、言语发育等进行评估,可选择助听器补偿其听力损失。而对于重度-极重度听力损失患者,符合人工耳蜗适应症者需选择至少一耳进行手术。
人工耳蜗植入电极的选择或影响患者的康复效果。IP-III耳蜗畸形患者内耳形态常表现为重度的耳蜗-内听道畸形[3,19],由于耳蜗蜗轴的缺失,螺旋神经节贴附于耳蜗壁上。Sennaroglu[11]和Papsin[20]报道对于蜗轴缺失的患者,使用全环电极可有效刺激螺旋神经节细胞。但需考虑全环电极可能会有刺激面神经的风险,因而半环电极在这方面优于全环电极[2];而相比较短电极而言,由于没有长电极增加了误入内听道的风险,因此,有学者提出使用全环电极且仅环绕耳蜗一圈则满足了对螺旋神经节的电刺激[2]。本研究中电极选择共使用直电极10例,软电极1例。其中1例软电极的使用是因为人工耳蜗植入补偿项目而由患者家属自主选择,但在术中植入时术者未将内芯拔出以避免因电极环抱而导致的短路。为避免电极误入内听道的可能性,我们使用术中CT观察电极植入位置,均无电极误入内听道的病例,本研究中并非所有病例均采用影像学手段,这需要根据耳鼻喉医生和听力师根据术中检测的结果进行选择。当电极植入后,若神经反应遥测结果不佳,且植入过程中未出现异常情况,则应怀疑电极误入内听道的可能性。而我们选择将软电极植入后,也可采用保留软电极的内芯的方式避免电极环抱导致的电极短路。
本研究发现,由于IP-III畸形患者耳蜗底转与内听道底骨板缺失,在行人工耳蜗植入术时,极有可能出现“井喷”现象(共9例9/11,81.8%),这与其他同类研究结果类似[3,7-8]。这种术中的井喷,Phelps等[4]认为是内听道内蛛网膜下腔内和耳蜗内的外淋巴液相通,因该通道畸形所导致;与之相似的是刘军等[21]认为是因为耳蜗水管扩大并与内听道之间存在窦性通道所致;而Sennaroğlu和Bajin[22]认为是因为蜗轴的缺失。然而在本研究中有两例病例未出现井喷,其中,一例为未在本院手术;另一例的手术记录未记载“井喷”相关特征,这有可能是记录时遗漏了该情况。因为该例患者为IP-III合并LVAS畸形,根据手术经验和专家研究(如刘军[22]、王秋菊[23]等),理论上“井喷”均发生于该类患者中。脑脊液漏引发的脑膜炎是很严重的手术并发症,严重时可能危及生命。本研究纳入患者手术中出现脑脊液漏时,术者在电极植入后可取肌肉或筋膜填塞于圆窗龛处,并反复观察是否渗出。李万鑫等[24]在40例脑脊液井喷的案例中发现,在处理井喷时,不推荐使用甘露醇降低颅内压,而是等到脑脊液流出压力自行减少后再植入电极;在填塞肌肉时,可将其塑形呈“哑铃状”,填塞后等待15分钟后无脑脊液流出为止。另外,不同的电极也可防止井喷和术后脑脊液外漏。Sennaroglu等[2]报道可使用FORM24电极在耳蜗底转形成一圈,以阻止井喷;有学者报道,“木塞”式电极可以防止术后脑脊液外漏[25]。
在合理的调试助听器或人工耳蜗调试并加以科学地语训,IP-III患者的听觉言语康复效果较好。本研究患者术后1年行小儿声场下行为测听示平均听力阈值(500Hz、1000Hz、2000Hz、4000Hz)为39.6dB HL,与正常耳蜗植入患者无差异,患者对声音的反应较好,但仍需专业的语训。这可能是因为本研究中患者在行MRI后发现,虽然耳蜗严重畸形,但听神经形态正常,这与国外报道相一致[2]。因为耳蜗畸形常常使得耳蜗的放大功能减弱,而听神经的畸形或缺如会导致患者对言语信号编码异常,导致异常的言语分辨。张道行[26]认为,单纯IP-III畸形患者的术后康复效果优于Mondini畸形和共同腔畸形,但手术难度会大于其他内耳畸形。术者需应当意识到手术潜在的风险,并应先行告知病患家属IP-III畸形患者人工耳蜗术后效果可能会差于无内耳畸形的同龄极重度感音神经性聋人工耳蜗植入者[27],建立合理的期望值。
当然,本研究存在一定缺陷。本研究随访资料较为局限,仅有助听下声场行为测听和言语识别率测试,这主要是因为大多数患者在开机后即离院回当地进行语训,至此后无法随访。而对于更多的言语和认知测试,如Mc Cormick言语测试、各种行为认知发育量表等,本院仍在开展的初步阶段。IP-III畸形是内耳畸形中较为罕见的类型之一,是不完全分隔畸形类别中最罕见的。干预措施可以依据患者听力损失程度和言语识别率而选择;由于特殊的耳蜗结构异常,为避免手术意外,术前的影像学检查为必须要求项。在临床实践中,对IP-III患者电极的选择须加注意;在术中需注意面神经走行,并有效控制井喷,而电极误入内听道的可能性也可以通过术中影像学手段辅助有效避免。听力学家、言语康复学家应当科学合理地进行人工耳蜗调试和语训,帮助患者提高言语功能。

