耳蜗不全分隔畸形患儿耳蜗形态与人工耳蜗术后效果评估
陈彪石颖拱月陈婧媛崔丹默魏兴梅郝欣平王杰孔颖,2刘莎,2李永新
1首都医科大学附属北京同仁医院耳鼻咽喉科,耳鼻咽喉头颈科学教育部重点实验室(首都医科大学)(北京,100730)
2北京市耳鼻咽喉科研究所
内耳畸形是导致先天性感音神经性聋的主要病因之一[1]。过去内耳畸形被认为是人工耳蜗植入的禁忌症。早期对于内耳畸形患者的人工耳蜗植入较为谨慎。1983年Mangabeira Albernaz报道了第1例Mondini畸形的人工耳蜗植入,随后有诸多其他类型的内耳畸形患者实施了人工耳蜗植入术,并且同自身相比言语识别率高于手术前[2],所以内耳畸形患者植入人工耳蜗是有效的。据文献报道,耳蜗不全分隔(Incomplete partition,IP)即其中典型表现为Mondini畸形,最常见,占内耳畸形的55%[3]。本文对植入FLEX系列人工耳蜗的不全分隔畸形患儿进行回顾性分析,目的在于量化研究不全分隔畸形患儿耳蜗形态、术后听力言语康复效果以及两者的关系。
1 材料和方法
1.1 研究对象
收集2013年9月至2015年9月期间于首都医科大学附属北京同仁医院耳鼻咽喉头颈外科进行人工耳蜗植入术的27例语前聋患儿的临床资料,进行回顾性分析。纳入标准:A所有患儿术前均进行裸耳行为测听,并经过客观听力学(包括ABR、ASSR、40Hz相关电位等)进行评估,诊断为双耳先天性重度或极重度感音神经聋;B所有患儿术前于我院行颞骨CT及内耳MRI检查;C根据Sennaroglu的内耳畸形分类方法,所有患者均存在耳蜗不全分隔畸形;D所有患者植入耳蜗产品均为MED-EL公司的FLEX系列耳蜗(耳蜗型号包括短电极、FLEX24、FLEX28);E、所有患儿术后进行正式康复训练。临床资料不全,听神经发育不良,听神经病患者除外。27例语前聋患儿中,10例为男性,17例为女性;植入耳蜗时平均年龄为20.44±10.21月,年龄最小7月,最大38月。根据畸形种类分组,将患者分为不全分隔畸形I型组(IP-I组,17例),不全分隔畸形II型组(IP-II组,10例)。收集耳蜗形态正常但是使用FLEX28型号人工耳蜗的患儿作为对照组(17例)。
1.2 方法
1.2.1 影像学评估
所有患者术前均在我院行颞骨CT检查,将原始数据图像上传至PORTAL后处理工作站进行影像后处理。以Sennaroglu等人[4-6]提出的内耳畸形分型为标准对耳蜗不全分隔畸形进行判定。不全分隔畸形I型(IP-I)表现为耳蜗缺少完整的蜗轴和隔膜;不全分隔畸形II型(IP-II)表现为耳蜗只有1½转、中间和顶端的融合到一起形成了一个囊状顶点、前庭扩大。
根据国际统一认定的耳蜗标准坐标系统[7],在显示耳蜗底转的颞骨CT层面,沿着耳蜗底转长轴方向以及蜗轴中心方向进行影像后处理获得耳蜗位图像以及与之对应的斜矢状位、斜轴位层面的颞骨影像,以圆窗中点为参考点,对骨蜗管进行测量。骨蜗管长度(CL):结合斜轴位、斜矢状位以及耳蜗位图像,以圆窗中点(a)为起点,以蜗尖(c)为终点,沿耳蜗外侧壁描绘耳蜗壁轨迹曲线,骨蜗管长度即为该曲线段的长度。耳蜗底转长径(X):在耳蜗位图像上,以圆窗中点为起点过蜗轴中心(b)到耳蜗底转外侧骨壁的距离(或圆窗中点至耳蜗对侧外侧骨壁的最大距离)。耳蜗底转宽径(Y):经过蜗轴中心并与耳蜗底转长径垂直,耳蜗两外侧骨壁之间的距离(或垂直于耳蜗底转长径,测量耳蜗两外侧骨壁最大距离)。耳蜗位图像上沿耳蜗外侧壁做一平行于耳蜗宽径的切线,经该切线的切点垂直于此线,测量距耳蜗底转内侧壁的距离,为耳蜗底转蜗管宽度(W)。在斜矢状位面于同一部位测量耳蜗底转蜗管高度(H)(如图1)。
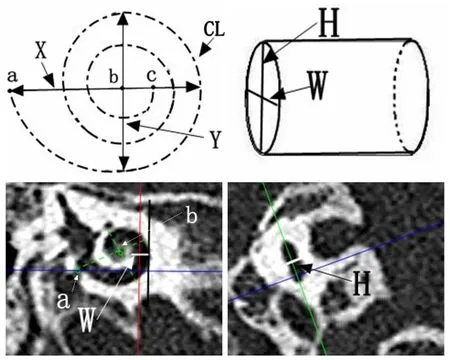
图1 骨蜗管、耳蜗底转长径及宽径、耳蜗底转蜗管宽度及高度的测量Fig.1 Measurement of length and width of cochlear canal and cochlear floor rotation,width and height of cochlear floor rotation
1.2.2 听力学评估
术后两年使用听觉行为分级标准(Categories of Auditory Performance,CAP)、言语可懂度分级标准(Speech Intelligibility Rating,SIR)、有意义听觉整合量 表(The Meaningful Auditory Integration Scale,MAIS)以及有意义言语使用量表(Meaningful Use of Speech Scale,MUSS)等量表评估患者术后听觉言语效果[8-10]。所有问卷结果均由与患儿密切接触的家长或者康复老师回答,通过面对面或电话随访获得。
1.2.3 统计学分析
使用SPSS 22.0进行统计学分析。采用单因素方差分析,比较各个组间耳蜗影像学数据是否存在差异。采用Pearson相关性分析,分析耳蜗各测量指标之间的相关性,以及术后2年听觉言语效果与耳蜗测量指标之间的相关性。检验水准取P=0.05。
2 结果
2.1 内耳畸形种类
入组患儿共27例,均为耳蜗不全分隔畸形,且双侧耳均存在内耳畸形(见表1)。

表1 27患者双侧内耳发育情况Table 1 Bilateral inner ear development in 27 patients
2.2 耳蜗影像学结果
本研究发现,IP-I组、IP-II组以及对照组的患儿骨蜗管长度存在明显差异(表2)(IP-I组与对照相比,P=0.000;IP-II组与对照相比,P=0.000;IP-I组与IP-II比,P=0.032)。表3显示不同耳蜗型号的组别间的骨蜗管长度。

表2 不同畸形骨蜗管长度测量统计Table 2 Measurement and Statistics of the Length of Cochlear Canal in Different Malformations

表3 不同人工耳蜗型号组间骨蜗管长度测量统计Table 3 Measurement and Statistics of Cochlear Canal Length among Different Cochlear Prostheses
IP-I组与IP-II组相比,耳蜗底转蜗管高度(H)与宽度(W)存在显著差异(P<0.05)。IP-I组与正常对照组相比,耳蜗底转长径(X)、耳蜗底转宽径(Y)、耳蜗底转蜗管高度、耳蜗底转蜗管宽度、X/Y值、W/H值均存在显著差异(P<0.05)。IP-II组与正常对照组相比耳蜗底转宽径(Y)存在显著差异(P<0.05)(表4)。
通过Pearson相关性分析发现IP-I组、IP-II组以及对照组的耳蜗底转长径和宽径之间存在明显正相关。IP-I组r=0.797,P<0.05;IP-II组r=0.640,P<0.05;对照组r=0.575,P<0.05。各组耳蜗底转蜗管宽度和高度之间存在明显正相关。IP-I组r=0.552,P<0.05;IP-II组 r=0.656,P<0.05;对照组r=0.870,P<0.05。
2.3 术后听觉言语效果
术后两年使用CAP、SIR、MAIS、MUSS评价患儿听觉言语康复效果,得分情况详见下表(表5)。
2.4 骨蜗管长度与术后听力言语效果相关性分析
通过Pearson相关性分析发现IP-I组骨蜗管长度与术后CAP、SIR、MAIS、MUSS得分存在明显正相关。CAP 得分r=0.664,P<0.05;SIR 得分r=0.630,P<0.05;MAIS得分r=0.545,P<0.05;MUSS得分r=0.457,P<0.05。
通过Pearson相关性分析发现IP-II组骨蜗管长度与术后CAP、SIR、MAIS得分存在明显正相关,与MUSS得分无明显相关关系。CAP得分r=0.748,P<0.05;SIR 得 分r=0.799,P<0.05;MAIS 得 分r=0.714,P<0.05。MUSS得分r=0.496,P>0.05。
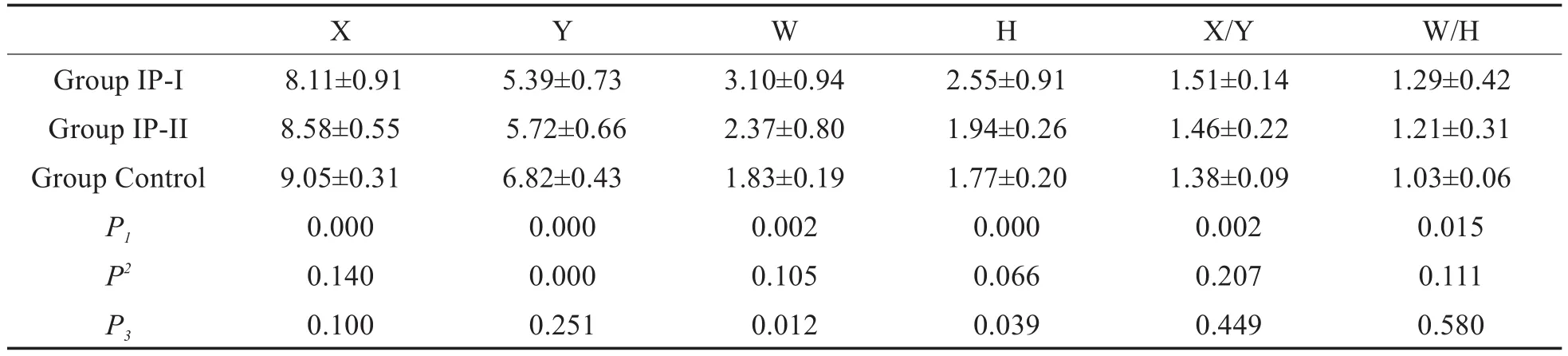
表4 IP-I组、IP-II组及对照组耳蜗底转测量结果对比Table 4 Comparison of cochlear floor rotation between ⅠP-Ⅰgroup,ⅠP-ⅠⅠgroup and control group

表5 术后2年各组听力言语效果对比Table 5 Comparison of hearing and speech effects in each group 2 years after operation
通过Pearson相关性分析发现对照组骨蜗管长度与术后CAP、SIR、MAIS、MUSS得分无相关关系。CAP得分r=0.231,P>0.05;SIR得分r=0.506,P>0.05;MAIS 得 分r=0.545,P>0.05。MUSS 得分r=0.306,P>0.05。
3 讨论
3.1 耳蜗影像学结果
本研究涉及不全分隔畸形I型、不全分隔畸形II型及正常内耳结构患者的耳蜗相关指标测量,包括骨蜗管长度、耳蜗底转长径、耳蜗底转宽径、耳蜗底转蜗管高度及宽度、耳蜗形态及耳蜗底转管径形态。对比三组耳蜗结构指标,得出耳蜗不全分隔畸形患者耳蜗测量数据与正常内耳结构患者相比存在显著差异,且耳蜗不全分隔畸形患者人群中耳蜗结构也存在较大个体差异。
国内外多位学者报道了骨蜗管长度的测量。Würfel等[11]使用锥形束计算机断层扫描测量218例受试者的骨蜗管长度,其平均长度为37.6 mm,范围为32 mm-43.5 mm;Erixon等人则通过颞骨标本测量骨蜗管长度,平均值为41.2±1.80 mm;Sato等人[9]也利用颞骨标本测量骨蜗管长度,结果平均值为38.64 mm,范围为32.7 mm-43.2mm。以往研究数据表明正常人群中骨蜗管长度差异可高达40%[11,12]。本研究中正常内耳结构患者的测量与以往报道大致相同,但也存在一定差异。本研究测量内耳结构正常患者的数值较以往报道稍小(31.19±1.88mm),可能是研究对象(儿童)、测量方法、人种等原因而造成。此外本研究还涉及IP-I及IP-II骨蜗管长度的测量(分别为20.29±4.39mm,24.35±2.92mm),结果显示耳蜗不全分隔畸形患者骨蜗管长度较正常患者明显减少,且变化范围更广。
本研究发现耳蜗不全分隔畸形患者较正常对照组而言,耳蜗底转长径和宽径偏小,且变异较大。通过比较耳蜗底转长径与宽径的比值,发现耳蜗不全分隔畸形者耳蜗形态更加接近椭圆形。如果耳蜗底转形状偏向椭圆形,电极在耳蜗内进行180°转向时,可能会导致耳蜗外侧壁及周围组织承受更大的压力,造成耳蜗内部结构的损伤;当插入电极时所遇到的阻力较大,不能够及时调整方向,耳蜗内部细微结构破坏的可能性也随之增加。就此而言,耳蜗不全分隔畸形患者出现耳蜗内部微细结构的损伤的风险较正常耳蜗明显增加。
通过比较耳蜗底转蜗管宽度与高度,发现耳蜗不全分隔畸形底转蜗管切面形态更加接近椭圆形,且变异程度较正常对照组大。这种变异可能会造成在电极植入过程中更易受到来自耳蜗内部结构的阻力,增加耳蜗内结构损伤的几率。但是由于本研究样本量限制、测量误差等原因,可能结果仍不够精确,需要进一步研究。
综上所述,耳蜗不全分隔畸形的耳蜗形态结构变异较大(IP-I尤为明显)。与正常耳蜗相比,骨蜗管长度、耳蜗底转蜗管形态存在明显差异。基于本研究所得的数据,耳蜗不全分隔畸形骨蜗管长度个体差异大,如果对这些患者使用相同长度电极的人工耳蜗,那么对于耳蜗管较长的患者而言,电极的植入深度相对较浅,可能会导致患者术后听觉言语康复效果较差;而对于耳蜗管较短的患者而言,电极植入深度相对较深,则可能会引起耳蜗内部细微组织结构的损伤,破坏螺旋神经节周围突的结构以及患者的残余听力[13,14]。同理,耳蜗管形态的多变,使电极在植入的过程中可能更容易遇到来自耳蜗内部结构的阻力,而增加耳蜗内部微细组织结构损伤的几率,可能是导致耳蜗不全分隔畸形患者术后言语康复效果不佳的原因之一。这也提示了术前进行耳蜗结构的测量以及耳蜗电极实现个性化定制的重要性,这对于IP-I患者而言意义更大。
3.2 人工耳蜗术后听觉言语功能
对语前聋CI患儿而言,当开机听到声音后,开始计算其听觉年龄,为0岁。之后患儿对声音的感知、识别、学习的过程呈现与正常儿童听觉言语发展类似的规律[15]。国内外研究表明,使用人工耳蜗时间的长短是影响术后效果的关键因素之一。患儿在人工耳蜗植入术后2年内听力言语康复效果可获得显著提高,术后1年的听觉能力康复效果的线性影响会随着植入时间的延长逐步减弱,而言语能力的发展较听觉能力的发展明显滞后[16-18]。因此本研究对IP-I和IP-II患者选择术后2年进行听觉言语康复效果评价。
对于听觉能力的评估,本组研究数据显示人工耳蜗术后2年,IP-I组、对照组之间CAP、MAIS平均得分均存在显著差异。IP-II组与IP-I组、对照组之间CAP、MAIS平均得分均无显著差异。同正常对照组及IP-II组相比,IP-I组患者的听觉康复明显滞后,这同先前报道是相一致的。2015年Suk等[19]报道CI术后4.7年IP-I患者与正常对照组之间CAP、MAIS得分相比无明显差异,但是在术后两年内IP-I组患者在CAP、MAIS得分上明显低于正常组。对于言语能力评估,本组数据显示IP-I组与对照组之间SIR、MUSS平均得分均存在显著差异;IP-II组与IP-I组、对照组SIR、MUSS平均得分无显著性差异。因此得出CI术后两年,IP-I组言语能力显著提高,但较对照组差,IP-II组与对照组间无明显差异。
术后两年IP-I组CAP、SIR、MAIS、MUSS得分与骨蜗管长度存在明显正相关。术后两年IP-II组CAP、SIR、MAIS得分与骨蜗管长度存在明显正相关,与MUSS得分无明显相关关系。术后两年对照组CAP、SIR、MAIS、MUSS得分与骨蜗管长度无相关关系。因此对于耳蜗不全分隔畸形而言,骨蜗管越长,耳蜗结构发育越好,越有利于术后听觉言语能力康复。当骨蜗管长度较长时,耳蜗内残存的螺旋神经节细胞数目可能更多,更多的螺旋神经节细胞收到电流刺激时,患者能够区别频率更加丰富的声信号,这有利于患者听觉言语能力的康复。术后两年时,IP-II组患者MUSS得分可能并不能恰当反映患者言语能力进步,从而出现MUSS结果与骨蜗管长度无相关关系。这种现象也可能是由于问卷误差、样本量小以及天花板效应等因素造成。本研究患者年龄小,植入耳蜗时间短,因此实验通过问卷方式评价人工耳蜗患者术后听觉言语能力的康复,耳蜗不全分隔畸形患者骨蜗管长度与其存在正相关关系,但是骨蜗管长度是否会影响术后患者的单词、句子、声母、韵母、音调、音乐等内容的学习与识别,仍需要进一步研究。

